核黄素复合羟丙基甲基纤维素涂膜处理对采后杨梅果实冷藏品质及抗氧化活性的影响
汪开拓,廖云霞,阚建全,韩 林,马 莉,许 凯(.重庆三峡学院生命科学与工程学院,重庆40400;.西南大学食品科学学院,重庆40075)
核黄素复合羟丙基甲基纤维素涂膜处理对采后杨梅果实冷藏品质及抗氧化活性的影响
汪开拓1,2,廖云霞1,阚建全2,韩林1,马莉1,许凯1
(1.重庆三峡学院生命科学与工程学院,重庆404100;2.西南大学食品科学学院,重庆400715)
以“乌种”杨梅果实为试材,研究了核黄素复合羟丙基甲基纤维素(HPMC)涂膜处理对采后杨梅果实在1℃贮藏期间品质及抗氧化活性的影响。结果显示,单一1mmol/L核黄素或1%HPMC处理均可有效抑制杨梅果实在整个贮藏期间腐烂率上升和品质劣变。核黄素复合HPMC涂膜处理则较单一处理更为显著(p<0.05)的抑制了杨梅果实在贮藏期间腐烂的发生,并降低了果实呼吸速率和MDA积累,从而维持了果实品质。同时,复合处理可显著(p<0.05)诱导杨梅果实在贮藏期间花色苷合成相关酶,如PAL、C4H、4-CL和DFR活性的上升,从而使经复合处理的果实中矢车菊-3-葡萄糖苷、榭皮素-3-O-芸香苷、杨梅黄酮和总花色苷含量以及DPPH自由基清除率和总还原力均显著(p<0.05)高于单一处理水平。结果说明,核黄素复合羟丙基甲基纤维素涂膜处理在采后杨梅果实保鲜领域具有良好的应用前景。
核黄素,羟丙基甲基纤维素(HPMC),杨梅,品质,抗氧化
杨梅(Myrica rubra Seib&Zucc.)属于杨梅科乔木植物,为主产于我国江南地区的亚热带水果,其具有色泽鲜艳、风味浓郁和柔软多汁等特点,故深受广大消费者喜爱,种植面积和产量逐年提高。同时,杨梅果实中富含的花色苷被证实具有清除人体内过量活性氧自由基、维持活性氧代谢平衡的作用,因而具有抗癌和抗突变的功能,并能预防糖尿病、心血管疾病和肿瘤等多种慢性病的发生[1]。但杨梅果果实组织娇嫩,在采收和贮运过程中极易遭受病原菌侵染而发生大量腐烂,果实中的花色苷类物质也迅速分解,从而导致杨梅果实采后腐烂率的上升和抗氧化活性的急剧降低[2]。常规的杨梅保鲜方法主要是通过物理(如气调、射线和热空气等)、化学(如SO2、萘乙酸、1-甲基环丙烯和茉莉酸甲酯等)和生物(如膜醭毕赤酵母和罗伦隐球酵母等)处理,从而抑制低温贮藏期间杨梅果实霉菌性病害的发生,进而延长果实贮藏期[3]。但这些保鲜处理方法有些不仅存在一定的安全隐患,而且其保鲜效果也易受到处理方式和浓度的影响。因此,寻求更有效的绿色保鲜方法一直是杨梅采后保鲜研究的热点。
可食性涂膜是近年来较为有效的果蔬保鲜方法。羟丙基甲基纤维素(hydroxypropylmethylcellulose,HPMC)作为绿色天然的纤维素衍生物,分散性和成膜性极佳,具有良好的广谱抗菌功能[4-5],已作为涂膜剂应用在柑橘[6]和葡萄[7]保鲜中。但现阶段的研究也表明,单一涂(被)膜处理存在功效单一、作用时间短等不足,保鲜效果有限,因此需要寻找其他方法与涂膜处理相结合来提高其对果实的综合保鲜效果。核黄素(Riboflavin)即水溶性维生素B2(Vitamin B2),为含有核糖醇侧链的异咯嗪衍生物,在动物性食品中有广泛分布。核黄素不仅在医学上可防治口、眼和舌等部位炎症,同时大量研究也证实核黄素作为抗性激发子可有效调控植物的一系列抗病相关蛋白和植保素的合成,从而有效抑制病原菌的侵染[8]。因此,本研究将核黄素添加进HPMC涂膜剂中,以分析该复合涂膜处理对杨梅果实在1℃贮藏期间腐烂、品质及抗氧化活性的影响,从而为杨梅果实采后保鲜技术的应用提供支撑。
1 材料与方法
1.1材料与仪器
“乌种”杨梅果实(Mycira rubra Sieb.et Zucc.Cv Wumei) 产自重庆市万州区燕山乡种植基地,采摘后2h内运回实验室,挑选无病虫害和机械伤且大小基本相同、着色均匀的商业成熟杨梅果实,25℃下自然风预冷1h左右散去田间热,随后仔细清洗并迅速风干,杨梅果实是否达到商业成熟可依据色差进行判断,当果实表面a*平均值达到或超过10时,可认为转色充分,达到商业成熟[2];苯丙氨酸、β-巯基乙醇、硫代巴比妥酸国药集团化学试剂有限公司;辅酶A、4-香豆酸、矢车菊-3-葡萄糖苷、榭皮素-3-O-芸香苷、杨梅黄酮、福林酚溶液、DPPH试剂美国Sigma公司;硼酸、硼砂、三氯乙酸、磷酸氢二钠、磷酸二氢钠、丙酮、乙醇西陇化工股份有限公司;乙腈(色谱纯) 美国Tedia公司。
LLOYD TAPlus型质构仪英国劳埃德仪器公司;UV-1600型分光光度计上海美谱达仪器有限公司;5424型台式冷冻离心机德国艾德本公司;DW-40L92超低温冰箱海尔公司;PL601-S型电子天平梅特勒-托利多公司;LC-20A型高效液相色谱仪日本岛津公司。
1.2处理方法
1.2.1含有核黄素的HPMC涂膜剂的制备HPMC膜制剂的配制参考Sánchez-González等[7]的方法进行,略有改动。准确称取HPMC 5g溶于500m L无菌蒸馏水中配成1%的HPMC溶液,随后将该溶液加热至80℃并搅拌保温2h,再冷却至30℃并重新定容至500m L后缓慢加入核黄素粉剂,使溶液中核黄素终浓度达到1mmol/L,最后用稀盐酸调节pH至6.5左右制成母液(可不添加核黄素单独制备HPMC涂膜剂母液)。母液于室温下自然冷却后用两层纱布进行过滤,再经真空泵抽真空至0.05~0.2MPa下脱气1h,随后于4℃冷库中静置过夜后再次脱气,即形成含(不含)有核黄素的HPMC保鲜膜制剂。
1.2.2处理将经挑选、预冷和75%表面消毒过的杨梅果实分为四组:a.对照组,果实不经任何处理;b.核黄素处理组,将果实浸泡于1mmol/L核黄素溶液10min;c.HPMC处理组:果实浸泡于上述制备好的1% HPMC保鲜膜制剂中10m in,并在此过程中用软塑料棒仔细翻转以确保果实涂膜均匀。浸泡完成后,将杨梅果实小心取出于不锈钢食品架上,在室温下以自然风缓慢晾干2h以在果实表面形成稳定涂膜;d.核黄素+HPMC处理组:果实浸泡溶液为含有1mmol/L核黄素的1%HPMC保鲜膜制剂,方法同处理c。处理完成后将果实用聚乙烯塑料盒(20cm×12cm×8cm)分装,置于(1±0.5)℃、90%~95%RH环境中贮藏8d。分别在果实贮藏前(0d)以及贮藏期间每隔2d取样,测定果实腐烂率、品质参数和呼吸速率;同时取样在液氮中速冻,保存于-60℃条件下,用于其余指标的测定。每组约3kg杨梅果实,整个实验重复三次。
1.3指标测定
1.3.1腐烂率杨梅果实表面出现霉菌性病斑即记为烂果。腐烂率(%)=(烂果数/总果数)×100
1.3.2硬度用TAPlus质构仪测定果实硬度,下压速度1mm/s,探头直径5mm,结果以N/cm2表示。
1.3.3可溶性固形物(TSS)、可滴定酸(TA)和pH测定
手持WYT-4型折光仪测定果实TSS含量;用标准NaOH滴定果实20m L果汁至pH 8.2来测定TA含量,结果以柠檬酸百分数来表示;用PHS-25B型pH计测定果实pH。
1.3.4苯丙氨酸解氨酶PAL、对香豆酰-CoA连接酶(4-CL)、肉桂酸羟化酶(C4H)和二氢黄酮醇还原酶(DFR)等花色苷合成相关酶活性的测定杨梅果实粗酶液参照文献[9]进行提取。PAL、C4H、4-CL和CFR酶活性分别参照Zucker[10]、Knobloch[11]、Lamb[12]和Ju[13]的方法进行测定,酶系反应液分别在290、333、340、550nm处吸光值1h增加0.001为1个酶活力单位,以上结果均以U/mg蛋白表示。
1.3.5花色苷单体及总花色苷含量的测定总花色苷含量的测定参照pH差异法进行[14];以文献[15]的高效液相色谱法测定果实中花色苷单体。以上结果均以mg/kgFW表示。
1.3.6抗氧化活性的测定以DPPH自由基清除率和总还原力来评价果实抗氧化活性。DPPH自由基清除率按照Larrauri[16]的方法进行测定,结果以DPPH自由基清除百分率来表示;还原力参考Ozsoy等[17]的方法进行测定,结果按反应液吸光值(700nm)来表示。
1.3.7呼吸速率和MDA含量的测定参照文献[18]测定杨梅果实呼吸速率。采用GXH-305型红外线CO2分析仪测定果实呼吸速率,以气体流速为1L/m in的标准CO2作对照,载气为脱CO2的空气,结果以mgCO2/(kg FW·h)表示。取1g杨梅果实冻样加入5m L 5%三氯乙酸进行匀浆,去上清液参照Hodges等[19]的TBA法测定MDA含量。
1.4数据分析
以上各指标测定除腐烂率和硬度重复10次外,其余指标均重复3次。运用SPSS 18.0软件进行数据处理分析,用邓肯氏多重比较方法进行差异显著性检验,5%为显著水平。
2 结果与分析
2.1核黄素复合HPMC涂膜处理对杨梅果实贮藏期间腐烂率的影响
如图1所示,杨梅果实在1℃贮藏期间,其腐烂率随贮藏时间的延长而逐渐上升,贮藏8d后,对照组果实腐烂率达到35.1%,果实已基本失去食用价值。1mmol/L核黄素和1%的HPMC涂膜的单一处理可显著(p<0.05)抑制杨梅果实冷藏期间腐烂的发生,贮藏8d后果实腐烂率较对照组水平分别下降了47.6%和59.6%;用含有1mmol/L核黄素和1%HPMC复合膜制剂进行涂膜处理较单一处理更为显著(p<0.05)地降低了果实腐烂率,经复合处理的果实腐烂率在贮藏后8d仅为8.7%,所以复合涂膜处理对抑制杨梅果实的腐烂效果最好。
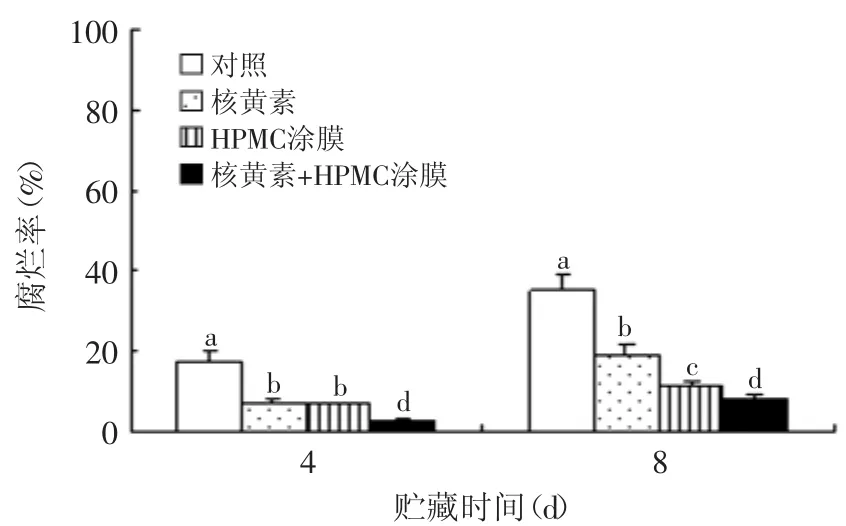
图1 核黄素复合HPMC涂膜处理对杨梅果实贮藏期间腐烂率的影响Fig.1 The effects of riboflavin in combination with HPMC coating treatmenton decay incidence in Chinese bayberries during the storages
2.2核黄素复合HPMC涂膜处理对杨梅果实贮藏期间呼吸速率和MDA含量的影响
杨梅果实在采后冷藏期间生理代谢旺盛,呼吸速率持续维持在较高水平。单一的核黄素处理对果实呼吸速率无显著(p>0.05)影响,但单一1%HPMC涂膜及其复合核黄素的处理可显著(p<0.05)降低果实冷藏期间呼吸速率,从而减慢果实底物代谢水平(见图2A)。
杨梅果实冷藏期间MDA含量逐渐上升,显示果实细胞膜脂过氧化程度逐渐加剧。经单一的核黄素处理的果实在冷藏后期其MDA含量均显著(p<0.05)低于对照水平;1%的HPMC涂膜处理较单一的核黄素处理更为显著(p<0.05)的抑制了果实MDA含量的上升,使其在整个冷藏期间均维持在较低水平;经复合处理的果实其MDA含量在整个贮藏期间显著(p<0.05)低于单一处理果实(见图2B)。所以,经复合涂膜处理的果实不仅显著降低了呼吸速率,且MDA含量也显著受到了抑制,对杨梅果实的保鲜起到了良好的作用。
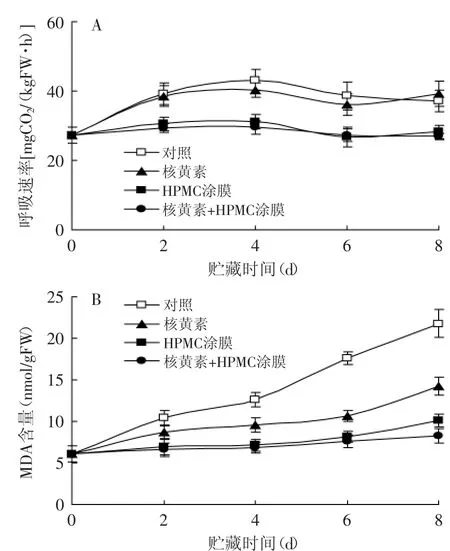
图2 核黄素复合HPMC涂膜处理对杨梅果实贮藏期间呼吸速率(A)和MDA含量(B)的影响Fig.2 The effects of riboflavin in combination with HPMC coating treatmenton respiration rate(A)and MDA content(B)in Chinese bayberries during the storages
2.3核黄素复合HPMC涂膜处理对杨梅果实贮藏期间品质的影响
如表1所示,经单一HPMC涂膜处理的杨梅果实在1℃贮藏8d后,果实中TA和TSS含量以及硬度均显著(p<0.05)高于对照组果实。核黄素复合HPMC涂膜处理较单一涂膜处理更为有效的抑制了果实软化;同时,复合处理最为显著(p<0.05)的延缓了果实pH的上升。综上所述,复合涂膜处理可以保持杨梅果实贮藏期间最好的品质指标(TA、TSS和硬度)。
2.4核黄素复合HPMC涂膜处理对杨梅果实贮藏期间花色苷合成相关酶的影响
PAL、C4H、4-CL和DFR为杨梅果实中花色苷合成的关键酶类。如图3(A)和图3(D)所示,对照果实在1℃贮藏期间PAL和DFR活性在贮藏前4d缓慢上升,随后迅速下降;而图3(B)和图3(C)显示,C4H和4-CL活性却随着贮藏时间的延长而逐渐下降。1% HPMC涂膜处理可显著(p<0.05)抑制果实贮藏后期PAL、C4H和DFR活性的下降,使这些酶活性在贮藏期后4d仍然维持在较高水平,但HPMC处理对4-CL活性在贮藏后期无显著(p>0.05)影响。核黄素则全面诱导了贮藏期间杨梅果实中PAL、C4H、4-CL和DFR活性,使其在整个贮藏期间均显著(p<0.05)高于对照果实。而核黄素复合HPMC涂膜处理,则较核黄素的单一处理更为显著(p<0.05),诱导了上述3种酶活性的提高,所以,复合涂膜处理对杨梅果实中花色苷合成酶活性均有提高作用。
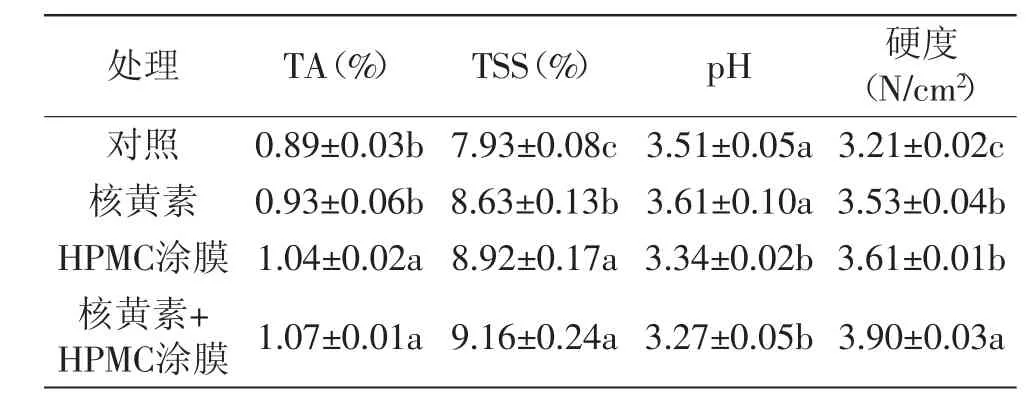
表1 核黄素复合HPMC涂膜处理对杨梅果实贮藏期间品质的影响Table 1 The effects of Riboflavin in combination with HPMC coating treatmenton quality parameters in Chinese bayberries during the storages
2.5核黄素复合HPMC涂膜处理对杨梅果实贮藏期间花色苷含量的影响
矢车菊-3-葡萄糖苷(cyanidin-3-glucoside,C3G)、槲皮素-3-O-芸香苷(quercetin-3-O-rutinoside,Q3R)以及杨梅黄酮(myricetin,MT)为杨梅中主要的花色苷类单体物质,其中C3G为最主要花色苷类单体[9]。如图4所示,对照组果实中Q3R和MT含量在1℃贮藏期间逐渐下降;C3G和总花色苷含量均在贮藏前2d缓慢上升,随后逐渐下降。单一的核黄素和HPMC涂膜处理均可显著(p<0.05)抑制果实花色苷类单体物质在贮藏期间的下降,但经两者的复合处理的果实的花色苷类物质含量在整个贮藏期间均显著(p<0.05)高于单一处理水平,所以复合涂膜处理可以使杨梅果实中的花色苷含量在贮藏期间维持最高水平。
2.6核黄素复合HPMC涂膜处理对杨梅果实抗氧化活性的影响
如图5所示,杨梅果实在1℃贮藏期间,伴随着花色苷类物质含量的下降,其DPPH自由基清除率和总还原力也随贮藏时间的延长而逐渐降低。对照果实在1℃下贮藏8d后,其DPPH自由基清除率和总还原力仅为贮藏前的57.2%和43.3%。经核黄素或HPMC涂膜处理后,杨梅果实DPPH自由基清除率和总还原力下降速度明显减慢;复合处理更为有效的延缓了果实贮藏期间抗氧化活性的降低,1℃贮藏8d后,经复合处理的果实中DPPH自由基清除率和总还原力为贮藏前的91.2%和82.9%,因而保持了较高的抗氧化活性。
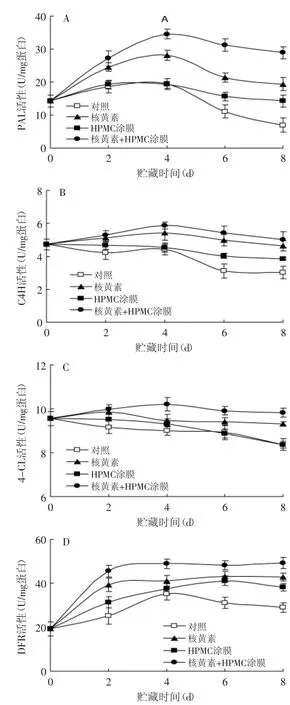
图3 核黄素复合HPMC涂膜处理对杨梅果实贮藏期间PAL(A)、C4H(B)、4-CL(C)和DFR(D)的影响Fig.3 The effects of riboflavin in combination with HPMC coating treatmenton activities of PAL(A),C4H(B),4-CL(C)and DFR(D)in Chinese bayberries during the storages
3 结论与讨论
杨梅果实采后生理代谢旺盛,低温冷藏仍然会发生严重的腐烂和品质劣变现象。涂膜处理可有效抑制果实采后病原菌侵染和衰老进程,从而维持果实品质,延长货架期[20]。HPMC为近年来新合成的纤维素衍生物,其无毒可降解,分散性和成膜性较好,作为食品涂膜剂可有效抑制多种病菌的生长[5]。研究显示,HPMC涂膜处理可显著抑制柑橘果实在贮藏期间青霉菌的侵染,并维持果实中挥发性成分的含量[6];而用HPMC对葡萄果实进行涂膜处理则显著延缓了葡萄果实在冷藏期间呼吸速率的上升,因此减少了呼吸底物的消耗,降低了果实失重率并维持了果实品质[7]。在本研究中,HPMC涂膜处理较单一的核黄素处理更为显著的抑制了杨梅果实采后1℃贮藏期间腐烂率的上升,同时有效降低呼吸速率和MDA含量,延缓果实采后衰老进程,因此减慢了果实硬度、TSS、TA含量的下降和pH的上升。核黄素复合HPMC涂膜处理较单一HPMC涂膜处理更为有效的抑制了果实腐烂并维持了果实品质。因此,在HPMC膜制剂添加核黄素可增进HPMC膜对杨梅果实的保鲜效果。
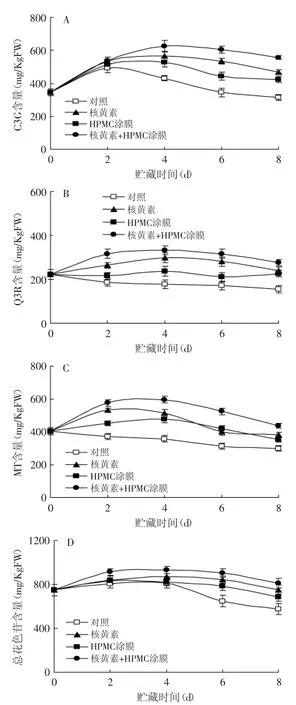
图4 核黄素复合HPMC涂膜处理对杨梅果实贮藏期间C3G(A)、Q3R(B)、MT(C)和总花色苷(D)含量的影响Fig.4 The effects of Riboflavin in combination with HPMC coating treatmenton contents of C3G(A),Q3R(B),MT(C)and total anthocyanins(D)in Chinese bayberries during the storages
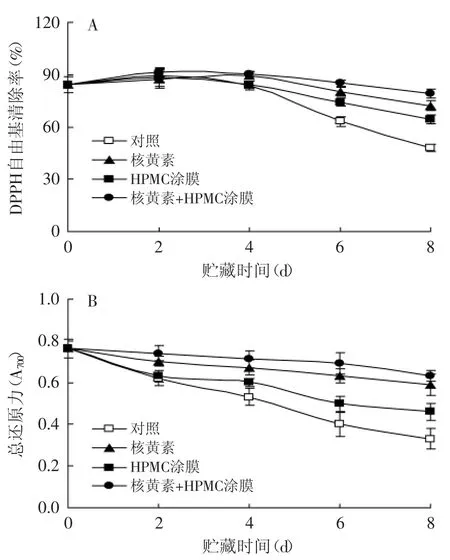
图5 核黄素复合HPMC涂膜处理对杨梅果实贮藏期间DPPH自由基清除力(A)和总还原力(B)的影响Fig.5 The effects of riboflavin in combination with HPMC coating treatmenton scavenging capacity against DPPH(A)and reducing power(B)in Chinese bayberries during the storages
杨梅果实主要功能性物质——花色苷是通过苯丙烷类代谢途径进行合成,而在此途径中,PAL是第一限速酶、C4H和4-CL则是合成花色苷前体4-香豆酰辅酶A关键酶,DFR则是合成无色花青素的关键酶,这些酶活性的大小直接关系着杨梅果实中花色苷的合成量[21]。核黄素作为化学激发子可显著诱导模式植物拟南芥[22]和烟草[23]中苯丙烷类代谢酶活性的上升,从而促进酚类物质的合成。在本研究中,单一核黄素处理较HPMC涂膜处理更为有效的诱导了杨梅果实在1℃贮藏期间PAL、C4H、4-CL和DFR酶活性的提高,因而全面促进了果实贮藏期间C3G、Q3R和MT等花色苷单体物质以及总花色苷含量的上升,进而抑制了果实DPPH自由基清除率和总还原力在冷藏期间的下降,维持了果实抗氧化活性。核黄素复合HPMC涂膜处理则较单一核黄素处理更为有效的维持了果实抗氧化活性。这些结果显示,核黄素处理可有效维持杨梅果实冷藏期间的抗氧化活性,而HPMC涂膜则增强了核黄素对抗氧化物质的诱导作用。与本研究相类似,HPMC涂膜处理复合柠檬精油也较单一的精油处理更为有效的抑制了葡萄贮藏期间抗氧化活性的下降[7]。
因此,本研究表明,单一的HPMC涂膜处理对杨梅果实有较好的品质维持作用,而核黄素则能延缓果实冷藏期间抗氧化活性的下降;两者的复合处理可达到良好的互补作用,即不仅更有效的抑制杨梅果实采后贮藏期间腐烂的发生和品质的下降,而且能全面诱导果实贮藏期间花色苷合成酶活性的上升,从而促进花色苷的合成并延缓抗氧化活性的下降,这些结果显示了该复合涂膜处理在杨梅保鲜中有良好的应用前景。
[1]Bao J S,Cai Y,Sun M.Anthocyanins,flavonols and free radical scavenging activity of Chinese bayberry(Myrica rubra)extracts and their color properties and stability[J].Journal of Agricultural and Food Chemistry,2005,53(6):2327-2332.
[2]Zhang W S,Chen K S,Zhang B,et al.Postharvest responses of Chinese bayberry fruit[J].Postharvest Biology and Technology,2005,37:241-251.
[3]巩卫琪,房祥军,郜海燕,等.杨梅采后病害与控制技术研究进展[J].生物技术进展,2013,3(6):403-407.
[4]吴俊红,王家俊,厉依俏,等.壳聚糖/羟丙基甲基纤维素包装薄膜的结构与性能[J].浙江理工大学学报,2010(1):64-68.
[5]Sánchez-González L,González-Martínez C,Chiralt A,et al. Physicaland antimicrobialpropertiesofchitosan-tea tree essential oil composite films[J].Journal of Food Engineering,2010,98:443-452.
[6]Sánchez-Moreno C,Plaza L,de Ancos B,et al.Quantitative bioactive compounds assessment and their relative contribution to the antioxidant capacity of commercial orange[J].Journal of the Science of Food and Agriculture,2003,83:430-439.
[7]Sánchez-González L,Pastor C,Vargas M,et al.Effect of hydroxypropyl methyl cellulose and chitosan coatings with and without bergamot essential oil on quality and safety of coldstored grapes[J].Postharvest Biology and Technology,2011,60:57-63.
[8]Taheri P,Tarighi S.Riboflavin induces resistance in rice against Rhizoctonia solani via jasmonate-mediated priming of phenylpropanoid pathway[J].Journal of Plant Physiology,2010,167:201-208.
[9]Wang K,Cao S,Jin P,et al.Effect of hot air treatment on postharvestmould decay in Chinesebayberry fruitand the possible mechanisms[J].International Journal of Food Microbiology,2010,141:11-16.
[10]Zucker M.Sequential induction of phenylalanine ammonia lyase and a lyase-inactivating system in potato tuber disks[J]. Plant Physiology,1968,43:365-374.
[11]Knobloch K H,Hahlbrock K.4-Coumarate:CoA ligase from cell suspension culture of Petroselinum hortense Hoffm.Partial purication,substrate specificity,and further properties[J].Archives of Biochemistry and Biophysics,1977,184:233-248.
[12]Lamb C J,Rubery PH.A spectrophotometric assay for trapscinnamic acid 4-hydroxylase activity[J].Analytical Biochemistry,1975,68:554-561.
[13]Ju ZG,Yuan Y B,Liu C L,et al.Dihydroflavonol reductase activity and anthocyanin accumulation in‘Delicious’,‘Golden Delicious’ and‘Indo’ apples[J].Scientiahorticulturae-Amsterdam,1997,70:31-43.
[14]Cheng GW,Breen P J.Activity of phenylalanine ammonia lyase(PAL)and concentration of anthocyanins and phenolics in developing strawberry fruit[J].Journal of the American Society for Horticultural Science,1991,116:865-869.
[15]Wang K T,Jin P,Shang H T,etal.Effectofmethyl jasmonate in combination with ethanol treatment on postharvest decay and antioxidant capacityinChinesebayberries[J].Journalof Agricultural and Food Chemistry,2010,58:9597-9604.
[16]Larrauri JA,Sanchez-Moreno C,Saura-Calixto F.Effect of temperature on the free radical scavenging capacity of extracts from red and white grape pomace peels[J].Journal of Agricultural and Food Chemistry,1998,46:2694-2697.
[17]Ozsoy N,Can A,Yanardag R,et al.Antioxidant activity of Smilax excelsa L.leaf extracts[J].Food Chemistry,2008,110:571-583.
[18]Wang K,Jin P,Shang H,et al.A combination of hot air treatment and nano-packing reduces fruit decay and maintains quality in postharvest Chinese bayberries[J].Journal of the Science of Food and Agriculture,2010,90:2427-2432.
[19]Hodges D M,DeLong JM,Forney C F,et al.Improving the thiobarbituric acid-reactive-substances assay for estimating lipid peroxidation in plant tissues containing anthocyanin and other interfering compounds[J].Planta,1999,207:604-611.
[20]Duan J,Wu R,Strik B C,et al.Effect of edible coatings on the quality of fresh blueberries(Duke and Elliott) under commercialstorageconditions[J].PostharvestBiologyand Technology,2011,59:71-79.
[21]张上隆,陈昆松.果实品质形成与调控的分子生理[M].北京:中国农业出版社,2007:153-164.
[22]Liu F,Wei F,Wang L,et al.Riboflavin activates defense responses in tobacco and induces resistance against Phytophthora parasiticaandRalstoniasolanacearum[J].Physiological and Molecular Plant Pathology,2010,74:330-336.
[23]Zhang S,Yang X,Sun M,et al.Riboflavin-induced Priming for Pathogen Defense in Arabidopsis thaliana[J].Journal of Integrative Plant Biology,2009,51:167-174.
Effect of riboflavin in combination w ith hydroxypropylmethyl cellulose(HPMC)coating on quality and antioxidant activity in harvested Chinese bayberries during refrigerated storage
WANG Kai-tuo1,2,LIAO Yun-xia1,KAN Jian-quan2,HAN Lin1,MA Li1,XU Kai1
(1.College of Life Science and Engineering,Chongqing Three Gorges University,Chongqing 404100,China;2.College of Food Science,Southwest University,Chongqing 400715,China)
In the p resent study,the effects of riboflavin in combination w ith HPMC coating on quality and antioxidant activity in harvested Chinese bayberries during the storage at 1℃ were investigated.The results exhibited that the treatment of 1mmol/L riboflavin or 1%HPMC coating alone could effectively inhibit the increase in decay incidence and quality deterioration in Chinese bayberries during the whole storage.The combination of riboflavin and HPMC coating more significantly inhibited decay occurrence and reduced resp iration rate and MDA accumulation in Chinese bayberries during the storage com pared w ith the either alone,which ledto maintainingthe fruit quality parameters.Meanwhile,the combinedtreatment could significantly induce the increase in the activities of anthocyanin synthesis related enzymes such as PAL,C4H,4-CL and DFR in Chinese bayberries during the storage,resulting in higher contents of C3G,Q3R,MT and total anthocyanins as well as scavenging capacity against 1,1-d iphenyl-2-pic rylhyd razyl(DPPH)and reducing power than riboflavin or HPMC app lied alone.These results ind icated that riboflavin in combination w ith HPMC coating m ightob tain a p rom ising app lication in p reservation of harvested Chinese bayberry.
riboflavin;hyd roxyp ropylmethyl cellulose(HPMC);Chinese bayberry;quality;antioxidant
TS255.3
A
1002-0306(2015)06-0331-07
10.13386/j.issn1002-0306.2015.06.064
2014-07-02
汪开拓(1983-),男,博士,副教授,研究方向:农产品贮藏与加工。
国家自然基金青年项目(31201440);国家教育部科学技术研究重点项目(212141);重庆市自然科学基金项目(cstcjjA80018);博士后面上基金项目(2014M552300);重庆市教委科学技术研究重点项目(KJ121120);第二批重庆市高等学校青年骨干教师资助计划(2014046);重庆三峡学院科研创新团队建设计划(201302);重庆三峡学院2014年度大学生创新性实验计划。

