醇洗法纯化高温花生粕分离蛋白的研究
张慧娟,李莹莹,王 静,刘英丽,周凯文
(北京工商大学食品添加剂与配料北京高校工程研究中心,北京100048)
醇洗法纯化高温花生粕分离蛋白的研究
张慧娟,李莹莹,王静*,刘英丽,周凯文
(北京工商大学食品添加剂与配料北京高校工程研究中心,北京100048)
以碱提酸沉方法提取高温花生粕蛋白,利用响应面法进行醇洗优化,在提高其蛋白质含量的基础上,研究醇洗对该蛋白的功能特性的影响。实验结果表明,在乙醇浓度为80%、醇洗时间为180min、料液比为1∶15、醇洗温度为50℃时,得到的蛋白质含量最高为79.21%。经过醇洗后,产品的持油性有所改善,乳化及乳化稳定性、起泡及起泡稳定性均显著降低。
高温花生粕,醇洗,响应面法,蛋白质
花生(Arachis hypogaea L.)属于豆科,一年生草本,又名落花生、地豆、地果、具有补虚、益寿、抗衰老、美容之功效,因而被称为长生果[1]。它是全世界公认的健康食品,在我国被认为是“十大长寿食品”之一[2]。
在我国,每年50%~60%的花生都用来榨油,花生经过榨油后的副产品—花生粕营养成分含量很高,其中含有丰富的蛋白质资源以及一些不溶性的花生纤维成分,具有很高的利用价值[3]。我国的花生蛋白产业起步较晚,基础薄弱,大部分产品都处于初级加工阶段。传统榨油方法会产生大量的高变性脱脂花生粕,这种副产物主要应用于饲料或食品加工原料等领域,花生资源的巨大潜能在经济效益和社会效益上未能得以发挥。现在我国花生制油业每年约有上百万吨的高温花生粕,具有很大的开发和研究利用价值[4],其研究前景十分广阔。
目前花生粕蛋白的提取方法有碱法、酶法及物理法等。对于花生粕蛋白的研究往往集中于单一的提取方法,本研究以传统碱提酸沉法提取出高温花生粕分离蛋白,在此基础之上进行乙醇洗涤,探究其对蛋白质含量的影响,同时对醇洗后花生粕分离蛋白的功能特性进行测定,为花生粕蛋白的深层研究奠定理论基础。
1 材料与方法
1.1材料与仪器
高温花生粕山东鲁花花生油有限公司;氢氧化钠、五水合硫酸铜、硫酸钾国药集团化学试剂有限公司;盐酸、无水乙醇、硫酸北京化工厂;甲基红、溴甲酚绿天津市光复精细化工研究所;硼酸北京益利精细化学品有限公司;十二烷基硫酸钠(SDS)天津市福晨化学试剂厂,所用试剂均为分析纯。
HT-500型多功能粉碎机郑州华通机械厂;AL204型电子分析天平梅特勒-托利多仪器(上海)有限公司;3K15型冷冻离心机德国SIGMA Laborzentrifugen GmbH;Starter2000型pH计美国奥豪斯(上海)有限公司;MODULYOD型冷冻干燥机美国Thermo Electron Corporation;DZF6050型真空干燥箱南京瑞奥电热科技有限公司;DKL8型半自动消化炉意大利VELP科技有限公司;UDK159型全自动凯氏定氮仪意大利VELP科技有限公司;IKA T18型高速分散机上海楚柏实验设备有限公司。
1.2实验方法
1.2.1碱溶酸沉法提取花生分离蛋白依据高云中[5]的方法,略有改动,具体步骤如下:用高效粉碎机粉碎高温花生粕,将粉碎物均匀过80目筛,封装4℃保存。将过筛后的原料按1g/10m L加入去离子水,用1.0mol/L NaOH溶液调节pH到9.5,保持pH不变,60℃下水浴搅拌浸提2h,4℃下以9000r/m in离心15m in,将上清液倒入洁净烧杯,取沉淀进行复提,按原来加水量的80%加入去离子水,并按上述方法重新提取,合并上清液,冷冻干燥20h得到花生分离蛋白。
1.2.2花生分离蛋白含量的测定采用凯氏定氮法[6]测定蛋白含量。
1.2.3乙醇洗涤花生分离蛋白的优化实验
1.2.3.1单因素实验通过控制洗脱时间90m in,温度50℃,料液比1∶9,改变乙醇浓度,采用50%、60%、70%、80%、90%5个浓度进行洗脱,然后分别测定洗脱后蛋白质的含量,选出最优值;选择最佳乙醇浓度,洗脱时间90m in,温度50℃,改变料液比,采用1∶7、1∶9、1∶11、1∶13、1∶15、1∶17 6个比例进行洗脱,然后分别测定洗脱后蛋白质的含量,选出最优值;在最佳乙醇浓度、最佳料液比、温度50℃的条件下,改变洗脱时间,采用60、90、120、150、180、210m in 6个时间进行洗脱,然后分别测得洗脱后蛋白质的含量,选出最优值;在最佳乙醇浓度、最佳料液比、最佳洗脱时间下,改变洗脱温度,采用45、50、55、60、65℃5个温度进行洗脱,然后分别测定洗脱后蛋白质的含量,选出最优值。
1.2.3.2响应面法因素水平表的确定采用响应面分析法对醇洗工艺进行优化。根据单因素实验所得结果,确定了响应面因素水平表1。

表1 花生蛋白提取Box-Behnken设计实验因素水平及其编码表Table 1 Box-Behnken design test factors and levels and coding table by peanut protein
1.2.4花生分离蛋白乙醇洗涤前后的性质对比
1.2.4.1分离蛋白的持水性(WHC)测定准确称取0.1g样品分散于5m L水中,室温条件下200r/m in搅拌30m in,3000r/m in离心30m in,弃去上清液,称沉淀质量,按下式计算持水性[7]。

1.2.4.2分离蛋白的持油性(OHC)测定准确称取0.3g样品于10m L离心管中,加入2m L大豆油,在室温25℃静置1h,3000r/m in离心30m in,倒掉上清液,10m in后称量沉淀的质量,按下式计算持油性。

1.2.4.3分离蛋白的乳化性及乳化稳定性测定将样品蛋白配制成浓度为1%(g/m L)的悬浊液,用0.1mol/L HCl或者NaOH将pH分别调为3.0、5.0、7.0、9.0,然后与5m L大豆油混合后均质1m in,均质速度为10000r/min。在0min和20min时分别用移液枪从容器底部吸取100μL样品,与4.9m L浓度为0.1%SDS混合,然后在波长500nm处测定样品吸光度值[8]。
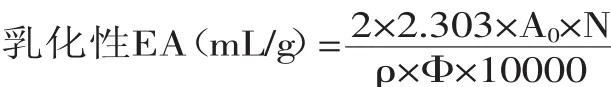
式中:A0—均质后迅速被稀释的乳化液的吸光度;ρ—为蛋白质的质量浓度(10g/L);N—为稀释倍数;Φ—为乳化液中油的体积分数(本实验是0.25)。
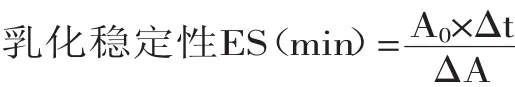
式中:Δt—两次测量之间的时间间隔;ΔA—Δt时间间隔内乳化液吸光度的变化。
1.2.4.4分离蛋白的起泡性及泡沫稳定性测定将样品蛋白配制成浓度为1%(g/m L)的悬浊液,用0.1mol/L HCl或者NaOH将pH分别调为3.0、5.0、7.0、9.0。量取20m L样品溶液,均质3m in,均质速度为10000r/m in。在0m in和3m in时读取泡沫体积。
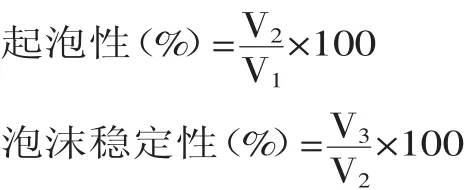
式中:V1—蛋白样品溶液的体积;V2—均质后泡沫体积;V3—均质结束3min后泡沫体积。
2 结果与讨论
2.1乙醇洗涤分离蛋白单因素实验
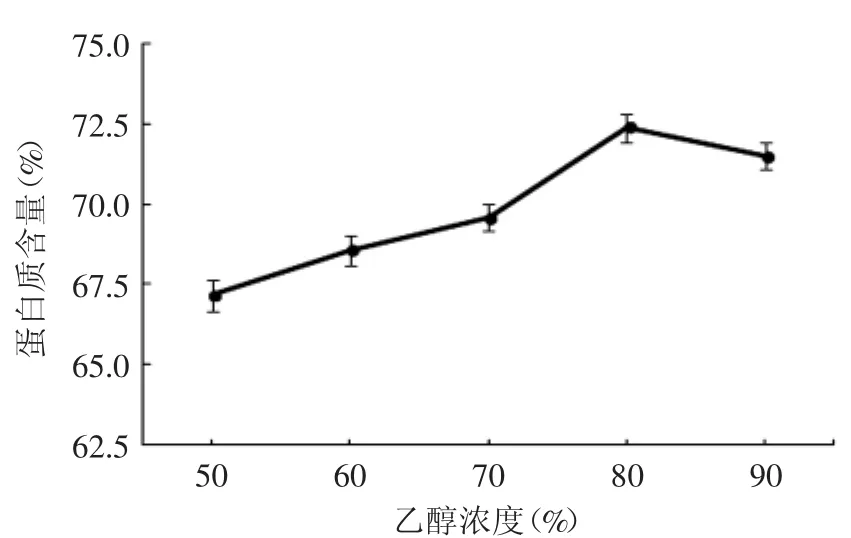
图1 乙醇浓度与蛋白质含量关系Fig.1 The relationship between the concentration of ethanol and protein content
从图1可以看出,在一定范围内,随着乙醇浓度的增加,醇洗后蛋白质的含量呈上升趋势,随着乙醇浓度的不断增大,当浓度高于80%时,蛋白含量有所下降,此时由于花生粕中的一些醇溶性杂质的溶解,导致醇洗后花生分离蛋白的杂质含量增高,影响蛋白质的含量,但其仍优于较低醇洗浓度下蛋白质含量,根据实验结果,乙醇浓度选择在70%~90%之间为宜。
从图2可知,醇洗时间对醇洗后蛋白质的含量有很大的影响。花生蛋白中醇溶性蛋白质含量不高,但是由于醇洗时间的增加,部分被不溶性蛋白包裹的醇溶性蛋白脱离出来,融入乙醇当中,导致醇洗后蛋白质的含量降低,同时导致能源消耗量增加和效率变低。醇洗时间控制在150~210min之间为宜。
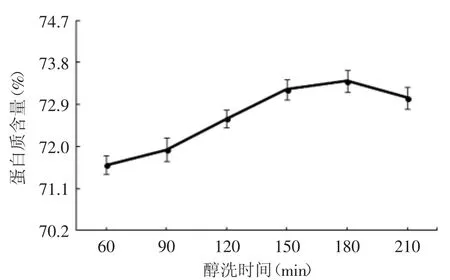
图2 醇洗时间与蛋白质含量关系Fig.2 The relationship between of ethanolwashing time and protein content
从图3中可已看出,料液比越大,蛋白质的溶出率越高,蛋白质含量也就越高。料液比小于1∶13时,随着料液比的增长,蛋白含量增长显著;当料液比超1∶13后,花生蛋白的含量虽仍随着料液比的增长而增大,但幅度较小,变化趋势缓慢。所以,从节省资源的角度来看,选取料液比在1∶13~1∶17间合适。
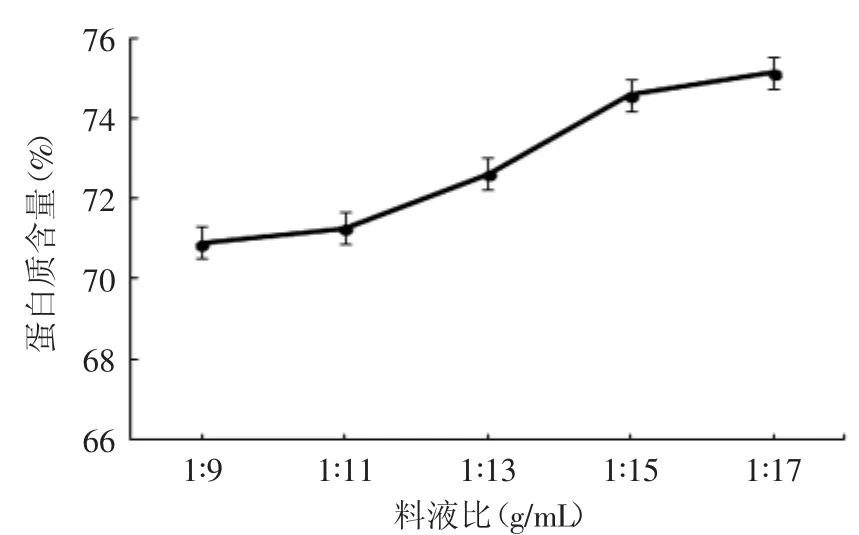
图3 料液比与蛋白质含量关系Fig.3 The relationship between liquid-solid ratio and protein content
从图4可见,在45~50℃范围内升高温度有利于蛋白含量的提高。适宜的温度有利于蛋白质的溶解,使得蛋白质的含量变大;而且蛋白溶解度大,可以有效的减少水的用量,减少排污量。但是温度过高会使蛋白质的损失量增大,同时增大能耗,因此选择温度范围在45~55℃。

图4 醇洗温度与蛋白质含量关系Fig.4 The relationship between the of ethanolwashing temperature and protein content
2.2响应面实验
2.2.1响应面实验设计结果实验采用Box-Benhnken设计实验,在单因素确定实验基础上,选择对醇洗花生分离蛋白过程有显著影响的四个因素:乙醇浓度、醇洗时间、料液比、醇洗温度,以醇洗后花生分离蛋白的蛋白含量为响应值,四因素三水平的响应面分析实验结果见表2。
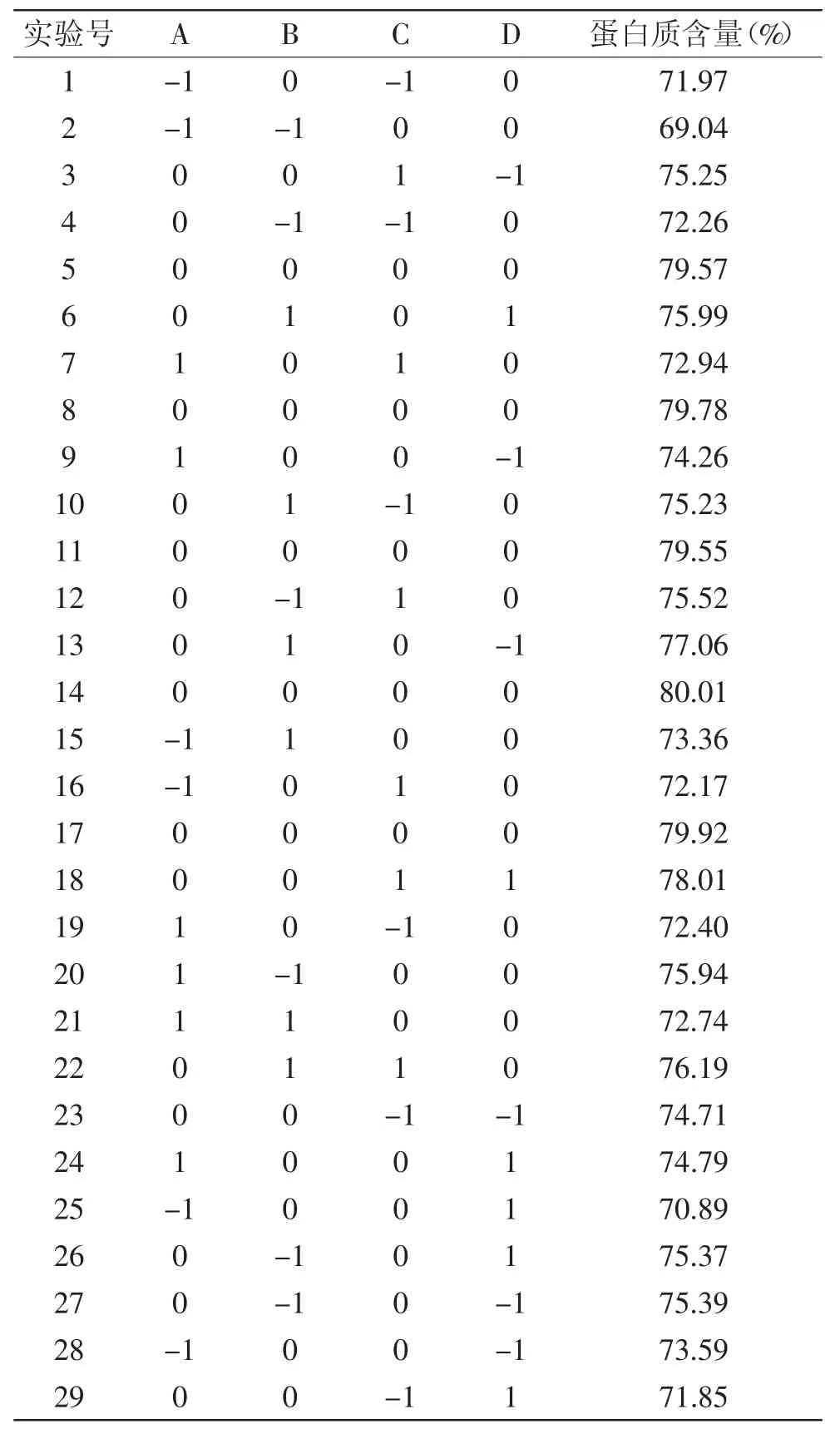
表2 花生蛋白提取Box-Behnken设计实验及结果Table 2 Box-Behnken design test results for peanut protein extraction
2.2.2回归方程的方差分析以花生蛋白含量为指标,利用Design-expert V8软件对表2进行分析得到四因素与花生蛋白含量(%)之间的回归方程如下:蛋白质含量=77.57-0.12A+1.30B-0.35C-0.025D+1.93AB+ 0.13AC+0.54AD+0.29BC-0.13BD+1.15CD-2.22A2+ 0.080B2-0.97C2-0.56D2
对回归模型进行方差分析,结果见表3回归模型达到极其显著水平(p<0.01),而失拟项不显著,说明回归方程与实际情况吻合较好,实验误差小,因此可用该回归方程代替实验真实点对实验结果进行分析。回归模型各项方差分析结果还表明,一次项、二次项都有显著影响,所以响应值的变化相当复杂,各个具体实验因素对响应值的影响不是简单的线性关系。回归模型中显示了多项交互作用,其中作用显著的是A、B、C、AB、CD、A2、B2、C2、D2。因此,在一定范围内可调节乙醇浓度、醇洗时间、料液比和醇洗温度的关系,使花生蛋白的含量达到所需水平。同时,从表3中可以看出,影响醇洗的各个因素影响大小排序依次为乙醇浓度(A)>料液比(C)>醇洗时间(B)>醇洗温度(D)。
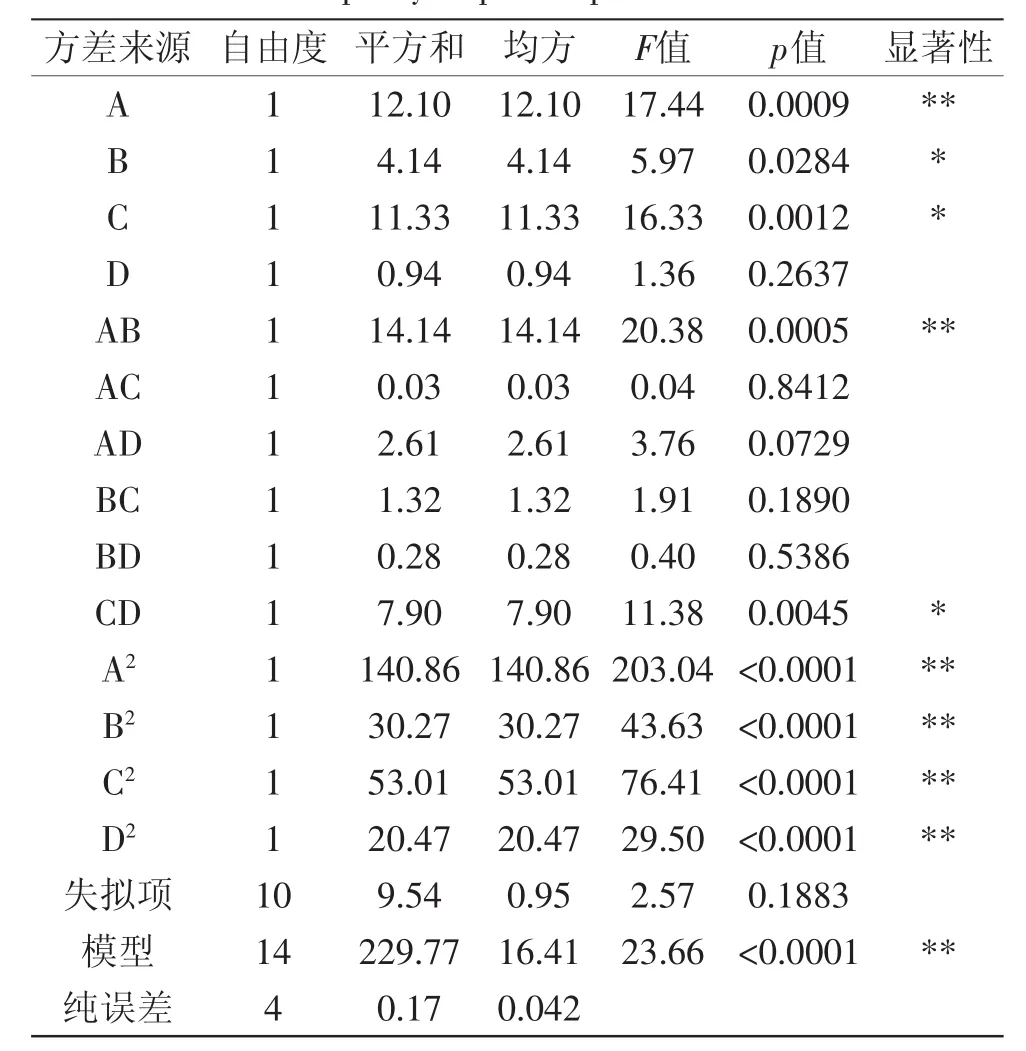
表3 花生蛋白含量方差分析表Table 3 ANOVA for the fitted quadratic polynomialmodel on purity of peanut protein
2.2.3各因素交互作用对花生蛋白的响应面分析通过Design-expert V8软件分析,以及显著项A、B、C和不显著项D分别进行分析比较,做出如图5~图8所示的响应面曲面图。由图5~图8可以直观的看到各因素之间的交互情况,A与B的交互作用的响应面随着因素的改变而显著变化,趋势明显,而等值线扁平,表示这两个因素之间的相互作用对蛋白含量的影响越大,即乙醇浓度与醇洗时间相互影响最大。

图5 乙醇浓度与醇洗时间交互作用的响应面Fig.5 Response surface of ethanol concentration and ethanolwashing time on peanut protein content
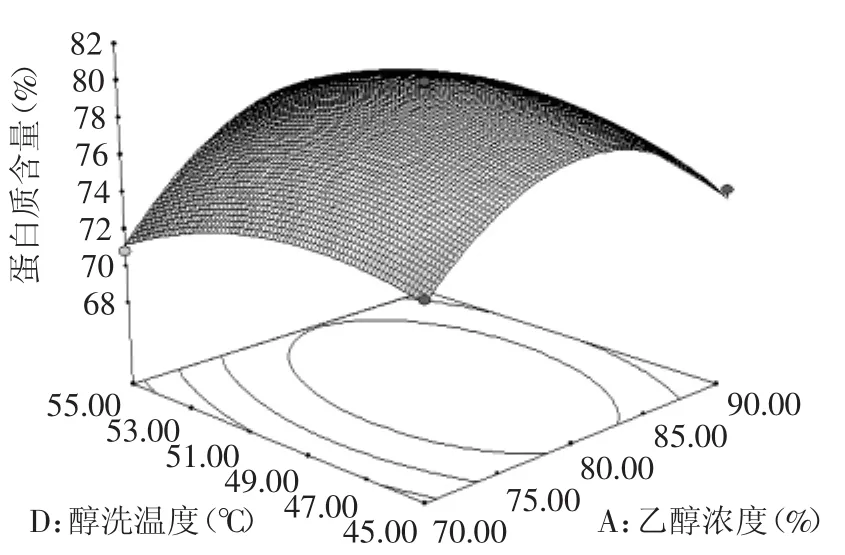
图6 乙醇浓度与醇洗温度交互作用的响应面Fig.6 Response surface of ethanol concentration and ethanolwashing temperature on peanut protein content
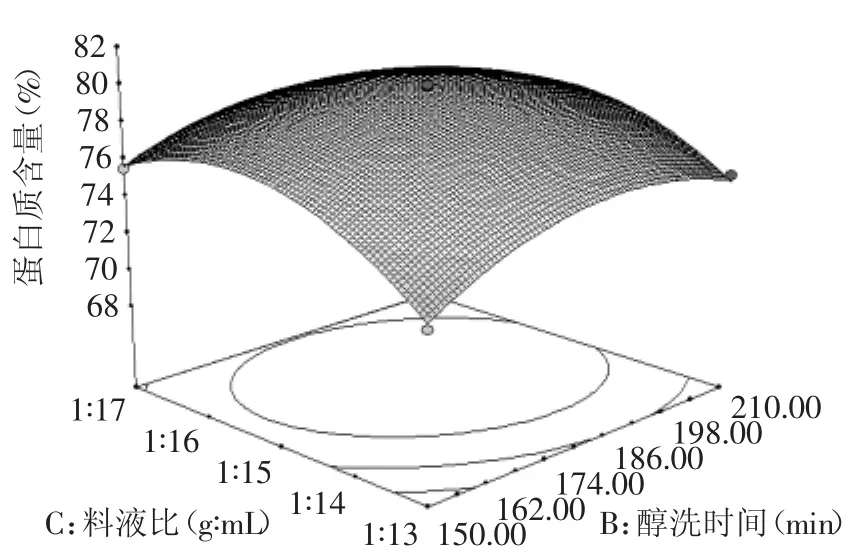
图7 醇洗时间与料液比交互作用的响应面Fig.7 Response surface of ethanolwashing time and solid-liquid ratio on peanut protein content
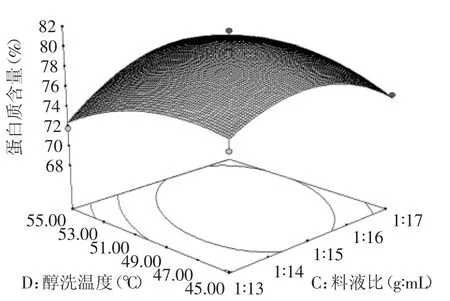
图8 料液比与醇洗温度交互作用的响应面Fig.8 Response surface of solid-liquid ratio and ethanol washing temperature on peanut protein content
2.3方程最优解求解与验证实验
利用Maxima 5.20.1进行规划求解,经转换,可得到实际的因素水平为乙醇浓度为80.95%、醇洗时间为182.21min、料液比为1∶15.33、醇洗温度为50.01℃。在最优条件下取整处理,在乙醇浓度为80%、醇洗时间为180m in、料液比为1∶15、醇洗温度为50℃进行验证实验,测定蛋白含量为79.21%,较预测值79.91%偏低。
2.4乙醇洗涤前后分离蛋白性质对比结果
2.4.1持水性及持油性的对比采用响应面实验最优工艺条件进行醇洗,醇洗前后花生蛋白的持水性和持油性见图9和图10。
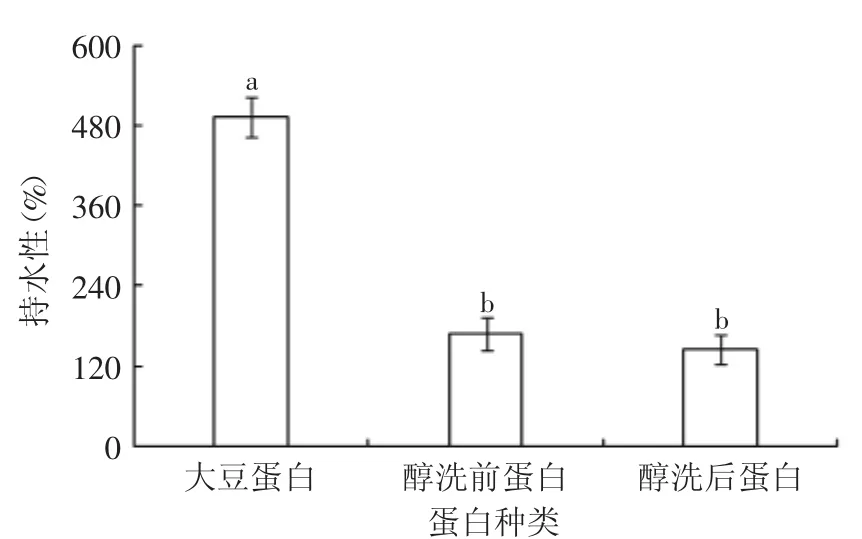
图9 不同种类蛋白的持水性Fig.9 The water-binding capacity of different proteins
蛋白质的持水性是指水化了的蛋白质牢固束缚水分不丢失的能力[9]。由图9可知,醇洗前后花生蛋白的持水性未出现显著性(p>0.05)差异,且较醇洗前蛋白降低了21.75%,两者较大豆蛋白均显著降低。本实验原料为高温花生粕,较高温度会使蛋白质的高级结构被破坏而变性聚集,致使其蛋白内部亲水基团减少,醇洗对其持水性作用的影响并不显著。
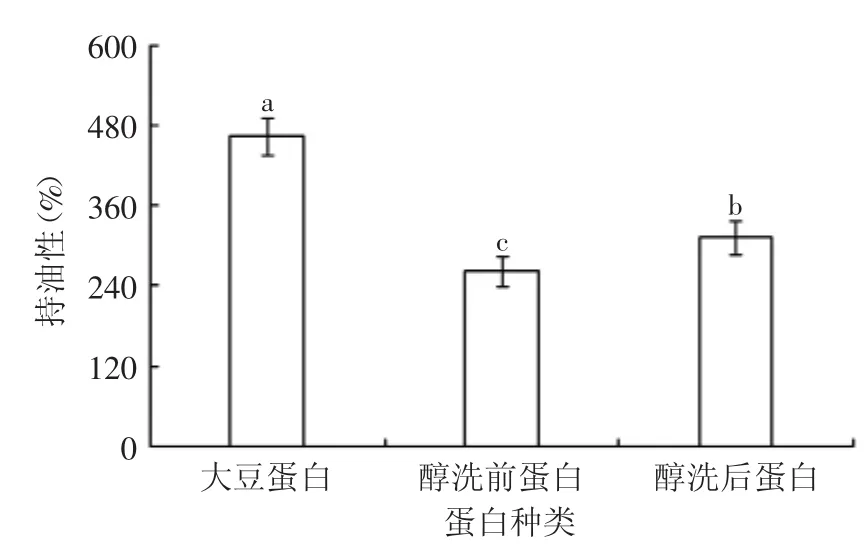
图10 不同种类蛋白的持油性Fig.10 The oil-binding capacity of different proteins
蛋白质的持油性是指蛋白吸附油脂的能力。影响吸油性的主要因素是蛋白质产品的种类、来源、颗粒大小、温度和加工方法,其中温度是影响吸油性最重要的指标[10]。由图10可知,醇洗后的花生蛋白较醇洗前的蛋白持油性显著(p<0.05)增加19%,这可能是由于蛋白质在醇洗后蛋白质结构展开,暴露出了更多疏水基团,亲油能力提高[11]。
2.4.2乳化性及乳化稳定性的测定乳化性是指蛋白质产品能将油水结合在一起,形成乳状液的性能,是衡量蛋白质促进水型乳状液形成能力的指标[12]。pH是影响乳化性的重要因素,采用响应面实验最优工艺条件进行醇洗,不同pH下各蛋白的乳化性及乳化稳定性见图11、图12。
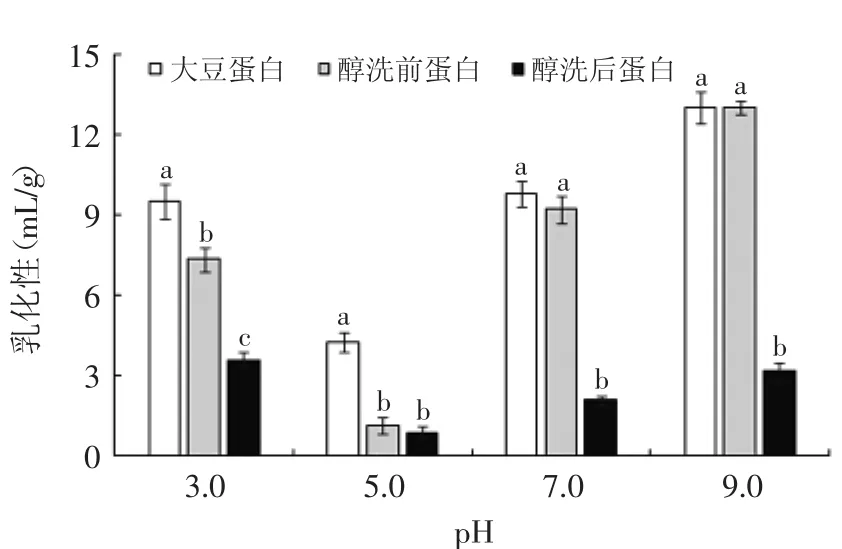
图11 不同pH下样品的乳化性Fig.11 Effectof different pH on the emulsibility of proteins
图11给出了同一pH下不同样品间的差异。除pH 5.0条件下,醇洗后的花生分离蛋白的乳化性较醇洗前均显著(p<0.05)降低,在pH为9.0时两者乳化性差值达到最大为9.86m L/g。这可能是由于醇洗后的花生蛋白疏水基团暴露,导致溶解性降低,而蛋白质的乳化性与溶解度有着很大的关系,溶解度降低,其乳化性会随之降低。当pH<5.0时,乳化性随pH增大而降低;pH>5.0,乳化性随pH的增大而增强。由于随着pH的升高,COO-逐渐增多,分子间的静电斥力越来越剧烈,离散双电层、溶液界面膜也随之加厚,同时有利于蛋白质的凝聚,所以乳化性逐渐增强[13]。
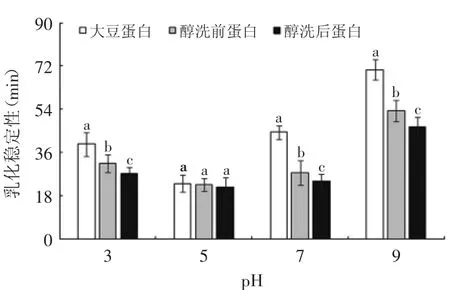
图12 不同pH下样品的乳化稳定性Fig.12 Effect of different pH on the emulsion stability of proteins
乳化稳定性是指油水乳状液保持稳定的能力。由图12可知,除pH 5.0条件下,经醇洗后,花生分离蛋白的乳化稳定性均显著(p<0.05)降低,且均显著(p<0.05)低于大豆蛋白。样品蛋白均在pH 5.0时达到最低值,这是因为当pH处在等电点附近时,由于等电点蛋白质的分子所带电荷数为零,蛋白分子表面不能形成水化层,颗粒间相互排斥力小,造成乳状液滴极易破裂[14]。同样从图12可以看出,当pH>5.0时,乳化稳定性随pH升高而增强,这时的分子负电荷增多,乳化颗粒间的排斥作用增大,形成的乳状液滴趋于稳定。
2.4.3起泡性及泡沫稳定性的测定起泡性是指蛋白产品搅打起泡,降低气-液界面的表面张力而帮助形成起泡的能力。影响蛋白起泡性的因素有很多,如蛋白质含量、pH、温度、离子强度、糖类、脂类等[15],本文主要研究pH对三种蛋白起泡性的影响。采用响应面实验最优工艺条件进行醇洗,样品的起泡性及泡沫稳定性见图13、图14。
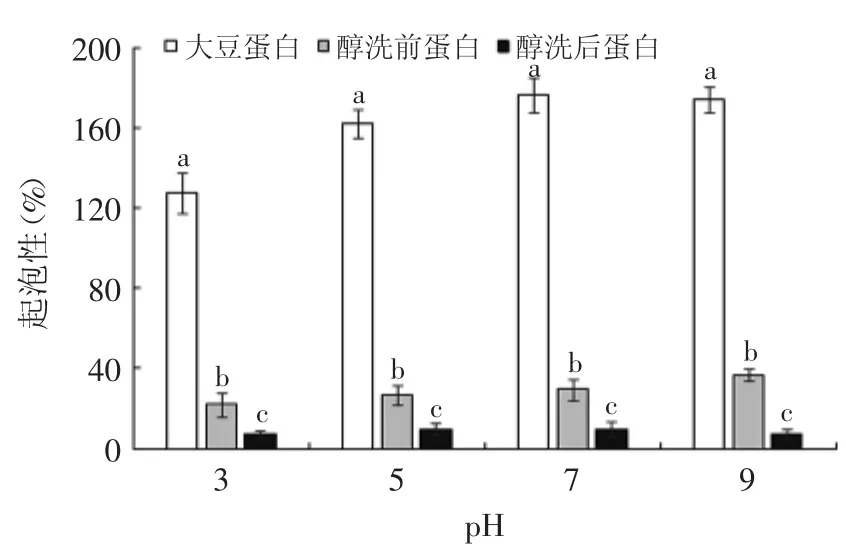
图13 不同pH下样品的起泡性Fig.13 Effectof different pH values on the foaming capacity of proteins
由图13可知,在不同pH条件下,醇洗对高温花生粕分离蛋白的起泡性没有起到改善作用,反而使起泡性能显著(p<0.05)降低,同时可见溶液体系的酸碱度影响着起泡性能。原因可能在于碱法提取的蛋白质溶解度低,溶解度低时花生蛋白不能充分分散于溶液中,导致起泡性较差。泡沫稳定性是指蛋白质维持泡沫稳定存在的能力。蛋白质分子形成连续的分子间聚合物包裹住气泡,分子间的凝聚力和弹性是产生稳定泡沫的重要因素[16]。不同pH下三种蛋白质的泡沫稳定性见图14。
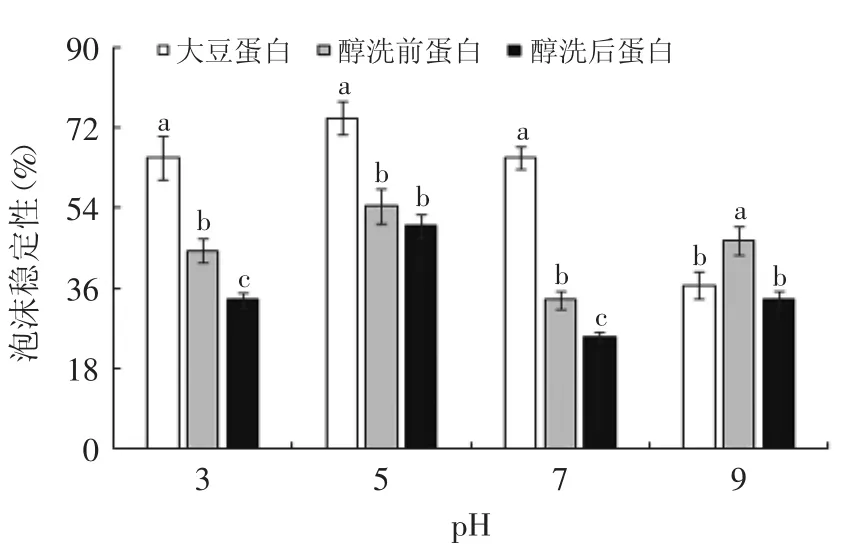
图14 不同pH下样品的泡沫稳定性Fig.14 Effectof different pH values on the foam stability of proteins
由图14可知,除pH5.0外,各pH环境下醇洗均使得花生分离蛋白泡沫稳定性显著(p<0.05)下降。当pH=5.0,三种蛋白质的稳定性均最好。这主要是因为在其等电点附近时,未溶解的蛋白质分子间的静电作用强烈,导致分布在界面上离电双电膜的厚度与硬度均增加,分子间的气泡薄膜紧密的结合在一起,并且pH对泡沫排液的影响很大,在等电点附近,排液速度缓慢,泡沫破裂放慢,因此泡沫稳定性好[17]。
3 结论
通过响应面分析,最后优化的理想工艺参数为:乙醇浓度为80%、醇洗时间为180min、料液比为1∶15、醇洗温度为50℃,通过采用优化参数验证实验测得蛋白质含量为79.21%,实验结果符合预测。
在持水性方面,醇洗对花生蛋白产品没有改善,在持油性方面,醇洗提高了花生蛋白的持油率,进而使花生蛋白有望在油性食物中得以充分开发利用。醇洗对花生分离蛋白的乳化性和起泡性影响较大,经过醇洗之后,花生蛋白的乳化性和起泡性均有所降低。所以在以后的研究生产中,需要根据实际生产需求,对醇洗工艺进行进一步的改善。
[1]高云中,张晖,袁俊,等.响应面法优化醇法花生蛋白提取工艺及其氨基酸分析[J].中国油脂,2009,5:17-20.
[2]薛芳,颜瑞,王承明.超声辅助碱提取花生多糖的研究[J].食品科学,2008,29(8):158-163.
[3]赵志强,万书波,束春德.花生的食品加工与综合利用[M].中国轻工出版社,1998,16-18.
[4]张岩,肖更生.花生粕的应用进展[J].食品工业科技,2006,27(8):197-198.
[5]高云中.花生粕蛋白的提取及性质研究[D].无锡:江南大学,2009.
[6]GB/T 14771-1993.食品中蛋白质的测定方法[S].
[7]刁静静,孔保华,彭新颜,等.乳清蛋白水解物功能性质的研究[J].食品科技,2010,35(8):89-93.
[8]朱慧,涂世,刘蓉蓉,等.酶法提取苦荞麦蛋白的理化性质和加工性质[J].食品科学,2010,31(19):197-203.
[9]丁晓雯,张红,姚舜,等.核桃蛋白功能性质及其影响因素效应的研究[J].西南农业大学学报,2005,27(6):769.
[10]杨瑾.山核桃饼粕蛋白质提取纯化工艺及其功能特性的研究[D].合肥:安徽农业大学,2012.
[11]黄晓钰,刘邻渭.食品化学综合实验[M].北京:中国农业大学出版社,2002:122-126.
[12]管斌,林洪,王广策.食品蛋白质化学[M].北京:化学工业出版社,2005:26-28.
[13]W Douid Deeslie,Munir cheryan.Functional properties of soy protein hydrolysat es from a continuous ultrafiltration reactor[J].Agric Food Chem,1988,36:26-31.
[14]范方宇,王艳萍,马艳娟,等.核桃蛋白提取工艺研究[J].农产品加工,2010(5):13-15.
[15]李书国.大豆分离蛋白生产新工艺的研究[J].西部粮油科技,1998,23(4):35-38.
[16]Carp D J,Wagner J,Bartholomal G B,et al.Rheological method for kinetics of drainage and disproportionation of soy proteins foams[J].Food Science,1997,62(6):1105-1109.
[17]Tang S,Hettiarachchy N S,Horax R,et al.PHysicochemical properties and functionality of rice bran protein hydrolyzate prepared from heat-stabilized defatted rice bran with the aid of enzymes[J].Journal of Food Science,2003,68(1):152-157.
Study on the purification ofhigh-tem perature peanutmealprotein by the method of alcoholwashing
ZHANG Hui-juan,LIYing-ying,WANG Jing*,LIU Ying-li,ZHOU Kai-wen
(Beijing Higher Institution Engineering Research Center of Food Additives and Ingredients,Beijing Technology and Business University,Beijing 100048,China)
In this experiment,peanutp rotein was extrac ted from high-temperature peanutmealby alkaliextraction and acid p recipitation,and the cond ition of alcoholwashing was op tim ized by response surface method.Based on the increase of p rotein content,the effect of alcohol washing on the characteristics of peanut p rotein had been carried out.It was suggested that the p rotein content could resch the highest value 79.21%under the follow ing conditions,alcohol concentration 80%,washing time 180m in,solid-liquid ratio 1∶15 and washing temperature 50℃.Oil retention of the p roduct was im p roved by alcohol washing,on the contrary,emulsion,emulsion stability,foam ing and foam ing stability were significantly lower.
high-tem perature peanutmeal;alcoholwashing;response surface method;p rotein
TS229
B
1002-0306(2015)06-0245-06
10.13386/j.issn1002-0306.2015.06.046
2014-06-23
张慧娟(1983-),女,博士,讲师,研究方向:粮食、油脂及植物蛋白工程。
王静(1976-),女,博士,教授,研究方向:食品营养与安全。
国家自然科学基金项目(31271976);“十二五”国家科技支撑计划项目(2012BAD34B05);国家高技术研究发展(863)计划项目(2012AA021502);北京市属高等学校高层次人才引进与培养计划项目(CIT&TCD20130309,IDHT20130506)。

