4周游泳训练对db/db小鼠脂肪组织巨噬细胞介导炎症的影响
贺强 季浏
摘 要:观察4周游泳训练对db/db小鼠内脏脂肪组织巨噬细胞介导的慢性炎症的影响,探讨运动抗炎的作用机制。将db/db小鼠和同窝野生小鼠各16只随机分为相应的对照组(WC、DC)和运动组(WE,DE)。小鼠进行4周每天1 h、每周5 d的游泳运动。各组小鼠取附睾脂肪分离附睾脂肪组织基质血管部分细胞(SVCs),流式细胞术检测SVCs F4/80+CD11b+CD11c+和F4/80+CD11b+ CD11c-巨噬细胞;RT-PCR检测炎症相关基因表达。结果显示db/db小鼠体质量、附睾脂肪含量、空腹血糖(FBG)、SVCs数量、SVCs中 F4/80+CD11b+巨噬细胞数量及其百分数、F4/80+CD11b+CD11c+巨噬细胞数量及其百分数均显著升高(P﹤0.05);附睾脂肪TNF-α、IL-6、iNOS、F4/80、CD11c mRNA表达显著升高(P﹤0.05);IL-10、CD206、Arg1 mRNA表达显著下降(P﹤0.05)。4周游泳训练显著提高db/db 小鼠体质量(P﹤0.05);附睾脂肪含量无显著差异;FBG、SVCs数量,SVCs中F4/80+CD11b+巨噬细胞数量及其百分数,F4/80+CD11b+巨噬细胞中CD11c+巨噬细胞数量及其百分数显著下降(P﹤0.05)。附睾脂肪TNF-α、IL-6、iNOS、F4/80、CD11c mRNA表达显著下降(P﹤0.05);IL-10、CD206、Arg1 mRNA表达显著升高(P﹤0.05)。4周游泳训练对野生型小鼠各项参数变化无显著差异。结果说明:1) db/db小鼠附睾脂肪M1型促炎性巨噬细胞增加,炎症因子基因表达提高;2)4周游泳训练有效降低db/db小鼠附睾脂肪巨噬细胞浸润,降低M1型巨噬细胞,提高M2型巨噬细胞表型,降低脂肪组织炎症水平。
关 键 词:运动生物化学;2型糖尿病;巨噬细胞;慢性炎症;游泳训练;小鼠
中图分类号:G804.7 文献标志码:A 文章编号:1006-7116(2015)05-0133-06
Abstract: The authors observed the effects of 4-week swimming training on visceral fat tissue chronic inflammation mediated by macrophages in db/db mice, and probed into the working mechanism of exercise-induced anti-inflammation. The authors randomly divided 16 db/db mice and 16 wild littermate mice into corresponding control groups (WC and DC) and exercise groups (WE and DE), let the mice swim 1 hour a day, 5 days a week, for 4 weeks, took epididymis fat pads out of the mice in various groups, separated stromal vascular fraction cells (SVCs) of epididymis fat tissues, analyzed SVCs F4/80+CD11b+CD11c+ and F4/80+CD11b+CD11c- macrophages by means of flow cytometry, determined inflammation related gene expressions by means of RT-PCR, and revealed the following findings: db/db mices body mass, epididymis fat content, fasting blood glucose (FBG), SVCs number, F4/80+CD11b+ macrophage number and its percentage in SVCs, F4/80+CD11b+ CD11c+ macrophages number and its percentage increased significantly (P<0.05), their epididymis fat TNF-α, IL-6, iNOS, F4/80 and CD11c mRNA expression increased significantly (P<0.05), their epididymis fat IL-10, CD206 and Arg1 mRNA expression decreased significantly (P<0.05); the 4-week swimming training significantly increased db/db mices body mass (P<0.05), did not significantly change their epididymis fat content, significantly decreased their FBG, SVCs number, F4/80+CD11b+ macrophage number and its percentage in SVCs, CD11c+ macrophage number and its percentage in F4/80+CD11b+ macrophages (P<0.05), significantly decreased their epididymis fat TNF-α, IL-6, iNOS, F4/80, CD11c mRNA expression (P<0.05), and significantly increased their IL-10, CD206 and ARG1mRNA expression (P<0.05); the 4-week swimming training did not significantly change various indexes of wild mice. The said findings indicate the followings: 1) as type M1 pro-inflammatory macrophages in epididymis fat of db/db mice increases, inflammatory cytokines gene expression increases; 2) the 4-week swimming training effectively reduced the infiltration of macrophages in epididymis fat of db/db mice, reduced type M1 macrophages, promoted type M2 anti-inflammatory macrophage phenotype, thus lowered fat tissue inflammation level.
Key words: sports biochemistry;type 2 diabetes;macrophage;chronic inflammation;swimming training;mouse
静态生活方式、不良饮食结构提高了2型糖尿病的发病风险,全球范围内2型糖尿病人群持续升高,成为医疗卫生面临的重大课题。Hotamisligil[1-2]1993年发现肥胖、糖尿病动物脂肪组织中促炎症因子TNF-α基因、蛋白表达均成倍增加,1994年发现TNF-α通过抑制胰岛素受体的酪氨酸酶活性直接干扰胰岛素信号通路,揭示了慢性炎症为胰岛素抵抗的病理机制之一,同样为2型糖尿病常见的病理特征。Weisberg[3]2003年通过免疫组化染色发现肥胖动物脂肪组织中F4/80+染色阳性巨噬细胞数量显著增加,为促炎症因子TNF-α、IL-6、IL-1β等的主要来源,极大地提高了对脂肪组织免疫细胞和代谢疾病之间的认识。罗格列酮为糖尿病治疗药物,可有效降低肥胖动物脂肪组织中巨噬细胞炎症,提示糖尿病的治疗与脂肪组织巨噬细胞炎症有关[4]。
2006年美国运动医学会(ACSM)提出“运动是良药”的健康理念,运动被列为疾病防控的常规治疗手段,运动、营养、药物作为治疗2型糖尿病(T2DM)的三驾马车,运动的经济性、广泛的健康效应更备受青睐,运动的抗炎效应实为防治T2DM的关键途径。前期研究发现,运动对肥胖动物模型慢性炎症的改善与降低脂肪组织巨噬细胞浸润、促炎表型有关[5]。运动对 2型糖尿病小鼠(db/db)脂肪组织巨噬细胞介导的慢性炎症的影响和机制尚不清楚,以往运动对脂肪组织炎症的研究多通过检测炎症因子基因表达的方法推测巨噬细胞数量变化、炎症状态,显然不如流式细胞术准确。本研究通过流式细胞术检测纯合瘦素受体自发突变(lepr-/-)的2型糖尿病小鼠(db/db)模型附睾脂肪组织巨噬细胞浸润、表型分析,该小鼠表现为多食、多饮、多尿,3~4周产生肥胖表型,10~14 d胰岛素和血糖开始升高,非常适合用于代谢类疾病研究。
1 材料与方法
1.1 实验动物及分组
本实验选用16只4周龄C57BLKS背景雄性瘦素受体自发突变纯合子db/db小鼠(BKS.Cg-Dock7m+/+ Leprdb/JNju)作为2型糖尿病研究模型,同窝生野生小鼠16只,购自南京大学模式动物中心(SCXK(苏)2010-0001)。适应饲养1周后随机分为野生安静对照组(WC)、db/db安静对照组(DC)、野生运动组(WE)和db/db游泳运动组(DE) ,每组8只。动物分笼饲养,饲养条件为室温(23±1)℃,相对湿度控制在50%~60%,喂食国家标准啮齿类动物饲料,自由摄食饮水,12 h/12 h光照。
1.2 运动方案
对照组小鼠不施加任何运动干预,于笼中静养;游泳运动组小鼠采用游泳运动:运动组小鼠在深为90 cm,直径为60 cm的塑料水桶内进行游泳,水温控制在(31±1)℃,水深控制在(60~65)cm。运动组小鼠适应性运动1周:第1、2天适应性游泳15 min,第3天30 min,第4、5天45 min,降低小鼠对水的应激反应,休息2 d执行正式运动方案:每天游泳60 min,每周5 d,共4周。
1.3 组织取材和指标测试
1)附睾脂肪组织SVCs分离和流式分析。
末次训练结束禁食12 h,血糖仪(日本京都1640血糖仪)检测小鼠空腹血糖,断颈处死小鼠,取双侧附睾脂肪,分离脂肪组织SVCs:50 mg附睾脂肪组织,预冷1×PBS 缓冲液清洗2~3次,去掉血迹和毛发,FACS buffer (1×PBS缓冲液+2%BSA)中剪碎,500 g 4 ℃离心5 min,加入2 mg/mL 2型胶原酶消化液(FACS buffer稀释),37 ℃摇床恒温水浴消化45 min,100 ?m孔径细胞筛网(美国BD)过滤细胞悬液,过滤掉细胞团块和无法消化的结缔组织,1 000 g离心5 min,弃上层脂肪细胞,收集底层SVCs细胞团,FACS buffer重悬细胞[6]。附睾脂肪SVCs的流式细胞仪分析20 ?g/mL FC-Block抗体4℃孵育附睾脂肪SVCs细胞20 min,小鼠F4/80 Percp-cy5.5、CD11b Pacific blue、CD11c APC-cy7荧光标记流式抗体和IgG抗体暗室孵育细胞20 min。美国BD FACS CantoII型流式细胞仪分离SVCs中F4/80+ CD11b+和F4/80+CD11b+ CD11c+巨噬细胞。
2)Real-time PCR法测定附睾脂肪组织基因表达。
Trizol法提取小鼠附睾脂肪总RNA:200 mg附睾脂肪于2 mL研磨管(含磁珠),加入1.5 mL Trizol试剂(Invitrogen),剪碎组织,匀浆(美国OMNI Bead Ruptor24) 2~3次,每次30 s,间隔15 s,12 000 g 4 ℃离心10 min,吸弃上层300 ?L油脂避免污染RNA,收集上清,加入200 μL氯仿,室温静置5 min,12 000 g 4 ℃离心15 min,收集上层水相400 μL,加入400 μL异丙醇,室温静置10 min。12 000 g 4 ℃离心10 min,弃上清,加入1 mL 体积分数为75%乙醇,7 500 g 4 ℃离心5 min,吸弃上清,空气干燥5~10 min,加入40 μL DEPC水(碧云天),55~60 ℃水浴助溶,超微量分光光度计(美国NanoVue Puls)测定RNA D(λ)值和D(260)/D(280),计算RNA浓度后于-80 ℃超低温冰箱保存备测。cDNA合成试剂盒(TOYOBO FSQ-101)进行逆转录反应(BIO-RAD PCR仪):反应条件为37 ℃ 15 min→98 ℃ 5 min→4 ℃,采用SYBR Green掺入法,利用TOYOBO SYBR Green Realtime PCR Master Mix(QPK-201)试剂盒在ABI荧光实时定量PCR仪进行PCR反应,反应条件为95 ℃ 1 min→95 ℃ 15 s→60 ℃ 30 s→72 ℃ 45 s共45个循环,目标基因引物见表1。
1.4 统计学分析
通过Graph Pad 5软件进行数据统计分析,数据以平均数±标准差形式表示,组间采用双因素方差分析,以P<0.05为显著性差异。
2 结果及分析
2.1 四周游泳训练对db/db小鼠生理和代谢的影响
如表2所示,与WC组比较,DC组小鼠体质量、附睾脂肪质量、附睾脂肪质量与体质量百分比、空腹血糖浓度显著增加(P<0.05);与WC组比较,WE组小鼠各种参数普遍表现出下降趋势,但并无显著性差异;与DC组比较,DE组小鼠体质量显著升高(P<0.05),附睾脂肪质量及其与体质量百分比均无显著性差异,空腹血糖浓度显著下降(P<0.05)。
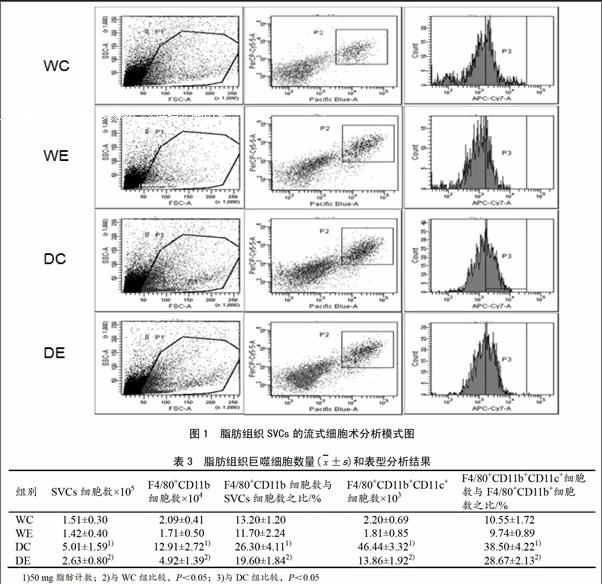
2.2 四周游泳训练对db/db小鼠脂肪组织巨噬细胞浸润和表型的影响
图1为各组小鼠附睾脂肪组织SVCs的流式细胞术分析模式图,P1门为SVCs,P2门为F4/80+CD11b+巨噬细胞,P3门为F4/80+CD11b+ CD11c+巨噬细胞。表3 表明,与WC 组比较,DC组小鼠附睾脂肪SVCs数量显著增加(P<0.05),SVCs中F4/80+CD11b+ 巨噬细胞数量、百分数显著增加(P<0.05),F4/80+CD11b+ 巨噬细胞中CD11c+ 巨噬细胞数量、百分数显著增加(P<0.05);与WC组比较,WE组小鼠附睾脂肪SVCs数量、SVCs中F4/80+CD11b+巨噬细胞数量、百分数和F4/80+CD11b+ 巨噬细胞中CD11c+ 巨噬细胞数量、百分数无显著差异。与DC组比较,DE组小鼠附睾脂肪SVCs数量显著下降(P<0.05),SVCs中F4/80+CD11b+巨噬细胞数量和百分数显著下降(P<0.05),F4/80+CD11b+巨噬细胞中CD11c+ 巨噬细胞数量和百分数显著下降(P<0.05)。
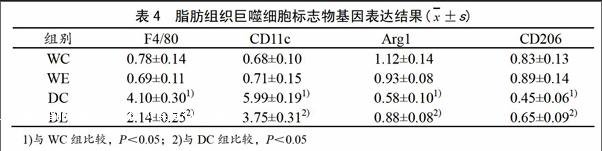
2.3 四周游泳训练对db/db小鼠脂肪巨噬细胞标志物基因表达的影响
表4表明,与WC组比较,DC组小鼠附睾脂肪F4/80、CD11c mRNA表达显著升高(P<0.05),CD206、Arg1mRNA表达显著下降(P<0.05);与WC组比较,WE组小鼠各参数无显著差异;与DC组比较,DE组小鼠F4/80、CD11c mRNA表达显著下降(P<0.05),CD206和ARG1mRNA表达显著升高。
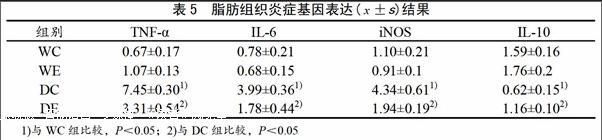
2.4 四周游泳训练对db/db小鼠脂肪炎症基因表达的影响
表5表明,与WC组比较,DC 组小鼠附睾脂肪TNF-α、IL-6、iNOS mRNA表达显著升高(P<0.05),IL-10 mRNA显著下降(P<0.05);与WC组比较,WE组小鼠各项参数无显著差异。与DC组比较,DE组小鼠TNF-α、IL-6、iNOS、mRNA表达显著下降(P<0.05),IL-10 mRNA表达显著升高(P<0.05)。
3 讨论
3.1 四周游泳训练对脂肪组织巨噬细胞数量和表型的影响
脂肪组织基质血管部分(stromal vascular fraction,SVF)富含间充质干细胞、前体脂肪细胞、内皮细胞和巨噬细胞、嗜酸性粒细胞等多种免疫细胞[7]。SVCs数量与脂肪组织的肥胖程度相关,随高脂膳食干预时间延长小鼠附睾脂肪含量增加的同时SVCs数量进行性增加[8]。本研究发现db/db小鼠附睾脂肪中SVCs数量明显增加。运动对脂肪组织SVCs数量的影响尚不清楚,也无类似研究先例,4周游泳训练对野生小鼠附睾脂肪SVCs数量的影响并不显著,不过4周游泳训练显著降低db/db小鼠附睾脂肪SVCs数量。Nishimura[9]探索ob/ob小鼠附睾脂肪SVCs中免疫细胞的组成,发现F4/80+CD11b+巨噬细胞数量最多,约为30%。脂肪组织中巨噬细胞数量随肥胖程度进行性增加,巨噬细胞数量、炎症状态与胰岛素抵抗高度相关[10]。肥胖动物内脏脂肪组织中巨噬细胞数量远远高于皮下脂肪组织,因此内脏脂肪组织对慢性炎症、胰岛素抵抗的作用更为突出,所以脂肪组织慢性炎症研究通常选择附睾脂肪[11]。
巨噬细胞根据炎症特性分为经典激活(M1)和替代性激活(M2),F4/80、CD11b为巨噬细胞常见的分子标志物,M2型巨噬细胞分泌抗炎因子IL-10,丰富表达精氨酸酶(Arginase1),可与iNOS竞争性催化底物L-精氨酸,抑制NO产生,经典标志物为CD206、CD163等;M1型巨噬细胞分泌TNF-α、IL-6等一系列促炎症因子,iNOS表达增加催化底物L-精氨酸,产生NO,经典标志物为CD11c[11]。通过F4/80、CD11b、CD11c荧光标记抗体分离db/db小鼠附睾脂肪组织SVCs中F4/80+CD11b+ CD11c+ (M1)和F4/80+CD11b+ CD11c- (M2)巨噬细胞,研究分析4周游泳训练对db/db小鼠附睾脂肪巨噬细胞的影响,结果发现db/db小鼠附睾脂肪SVCs中F4/80+CD11b+巨噬细胞数量和百分数增加,F4/80+CD11b+巨噬细胞中CD11c+/M1型巨噬细胞及其比例远远高于野生小鼠,提示促炎症的巨噬细胞数量显著增加,结果同营养性肥胖小鼠附睾脂肪巨噬细胞变化相似。Nguyen[6]发现ob/ob小鼠附睾脂肪组织F4/80+巨噬细胞百分数(55.5±2.3)%显著高于野生对照组(35.1±1.1)%,C57BL/6小鼠附睾脂SVCs中F4/80+、F4/80+CD11b+ CD11c+巨噬细胞数量随肥胖程度进行性增加。4周游泳训练显著降低db/db小鼠附睾脂肪SVCs中F4/80+CD11b+巨噬细胞的数量及其百分数和F4/80+CD11b+ CD11c+ 细胞及其百分数,对野生小鼠相同指标影响则不明显,因此可以推断4周游泳训练降低db/db小鼠附睾脂肪组织SVCs数量部分与F4/80+CD11b+巨噬细胞数量减少有关。很明显50 mg附睾脂肪无法分离出明显的F4/80+CD11b+CD11c-细胞群,无法直观地判定F4/80+CD11b+CD11c-细胞亚群的变化趋势。
3.2 四周游泳运动对脂肪组织巨噬细胞炎症标志物基因表达的影响
db/db小鼠附睾脂肪F4/80、CD11c mRNA表达显著高于同窝野生小鼠,进一步表明db/db小鼠附睾脂肪中巨噬细胞,尤其M1型巨噬细胞数量的增加。TNF-α、IL-6、iNOS mRNA表达的显著升高表明脂肪组织炎症水平的升高,同时CD206、IL-10和Arg1基因表达的显著下降提示M2型巨噬细胞数量下降,抗炎功能下降或受到抑制。前期研究表明db/db小鼠附睾脂肪F4/80+染色阳性细胞数目增加,F4/80、CD68、TNF-α、IL-6、CD11c、MCP-1mRNA等表达显著提高[12-13],这些研究结果同ob/ob、小鼠营养性肥胖小鼠脂肪组织巨噬细胞炎症特征基本一致[14]。有氧运动对改善2型糖尿病患者胰岛素抵抗、降低外周血中炎症标志物有良好的效果[15],动物实验也发现2周中等强度运动可降低db/db小鼠外周血中炎症蛋白[16],然而运动对db/db小鼠脂肪炎症基因表达的影响没见报道。本研究发现4周游泳训练显著降低db/db小鼠附睾脂肪F4/80、CD11c、TNF-α、IL-6、iNOS mRNA表达,提高了IL-10、Arg1、CD206 mRNA表达,这一发现同运动对肥胖小鼠附睾脂肪炎症的改善效果相似,Kawanishi[5]发现营养性肥胖小鼠附睾脂肪F4/80、CD11c、TNF-α mRNA表达显著升高,CD163 mRNA表达显著下降,16周耐力跑台运动显著降低F4/80、CD11c mRNA表达,提高CD163mRNA表达,降低脂肪组织炎症。Bradely[17]发现6周自主跑轮运动显著降低高脂膳食小鼠TNF-α、MCP-1等促炎因子mRNA表达。Vieira[18]发现12周65%~70%VO2max跑台运动降低脂肪组织F4/80、TNF-α表达,同时降低机体炎症水平,改善胰岛素抵抗。
db/db小鼠附睾脂肪M1型(F4/80+CD11b+CD11c+) 巨噬细胞增多,炎症因子基因表达水平明显高于野生小鼠;4周游泳训练有效降低附睾脂肪F4/80+CD11b+巨噬细胞浸润,尤其降低M1型巨噬细胞数量,提高M2型巨噬细胞表型,降低db/db小鼠附睾脂肪炎症水平。
参考文献:
[1] Hotamisligil G S,Shargill N S,Spiegelman B M. Adipose expression of tumor necrosis factor-alpha:direct role in obesity-linked insulin resistance[J]. Science,1993,259(5091):87-91.
[2] Hotamisligil G S,Budavari A,Murray D,et al. Reduced tyrosine kinase activity of the insulin receptor in obesity-diabetes. Central role of tumor necrosis factor-alpha[J]. J Clin Invest,1994,94(4):1543-1549.
[3] Weisberg S P,McCann D,Desai M,et al. Obesity is associated with macrophage accumulation in adipose tissue[J]. J Clin Invest,2003,112(12):1796-1808.
[4] Xu H,Barnes G T,Yang Q,et al. Chronic inflammation in fat plays a crucial role in the development of obesity-related insulin resistance[J]. J Clin Invest,2003,112(12):1821-1830.
[5] Kawanishi N,Yano H,Yokogawa Y,et al. Exercise training inhibits inflammation in adipose tissue via both suppression of macrophage infiltration and acceleration of phenotypic switching from M1 to M2 macrophages in high-fat-diet-induced obese mice[J]. Exerc Immunol Rev,2010,16:105-118.
[6] Nguyen M T,Favelyukis S,Nguyen A K,et al. A subpopulation of macrophages infiltrates hypertrophic adipose tissue and is activated by free fatty acids via Toll-like receptors 2 and 4 and JNK-dependent pathways[J]. J Biol Chem,2007,282(48):35279-35292.
[7] Schipper H S,Prakken B,Kalkhoven E,et al. Adipose tissue-resident immune cells:key players in immunometabolism[J]. Trends Endocrinol Metab,2012,23(8):407-415.
[8] Shaul M E,Bennett G,Strissel K J,et al. Dynamic,M2-like remodeling phenotypes of CD11c+ adipose tissue macrophages during high-fat diet--induced obesity in mice[J]. Diabetes,2010,59(5):1171-1181.
[9] Nishimura S,Manabe I,Nagasaki M,et al. CD8+ effector T cells contribute to macrophage recruitment and adipose tissue inflammation in obesity[J]. Nat Med,2009,15(8):914-920.
[10] Cancello R,Henegar C,Viguerie N,et al. Reduction of macrophage infiltration and chemoattractant gene expression changes in white adipose tissue of morbidly obese subjects after surgery-induced weight loss[J]. Diabetes,2005,54(8):2277-2286.
[11] Cancello R,Tordjman J,Poitou C,et al. Increased infiltration of macrophages in omental adipose tissue is associated with marked hepatic lesions in morbid human obesity[J]. Diabetes,2006,55(6):1554-1561.
[12] Tamura Y,Yano M,Kawao N,et al. Enzamin ameliorates adipose tissue inflammation with impaired adipokine expression and insulin resistance[J]. J Nutr Sci,2013,2:e37.
[13] Tamura Y,Sugimoto M,Murayama T,et al. CCR2 inhibition ameliorates insulin resistance and hepatic steatosis in db/db mice[J]. Arterioscler Thromb Vasc Biol,2013,2:e37.
[14] Lumeng C N,Bodzin J L,Saltiel A R,et al. Obesity induces a phenotypic switch in adipose tissue macrophage polarization[J]. J Clin Invest,2007,117(1):175-184.
[15] Kadoglou N P,Perrea D,IIiadis F,et al. Exercise reduces resistin and inflammatory cytokines in patients with type 2 diabetes[J]. Diabetes Care,2007,30(3):719-721.
[16] Sallam N,Khazaei M,Laher I,et al. Effects of moderate-intensity exercise on plasma C-reactive protein and aortic endothelial function in type 2 diabetic mice[J]. Mediators Inflamm,2010:149678.
[17] Bradley R L,Jeon J Y,Liu F F,et al. Voluntary exercise improves insulin sensitivity and adipose tissue inflammation in diet-induced obese mice[J]. Am J Physiol Endocrinol Metab,2008,295(3):E586-E594.
[18] Vieira V J,Valentine R J,Wilund K R,et al. Effects of diet and exercise on metabolic disturbances in high-fat diet-fed mice[J]. Cytokine,2009,46(3):339-345.

