菝葜提取物的抗氧化作用
帅丽乔娃等


摘要:研究菝葜不同溶剂提取物的抗氧化活性,以2,6-二叔丁基-4-甲基苯酚(BHT)为阳性对照,测定菝葜50%乙醇提取物中的石油醚相、三氯甲烷相、乙酸乙酯相、正丁醇相、水相,以及浓度为0.2~1.2 mg/mL时,菝葜50%乙醇提取物清除·OH、 O-2· 、DPPH·、ABTS+·能力、总抗氧化能力。结果表明,各萃取物均有不同程度的抗氧化活性,且与质量浓度呈量效关系,不同极性提取物中抗氧化能力大小为:乙酸乙酯相>正丁醇相>水相>醇提物>石油醚相>三氯甲烷相;当BHT浓度为 1.2 mg/mL 时,对·OH、DPPH·、 O-2· 、ABTS+·清除率分别为63.52%、6041%、70.35%、92.17%,亚铁还原能力(FRAP)值为(151.57±0.16)mmol/g;而1.2 mg/mL乙酸乙酯相对·OH、DPPH·、 O-2· 、ABTS+·的清除率分别为58.73%、66.46%、73.17%、95.84%,FRAP值为(186.25±0.21)mmol/g;除清除·OH外,在其他抗氧化效果方面,乙酸乙酯比BHT更好。以上结果表明,菝葜乙酸乙酯层中抗氧化物质的活性最强,且抗氧化活性与乙酸乙酯萃取物呈量效关系。
关键词:菝葜;萃取物;抗氧化作用
中图分类号: Q946.91+9;R284.1文献标志码: A文章编号:1002-1302(2015)09-0346-04
通信作者:郑国栋,博士,副教授,研究方向为天然产物的分离提取、功能食品等。Tel:(0791)83813420;E-mail:zrs150716@aliyun.com。菝葜为百合科植物菝葜(Smilax china L.)的干燥根茎,别称金刚藤、金刚树等,主要分布在长江以南地区。菝葜的根、茎、叶均可入药,其中根茎作为中药使用更为常见。菝葜根茎中含有皂苷、黄酮、鞣质、生物碱、氨基酸、糖、多元酚等多种成分[1],具有活血化瘀、抗菌消炎、清热利湿、强筋壮骨、补气活血等功效[2]。
自由基过多或清除过慢,会加速机体的衰老进程并诱发各种疾病,一些抗氧化剂能够有效地清除自由基,从而能够预防或治疗这些疾病。但是研究发现,过量食用这类物质对人体健康不利,因此寻找安全、可靠的抗氧化物质成为近年来世界各国研究的重点内容之一。目前,许多来自天然植物中的提取物被证明具有良好的抗氧化活性[3],它们不仅可以通过清除自由基起到抗衰老的作用,而且还有吸收放射性物质毒害的能力,对辐射损伤器官具有良好的防护作用,是具有广泛开发前景的天然抗氧化剂[4]。
目前,关于菝葜提取物抗氧化活性的研究还不是很多,菝葜甲醇提取物在高浓度时具有1,1-二苯基-2-三硝基苯肼(DPPH)自由基清除能力(IC50=7.4 g/mL )和细胞生存保护能力;进一步研究表明,菝葜乙酸乙酯、正丁醇、水提取物均有很强的DPPH自由基清除能力[5]。赵钟祥等从菝葜中分离得到了3个芪类化合物、9个天然多酚类化合物,对其进行抗氧化活性检测结果表明:这些化合物均具有较强的抗氧化活性,能有效清除DPPH自由基[6]。前人研究的抗氧化指标都比较单一,本试验的抗氧化指标为清除·OH、 O-2· 、DPPH·、ABTS[2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐]自由基能力,以及总抗氧化能力,种类更多,数据更全面,可为菝葜作为新型天然抗氧化剂的开发利用提供理论依据。
1材料与方法
1.1材料与试剂
菝葜购自江西省南昌市药材店(产地:南昌市湾里),粉碎后过40目筛,得到菝葜粉末。2,6-二叔丁基-4-甲基苯酚(BHT)、无水乙醇、福林酚、碳酸钠、亚硝酸钠、硝酸铝、氢氧化钠、双氧水、水杨酸、硫酸亚铁、三氯化铁、过硫酸钾、盐酸、乙酸钠、冰乙酸、三羟甲基氨基甲烷(Tris)、邻苯三酚均为分析纯,购自天津市永大化学试剂开发中心。没食子酸、芸香苷购自成都曼思特公司。DPPH、2,4,6-三吡啶基-S-三嗪(TPTZ)、ABTS购自美国Sigma公司。
1.2试验仪器
KQ-500B型高功率数控超声波清洗器,昆山市超声波仪器有限公司;BS224S型电子天平,赛多利斯科学仪器(北京)有限公司;SP-754PC型分光光度计,上海光谱仪器有限公司;HH-6数显恒温水浴锅,国华电器有限公司。
1.3试验方法
1.3.1萃取物的制备[7]和总酚、总黄酮的测定取菝葜粉末1 kg,用50%乙醇超声提取后,分别用石油醚、三氯甲烷、乙酸乙酯、正丁醇萃取,减压浓缩、冷冻干燥后得6种萃取物,即醇提物(未经萃取的50%乙醇提取物)、水相物(4种溶剂萃取后的水溶液浓缩干燥所得)、乙酸乙酯萃取物、正丁醇萃取物、三氯甲烷萃取物、石油醚萃取物。测定各极性提取物的总酚[8]、总黄酮含量[9],结果见表1。
表1不同萃取相的总酚、总黄酮含量(x±s,n=3)
样品萃取相总酚含量
(mg/g)总黄酮含量
(mg/g)石油醚相26.7±0.1aA22.3±0.2aA 三氯甲烷相24.1±0.2aA19.6±0.3aA乙酸乙酯相451.3±3.7bB404.1±1.5bB正丁醇相326.9±2.2cC289.4±0.6cC水相物184.5±1.3dD172.2±2.8dD醇提物149.8±3.2eE137.9±3.6eE注:同列数据后标有不同小写、大写字母分别表示差异显著(P<0.05)、极显著(P<0.01)。表2同。
1.3.2抗氧化能力测定方法
1.3.2.1清除羟自由基能力的测定[10]在试管中依次加入2 mL 9 mmol/L FeSO4溶液、2 mL 9 mmol/L水杨酸溶液、2 mL不同浓度(0.2、0.4、0.6、0.8、1.0、1.2 mg/mL)的提取物溶液,最后加入2 mL 8.8 mmol/L H2O2启动整个反应;37 ℃水浴30 min后,以蒸馏水为参比,在510 nm下测定吸光度D1,用蒸馏水代替水杨酸测定其吸光度D2,以蒸馏水代替样液测定其吸光度D0,用0.2、0.4、0.6、0.8、1.0、1.2 mg/mL BHT溶液对·OH的清除率作为对比。计算公式如下:羟自由基清除率=[1-(D1-D2)/D0]×100%。
1.3.2.2清除DPPH自由基能力的测定[11]制备DPPH溶液:称取DPPH样品0.01 g,用无水乙醇溶解并定容至 250 mL,即得到浓度为0.04 mg/mL的DPPH溶液,置于4 ℃冰箱备用。将2 mL上述浓度的提取物溶液与等体积DPPH混合、摇匀,放置于黑暗中30 min后,于517 nm下测定吸光度值Di。将2 mL不同浓度的样液与无水乙醇等体积混合于试管中,摇匀,测定吸光度为Dj(用以扣除样品本身对吸光度测定的干扰)。以蒸馏水与无水乙醇混合液测得的吸光度作为空白对照Dd,用BHT溶液对DPPH的清除率作为对比,相关计算公式为:DPPH自由基清除率=[1-(Di-Dj)/Dd]×100%。
1.3.2.3清除超氧阴离子能力的测定[12]取4.5 mL浓度为0.05 mmol/L、pH值为8的Tris-HCl缓冲溶液,于20 ℃水浴中进行预热,20 min后分别加入1 mL不同浓度提取液、0.4 mL 浓度为0.5 mmo1/L的邻苯三酚溶液,充分混匀后于 25 ℃ 水浴中反应5 min,然后加入1 mL浓度为8 mol/L的HCl溶液终止反应。最后在299 nm处测定吸光度Dk1;空白对照则以蒸馏水代替样品液,测定吸光度Dk2。以BHT溶液对 O-2· 的清除率作为对比,相关计算公式为:超氧阴离子自由基清除率=(1-Dk1/Dk2)×100%。
1.3.2.4清除ABTS自由基能力的测定[13]将5 mL浓度为7 mmol/L的ABTS溶液与88 μL浓度为2.45 mmol/L的过硫酸钾溶液混合反应,制备ABTS自由基溶液,使用前将 ABTS+· 溶液在室温下黑暗中放置12~16 h,并将ABTS+·溶液用无水乙醇稀释到吸光度测定值为0.70±0.02(734 nm条件下)。在试管中加入0.15 mL不同浓度的提取液,再加入285 mL的ABTS自由基工作液溶液,振荡摇匀,于室温避光静置1 min,在734 nm处测定其吸光度值Ds;同法,在 0.15 mL 无水乙醇中加入2.85 mL ABTS自由基工作液混匀,在734 nm处测定吸光度Do。用BHT溶液对ABTS+·的清除率作为对比,相关计算公式为:
ABTS自由基清除率=(1-Ds/Do)×100%。
1.3.2.5抗氧化能力测定[14]亚铁还原能力(FRAP)反应液配制方法:300 mmol/L 乙酸钠缓冲液(pH值3.6)、10 mmol/L TPTZ溶液(40 mmol/L HCl为溶剂)、20 mmol/L FeCl3溶液,三者体积比为10 ∶1 ∶1。反应液现配现用,在使用前放置在37 ℃的水浴中保温。分别吸取 0.5、1.0、1.5、20、2.5、3.0 mmol/L的 FeSO4标准液,加入3 mL FRAP工作液,再加入0.3 mL超纯水,混匀,于37 ℃下准确反应30 min,于593 nm处测定其吸光度D593 nm,用超纯水调零,以FeSO4的浓度(mmol/L)为横坐标、D593 nm为纵坐标绘制标准曲线。分别移取0.2 mL不同浓度提取液于试管中,加入3.8 mL FRAP 工作液,混匀后在37 ℃下反应30 min,测吸光度,各试验组均做3次平行,取均值。根据反应后的吸光度,在标准曲线上求得相应FeSO4的浓度(mmol/L),定义为FRAP值。以BHT溶液测定的FRAP值作对比。
1.3.3数据分析采用DPS 7.5版分析软件中的Duncans新复极差法对总酚、总黄酮含量、清除各自由基的数据进行差异显著性分析。
2结果与分析
2.1对·OH自由基的清除作用
羟基自由基是目前所知活性氧中对生物体毒性最强、危害最大、并有非常高反应速率的一种自由基,几乎来不及扩散就与碰到的分子发生反应,使细胞坏死或突变;因此,研究羟基自由基的清除作用是研究抗氧化性中十分重要的一部分。本试验原理是H2O2与Fe2+发生Fenton反应,生成具有很高活性的羟自由基,能与水杨酸反应产生可用分光光度法测量的羟基化合物2,3-二羟基苯甲酸,但若加入清除羟自由基功能的物质,便会与水杨酸竞争,从而使有色产物生成量减少。
从图1可以看出,在试验浓度范围内,菝葜各极性提取物对·OH均有一定的清除作用,并在试验浓度范围内呈量效关系;其中乙酸乙酯萃取相清除率最大,提取物浓度为1.2 mg/mL时,其清除率达到了58.73%,仍然小于同浓度下的BHT(清除率63.52%);当提取物浓度低于0.8 mg/mL时,清除率均不超过50%。这与乙酸乙酯层多酚、黄酮含量最高有关,因为多酚、黄酮有很好的抗氧化活性[15-16]。整体看出,清除·OH的强弱顺序为:BHT>乙酸乙酯相>正丁醇相>水相>醇提物>石油醚相>三氯甲烷相。
2.2对DPPH自由基的清除作用
DPPH·是一种稳定的以氮为中心的质子自由基,含有3个苯环,乙醇溶液呈紫色,在517 nm处有最大吸收波长,当有清除剂时,清除剂提供1个电子与DPPH·的孤对电子配对,使溶液颜色变淡、吸光度变小,如果被测物能够较好地清除DPPH·,表明该物质能够降低氧自由基、烷基自由基等的浓度,阻断脂质的过氧化反应。因此,对DPPH·清除率的高低是天然抗氧化剂筛选的指标之一。
从图2可以看出,在试验浓度范围内,菝葜各极性提取物对DPPH·均有一定的清除作用,并且随其浓度的增加,能力也逐渐增强。其中乙酸乙酯相比其他萃取相清除DPPH自由基能力更强,乙酸乙酯萃取相甚至比同浓度的BHT清除率更高,当提取物浓度为1.2 mg/mL时,乙酸乙酯相的清除率达到了66.46%,而BHT清除率为60.41%,这与乙酸乙酯层黄酮、多酚含量最高有关。整体看出,清除DPPH·的强弱顺序:乙酸乙酯相>BHT>正丁醇相>水相>醇提物>石油醚相>三氯甲烷相。
2.3对超氧阴离子的清除作用
在生物体内氧化还原反应中,有2%~5%的氧变成超氧阴离子,这种阴离子会产生超氧阴离子自由基,这种自由基随着生命活动代谢而产生,其氧化能力很强,机体发生氧中毒往往是由这种自由基的毒性导致。因此清除超氧阴离子自由基的能力也是检验抗氧化物质活性的主要指标。
从图3可以看出,在试验浓度范围内,菝葜各萃取相对 O-2· 均有一定的清除作用,且随其浓度的增加清除率逐渐增大。当提取物浓度为1.2 mg/mL,石油醚相、三氯甲烷相、乙酸乙酯相、正丁醇相、水相、醇提物、BHT对 O-2· 清除率分别为47.61%、43.95%、73.17%、67.54%、62.39%、59.48%、70.35%,乙酸乙酯相清除能力超过了同浓度的BHT。整体上看出,清除 O-2· 的强弱顺序:乙酸乙酯>BHT>正丁醇>水相>50%乙醇>石油醚>三氯甲烷。
2.4对ABTS自由基的清除作用
ABTS与一定浓度的过硫酸钾在室温暗处反应12~16 h,ABTS经氧化后生成相对稳定的蓝绿色的ABTS+·,抗氧化剂与ABTS+·反应后使其溶液褪色,溶液吸光度降低,吸光度越低,表明所检测物质的总抗氧化能力越强。
从图4可以看出,在试验浓度范围内,菝葜各极性提取物对ABTS+·均有一定的清除作用,且随其浓度的增加清除率逐渐增大。当提取物浓度为1.2 mg/mL时,石油醚相、三氯甲烷相、乙酸乙酯相、正丁醇相、水相、醇提物、BHT对 ABTS+· 的清除率分别为42.46%、35.94%、95.84%、8991%、82.48%、78.62%、92.17%,乙酸乙酯相比其他极性提取物表现出更好的清除能力;当提取物浓度为0.4 mg/mL时,BHT清除能力强于乙酸乙酯相;提取物浓度大于等于 0.6 mg/mL 后,乙酸乙酯相清除能力明显增强,并逐渐超过了BHT。可能由于乙酸乙酯层的黄酮、 多酚含量比其他萃取相
高,因此清除ABTS+·的能力也更强。整体看出,清除ABTS+·的强弱顺序:乙酸乙酯相>BHT>正丁醇相>水相>醇提物>石油醚相>三氯甲烷相。
2.5总抗氧化能力测定
Fe3+-TPTZ可被还原物质还原为二价铁离子形式,溶液呈现出明显的蓝色,并在593 nm处具有强烈吸收,根据吸光度的大小计算样品抗氧化活性的强弱,FRAP值越大,抗氧化能力越强。
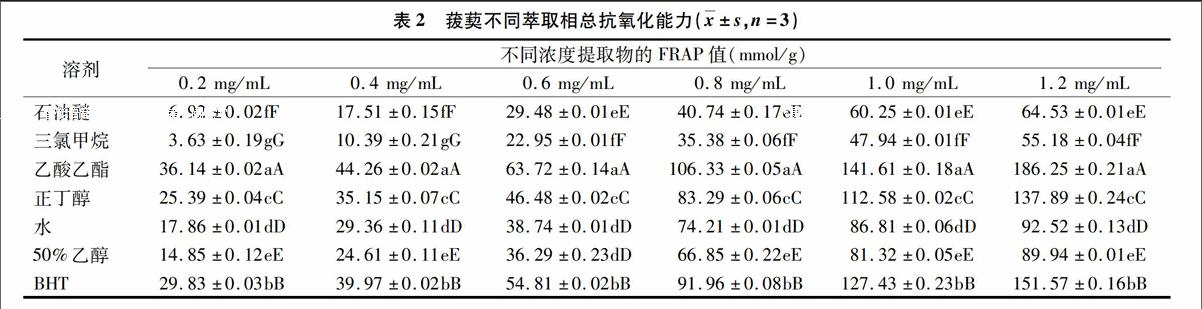
根据FeSO4的浓度,得线性方程为:y=0.206 3x+0.047(r=0.999 2)。测得不同极性成分反应吸光度(D)后,在标准曲线上求得相应 FeSO4的浓度(μmol/L),定义为FRAP值。从表2可以看出,在试验浓度范围内,菝葜不同极性成分的FRAP值与浓度呈量效关系,FRAP 值越大,其抗氧化活性越强;Fe3+还原抗氧化能力强弱顺序
菝葜各萃取相均有一定抗氧化能力,且随着浓度的增加,抗氧化活性增强,这是因为各萃取相均含有多酚、黄酮类,多酚、黄酮是植物中主要的抗氧化物质,并且随着萃取相浓度的增加,抗氧化活性也增强,其总酚、总黄酮含量最高的乙酸乙酯层抗氧化能力最强。抗氧化活性强弱顺序:乙酸乙酯相>正丁醇相>水相>醇提物>石油醚相>三氯甲烷相,这说明菝葜中的抗氧化活性物质最多存在于乙酸乙酯相中。当浓度为1.2 mg/mL时,BHT对·OH、DPPH·、 O-2· 、ABTS+·清除率分别为63.52%、60.41%、70.35%、92.17%,FRAP值为(151.57±0.16)mmol/g;乙酸乙酯相对·OH、DPPH·、 O-2· 、ABTS+·清除率分别为58.73%、66.46%、73.17%、95.84%,FRAP值为(186.25±0.21)mmol/g。除了清除·OH,其他的乙酸乙酯相的抗氧化效果相比BHT好。
试验结果充分证实了菝葜的乙酸乙酯萃取相有较强的抗氧化活性,这对于利用菝葜开发天然抗氧化功效因子提供了依据。但由于本试验仅是在体外进行研究,而生物体内的氧化代谢是很复杂的,因此还有待于从生物体内源抗氧化酶系活性、生物大分子氧化代谢产物水平的角度来进一步研究菝葜的抗氧化作用机制。
参考文献:
[1]Zhang Q F,Guo Y X,Shangguan X C,et al. Antioxidant and anti-proliferative activity of Rhizoma Smilacis Chinae extracts and main constituents[J]. Food Chemistry,2012,133(1):140-145.
[2]Khan I,Nisar M,Ebad F,et al. Anti-inflammatory activities of sieboldogenin from Smilax china Linn.:experimental and computational studies[J]. Journal of Ethnopharmacology,2009,121(1):175-177.
[3]吴雪辉,张喜梅,李廷群,等. 板栗花粗提物的抗氧化活性研究[J]. 现代食品科技,2008,24(1):14-16,19.
[4]Benvenuti S,Pellati F,Melegari M,et al. Polyphenols,anthocyanins,ascorbic acid,and radical scavenging activity of rubus,ribes,and aronia[J]. Journal of Food Science,2004,69(3):C164-C169.
[5]Lee S E,Ju E M,Kim J H. Free radical scavenging and antioxidant enzyme fortifying activities of extracts from Smilax china root[J]. Experimental & Molecular Medicine,2001,33(4):263-268.
[6]赵钟祥,金晶,方伟,等. 菝葜多酚类成分抗氧化活性的研究[J]. 医药导报,2008,27(7):765-767.
[7]季志平,苏印泉. 杜仲叶提取物的抑菌活性研究[J]. 林产化学与工业,2008,28(1):63-66.
[8]Xu J G,Tian C R,Hu Q P,et al. Dynamic changes in phenolic compounds and antioxidant activity in oats (Avena nuda L.) during steeping and germination[J]. Journal of Agricultural and Food Chemistry,2009,57(21):10392-10398.
[9]迟玉新,窦德强. 楮实子与构树叶中总黄酮含量测定[J]. 中国现代中药,2008,10(11):16-17.
[10]Zheng W,Wang S Y. Oxygen radical absorbing capacity of phenolics in blueberries,cranberries,chokeberries,and lingonberries[J]. Journal of Agricultural and Food Chemistry,2003,51(2):502-509.
[11]黄莉娟,胡蝶,张萍,等. 柑橘的抗氧化活性研究[J]. 现代食品科技,2012,28(4):399-401.
[12]Cheung Y C,Siu K C,Liu Y S,et al. Molecular properties and antioxidant activities of polysaccharide-protein complexes from selected mushrooms by ultrasound-assisted extraction[J]. Process Biochemistry,2012,47(5):892-895.
[13]Kang W Y,Wang J M. In vitro antioxidant properties and in vivo lowering blood lipid of Forsythia suspense leaves[J]. Medicinal Chemistry Research,2010,19(7):617-628.
[14]康文艺,李彩芳,张 丽. 卷丝苣苔和勐醒芒毛苣苔抗氧化活性研究[J]. 天然产物研究与开发,2009,21(3):470-472.
[15]Hossain M A,Rahman S. Total phenolics,flavonoids and antioxidant activity of tropical fruit pineapple[J]. Food Research International,2011,44(3):672-676.
[16]Vignoli J A,Bassoli D,Banassi M T. Antioxidant activity,polyphenols,caffeine and melanoidins in soluble coffee:the influence of processing conditions and raw material[J]. Food Chemistry,2011,124(3):863-868.

