大孔树脂分离富集葛根中葛根素及大豆苷元
高俊等
摘要:研究8种不同极性大孔吸附树脂对葛根素、大豆苷元的吸附、解吸性能,筛选出分离富集葛根素、大豆苷元的最佳树脂HP20。利用HP20大孔吸附树脂吸附富集葛根中2种异黄酮的过程为:上样液用盐酸调节pH值为6,然后采用HP20大孔吸附树脂在5 ℃的条件下进行吸附。结果表明,HP20大孔吸附树脂对葛根素、大豆苷元的饱和吸附量分别为(71.78±0.75)、(21.77±0.01)mg/g;吸附饱和后用去离子水洗涤树脂以除去杂质,在25 ℃条件下用70%乙醇解吸,得葛根素、大豆苷元,解吸率分别为63.39%、80.68%,葛根素纯度由8.62%提高到35.26%,大豆苷元纯度由0.27%提高到10.17%。
关键词:葛根素;大豆苷元;大孔树脂;吸附;解吸;分离;富集;工艺条件
中图分类号: R284.2文献标志码: A文章编号:1002-1302(2015)09-0292-05
葛根是豆科类植物野葛[Pueraria lobata (Willd.) Ohwi]的根,是一种常用中药材。我国有着丰富的葛根资源,主要分为粉葛、野葛两大类,尤以野葛的分布最为广泛,且野葛中异黄酮类化合物含量高,常作药用。葛根享有“山人参”的美称,据《神农本草经》记载,葛根具有清热解毒、改善微循环、降血压、调节血脂等作用[1-2]。葛根素、大豆苷元是葛根中主要的药物活性成分,临床研究表明,葛根素对心脑血管疾病的治愈率达97.6%,且副作用低,深受患者欢迎;大豆苷元具有防止骨质疏松作用,还能减轻妇女更年期综合症、降低冠心病的发病率、促进神经元的保护和再生[3-5]。随着物质生活日益丰富,心血管疾病患者不断增多,以葛根异黄酮类化合物为原料的药品是治疗该类疾病的特效药之一,因此,如何分离富集葛根提取液中的葛根素、大豆苷元成为当下研究的热点。
大孔树脂是一类具有大孔网状结构的高分子有机聚合吸附剂,由于其具有理化性质稳定、吸附选择性独特、吸附和解吸条件温和、重复利用率高、安全无毒等优点,近年来广泛应用于皂苷、黄酮、生物碱等天然产物的分离纯化[6-9]。目前葛根中异黄酮类化合物的分离富集方法多以葛根素为主,忽略了大豆苷元的市场应用价值,造成一定程度上的资源浪费[10-11]。本研究选用不同极性的大孔树脂同时分离富集葛根提取液中的葛根素、大豆苷元,考察大孔树脂对葛根素、大豆苷元的吸附洗脱作用和过程动力学,并对优选出的树脂分离富集葛根素、大豆苷元的工艺条件进行研究。
1材料与方法
1.1试验材料
葛根[Pueraria lobata (Willd.) Ohwi]购自江苏镇江药材市场,阴干、粉碎后保存备用。对照品为葛根素、大豆苷元,Sigma公司产品;含量测定用色谱纯甲醇、乙酸为J&K Chemical Ltd产品;去离子水为自制;大孔吸附树脂HPD750、HPD600购自南开大学化工厂,HP20、D100、SP70、HPD722、HPD450A、HPD500购自郑州勤实科技有限公司;其他试剂均为国产分析纯。
1.2试验仪器
Agilent 1260LC高效液相色谱仪配G1311-B四元泵、G1311-B自动进样器、G1316-A柱温箱、G1314-F紫外检测器,美国Agilent公司;Milli-Q纯水仪,美国Millipore公司;DK-S28型电热恒温水浴锅,上海精宏实验设备有限公司;RE-52A旋转蒸发仪,上海亚荣生化仪器厂。
1.3大孔树脂的预处理
在室温条件下将树脂用体积分数为95%的乙醇浸泡 24 h,每隔一段时间搅拌1次,每8 h更换1次乙醇溶液,之后用去离子水将树脂洗至无乙醇味;用5%的HCl溶液将树脂浸泡4 h后,用去离子水清洗树脂直至清洗液pH值为7;用5%NaOH溶液将树脂浸泡4 h后,用去离子水清洗树脂直至清洗液pH值为7;最后用蒸馏水浸泡24 h。试验中所用大孔树脂的性质见表1。
1.4葛根提取液的制备
取自然阴干的葛根,粉碎过筛备用。以葛根粉末(60~80目)为原料,用体积分数为70%的乙醇为提取剂,按料液比1 g ∶8 mL在90 ℃条件下水浴回流提取2 h,重复提取3次,过滤并合并滤液。将滤液减压蒸馏至无乙醇味,用去离子水分别配置成葛根素、大豆苷元含量为1.527、0.140 mg/mL的溶液备用。
1.5分析方法
采用高效液相色谱法检测样品液中葛根素、大豆苷元含量[12-15]。色谱条件:Agilent ODS-C18色谱柱(250 mm×4.6 mm,5 μm);检测波长250 nm;柱温25 ℃;流速 1 mL/min;进样量5 μL;流动相:A相为含0.1%乙酸的乙腈溶液,B相为含0.1%乙酸的水溶液,流动相配比见表2。
1.6葛根素、大豆苷元标准曲线的建立
精确称取5.00 mg葛根素标准品、 3.00 mg大豆苷元标准品,用甲醇溶解并于10 mL容量瓶中定容,作为标准品贮备液(500 μg/mL葛根素,300 μg/mL大豆苷元)。精确量取标准品储备液,用甲醇稀释配制成以下浓度的标准品溶液:250.000、125.000、62.500、31.250、15.625 μg/mL葛根素;150.000、75.000、37.500、18.750、9.375 μg/mL大豆苷元,分别用0.22 μm滤膜过滤后按“1.4”节中的色谱条件进行检测,每个浓度重复进样3次。
分别以葛根素、大豆苷元浓度为横坐标,以峰面积积分值为纵坐标绘制标准曲线,得葛根素、大豆苷元回归方程:y=28 118.05x+20.67(r2=0.999 8)、y=20 638.31x+84.16(r2=0.999 7)。浓度分别在10~300、5~250 μg/mL范围内时葛根素、大豆苷元的浓度与峰面积积分值线性关系良好。
1.7大孔树脂分离富集葛根素、大豆苷元
1.7.1树脂的筛选准确称取预处理过的绝干质量为 0.25 g 的不同型号的湿树脂于100 mL锥形瓶中,加入30 mL葛根提取液,放入恒温水浴振荡器中。吸附条件:温度为25 ℃、转速为120 r/min,吸附24 h达到吸附平衡后过滤,取 1 mL 滤液,用0.22 μm滤膜过滤后进行HPLC检测。按式(1)计算各树脂的吸附量:
Qe=(C0-Ce)×Vi(1-M)m。(1)
式中:Qe为吸附质在吸附剂中的平衡吸附量,mg/g;Ce为平衡时吸附质的浓度,mg/mL;C0为葛根提取液初始浓度,mg/mL;Vi为葛根提取液体积,mL;m为树脂质量,g;M为树脂的含水率,%。
将吸附饱和的大孔树脂置于100 mL锥形瓶中,加入 10 mL 去离子水冲洗树脂后,过滤弃去去离子水,加入10 mL体积分数为70%的乙醇溶液,放入水浴振荡器中。解吸条件:温度为25 ℃、转速为120 r/min,解吸24 h后分别取 1 mL 上清液,用0.22 μm滤膜过滤后进行HPLC检测。按式(2)计算各树脂解吸率:
D=Cd×Vd(C0-Ce)Vi×100%。(2)
式中:D为树脂的解吸率,%;Cd为解吸液中吸附质的浓度,mg/mL;Vd为解吸液的体积,mL;Ce为平衡时吸附质的浓度,mg/mL;C0为葛根提取液初始浓度,mg/mL;Vi为葛根提取液体积,mL。
1.7.2pH值对树脂吸附性能的影响准确称取预处理过的绝干质量为0.25 g的不同型号的湿树脂于100 mL锥形瓶中,加入30 mL不同pH值的葛根提取液(pH值分别为5、6、7、8、9,溶液的pH值用HCl、NaOH调节),放入恒温水浴振荡器中。吸附条件:温度为25 ℃、转速为120 r/min,吸附24 h后分别取样1 mL,用0.22 μm滤膜过滤后进行HPLC检测。
1.7.3解吸液乙醇浓度对树脂解吸性能的影响准确称取预处理过的绝干质量为0.25 g的不同型号的湿树脂于 100 mL 锥形瓶中,加入30 mL葛根提取液,放入恒温水浴振荡器中。设定温度为25 ℃、转速为120 r/min,当达到吸附平衡以后,过滤,用10 mL去离子水冲洗树脂,之后加入10 mL不同体积分数的乙醇溶液(60%、70%、80%、90%、100%),放入水浴振荡器中,设定温度为25 ℃、转速为120 r/min,解吸24 h分别取样1mL,用0.22 μm滤膜过滤后进行HPLC检测。
1.7.4树脂的吸附动力学曲线分别称取3份预处理过的、绝干质量为2.5 g的大孔吸附树脂,置于1 000 mL具塞锥形瓶中,分别将300 mL葛根提取液加入到装有树脂的锥形瓶中,并将锥形瓶放入水浴振荡器中,设置温度为25 ℃、转速为120 r/min,分别于0.25、0.50、1.00、1.50、2.00、4.00、6.00 h时取样1 mL,用0.22 μm滤膜过滤后进行HPLC检测。
1.7.5树脂的解吸动力学曲线分别称取3份预处理过的绝干质量为2.5 g的大孔吸附树脂,置于1 000 mL具塞锥形瓶中,分别将300 mL葛根提取液加入到装有树脂的锥形瓶中,并将锥形瓶放入水浴振荡器中,设定温度为25 ℃、转速为120 r/min;当达到吸附平衡以后,过滤,用去离子水冲洗树脂,之后加入20 mL体积分数为70%的乙醇溶液,放入水浴振荡器中,设定温度为25 ℃、转速为120 r/min,分别于5、10、20、30、40、50、60 min取样1mL,用0.22 μm滤膜过滤后进行HPLC检测。
1.7.6树脂的吸附等温曲线称取若干份预处理好的HP20树脂,每份绝干质量0.25 g,分别加入30 mL不同浓度的葛根提取液,在5、25、45 ℃的条件下分别吸附2 h后取样1 mL,用0.22 μm滤膜过滤后进行HPLC检测。绘制出在不同温度条件下的吸附等温线,并利用Langrnuir方程进行参数拟合。
1.7.7葛根素、大豆苷元纯度的计算将HP20树脂解吸液减压浓缩至干,得葛根异黄酮粗品。称取25 mg葛根异黄酮粗品,定容至25 mL的容量瓶中,取样1 mL用0.22 μm滤膜过滤后,用HPLC检测葛根素、大豆苷元的含量,并按式(3)计算其纯度:
F=CfVfm×100%。(3)
式中:F为纯度,%;Cf为溶液中吸附质的浓度,mg/mL;Vf为溶液的体积,mL;m为葛根异黄酮粗品的质量,mg。
2结果与分析
2.1大孔吸附树脂的吸附量、解吸率
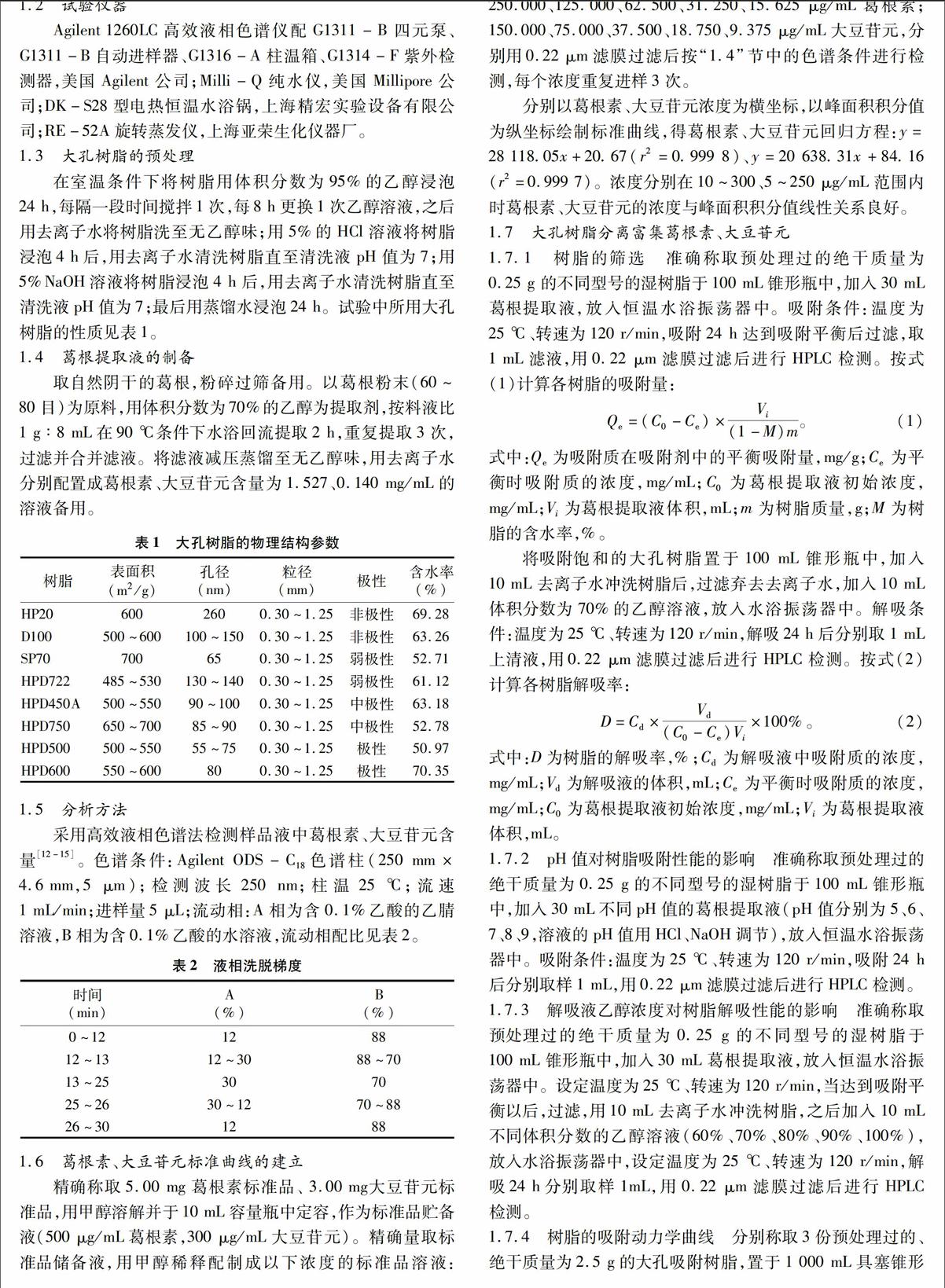
不同大孔树脂对葛根素、大豆苷元的吸附和解吸性能有很大差异。如图1-a所示,多数非极性、弱极性、中级性树脂的吸附能力明显优于极性树脂,这是因为树脂对葛根素、大豆苷元的吸附特性主要表现为通过范德华力进行吸附,从而有利于非极性、弱极性、中级性树脂的吸附[16];HP20、HPD722、HPD450A型树脂表现出了较好的吸附性能,对葛根素、大豆苷元的吸附量都很高,其中HP20树脂对葛根素、大豆苷元的吸附量分别达(61.78±0.36)、(12.77±0.02) mg/g。
如图1-b所示,在解吸试验中,不同极性的树脂对葛根素、大豆苷元的解吸能力有所不同。大孔树脂对于葛根素的解吸能力大致随着极性的升高而增强;而对于大豆苷元,大孔树脂的解吸能力大致随着极性的升高而降低,这可能是由于吸附作用力强,解吸起来就会困难。综合考虑树脂的吸附量和解吸率,HP20型树脂对于葛根素、大豆苷元的吸附和解吸能力与其他树脂相比较高,因此选用HP20型树脂进行上样液pH值对树脂吸附性能影响的试验。
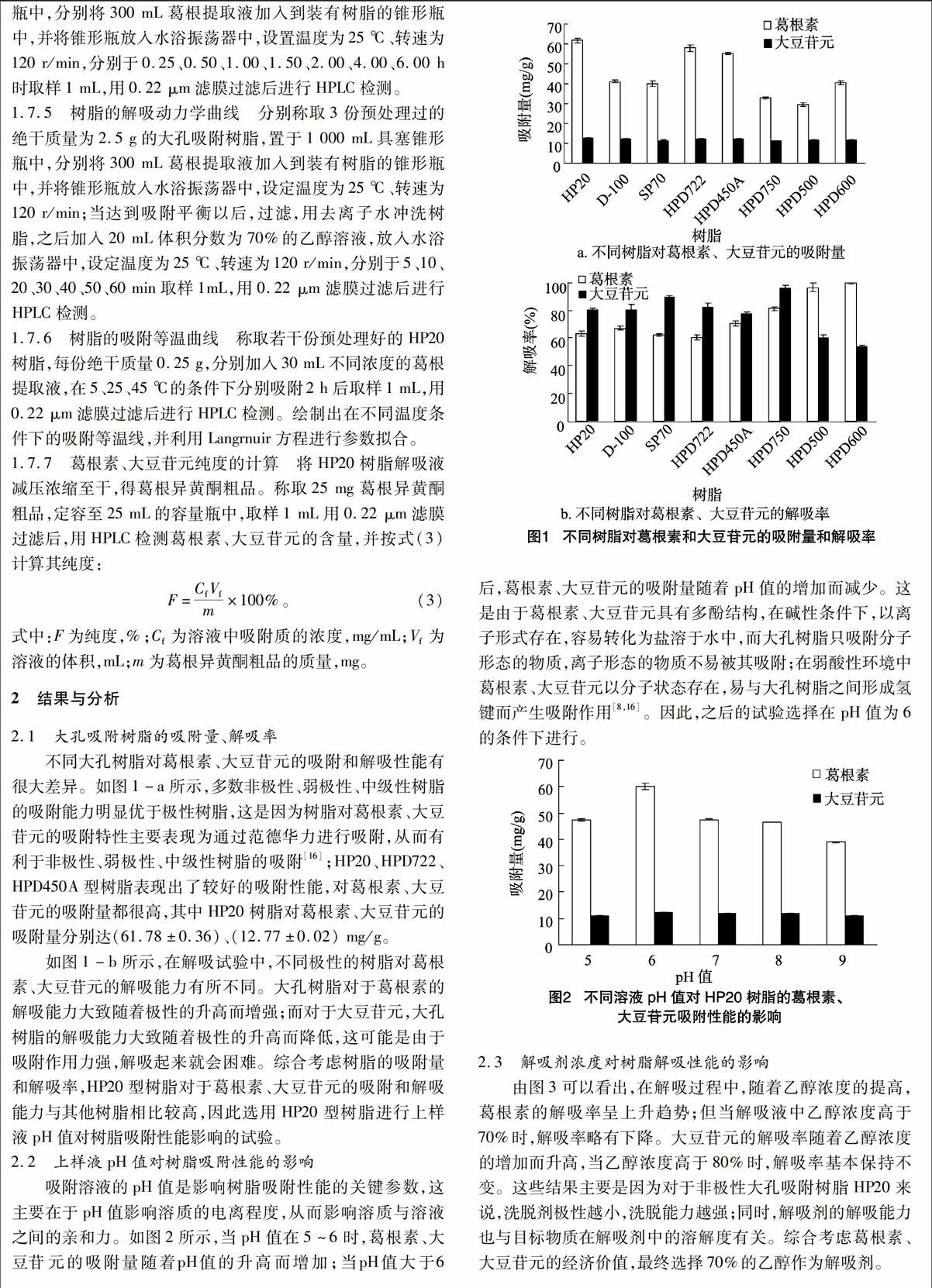
2.2上样液pH值对树脂吸附性能的影响
吸附溶液的pH值是影响树脂吸附性能的关键参数,这主要在于pH值影响溶质的电离程度,从而影响溶质与溶液之间的亲和力。如图2所示,当pH值在5~6时,葛根素、大豆苷元的吸附量随着pH值的升高而增加;当pH值大于6

