拮抗放线菌YH6的鉴定及发酵条件优化
赵柏霞等

摘要:为探讨拮抗菌YH6在食品工程中的应用潜力,通过形态观察及16S rDNA序列分析确定了其分类地位,采用牛津杯法测定其发酵液的抑菌活性,并采用单因素试验与正交设计方法筛选出该菌株的优化发酵配方和发酵条件。结果表明,YH6为球孢链霉菌(Streptomyces globisporus);该菌株发酵液对大肠杆菌、金黄色葡萄球菌都有较强的抑制活性。培养基优化组合为:甘薯粉8.0 g/L、硫酸铵 10.0 g/L、蛋白胨3.0 g/L、NaCl 2.0 g/L、CaCO3 1.0 g/L,优化发酵条件为:初始pH值8.0、发酵时间5 d、发酵温度28 ℃、接种量8%、装液量50 mL/250 mL、转速120 r/min。
关键词:抑菌活性;放线菌;分类鉴定;发酵条件优化
中图分类号: S482.2+8文献标志码: A文章编号:1002-1302(2015)09-0180-04
金黄色葡萄球菌(Staphylococcus aureus Rosenbach)、大肠杆菌(Escherichia coli)是动物和人类化脓感染中最常见的病原菌[1],在自然界中无处不在,空气、水、灰尘及人和动物的排泄物中都可以找到,因此,食品受其污染的机会很多,产生的肠毒素可以沾染食物而致食物中毒。
放线菌是生物农药中农用抗生素制剂的重要来源,已研制开发具有较强抗菌防病作用的放线菌源农用抗生素如放线菌酮、井冈霉素、中生菌素、春雷霉素、武夷菌素、农抗120、多抗霉素等,均已成功应用于植物各种病害的生物防治[2-3]。海洋环境特殊,孕育着丰富的微生物资源,包括能产生各种次级代谢产物的海洋放线菌,并且也有从海水中筛选出许多对植物病原真菌、细菌病害以及对金黄色葡萄球菌、大肠杆菌有抗菌活性的放线菌,因此,海洋放线菌在新型代谢产物以及生物农药的开发方面具有巨大的潜力[4-8]。
本研究室从海洋沉积物中筛选到1株对金黄色葡萄球菌具有强拮抗活性的放线菌株YH6,对该菌进行形态观察和16S rDNA序列分析,并对其发酵培养液成分和发酵条件进行优化,为进一步研究抗菌机制、测定活性物质结构和产业化开发利用提供科学依据。
1材料与方法
1.1材料
供试菌株:拮抗菌YH6由大连开发区泊石湾海泥中分离获得;金黄色葡萄球菌、大肠杆菌由笔者所在的研究室分离鉴定并保存。
供试培养基:A~D号发酵培养基(A培养基,马铃薯20%、葡萄糖2%;B培养基,大豆粉1%、葡萄糖1%、氯化钠0.25%、碳酸钙0.2%、蛋白胨0.3%;C培养基,葡萄糖1%、蛋白胨0.3%、氯化钠0.25%、碳酸钙0.2%;D培养基,葡萄糖2%、大豆粉2%、蛋白胨0.3%、硫酸铵0.2%、硫酸镁005%、碳酸钙0.6%,pH值7.8-8.0;LB培养基,胰蛋白胨1%、酵母提取物0.5 %、NaCl 1%、琼脂1.5%,pH值7.8~80)。A~D培养基用于菌株YH6发酵液的培养;LB培养基用于指示菌培养以及抑菌活性的测定。
主要试验仪器:ZHWY211B型恒温摇床(上海,智诚公司);CT15RT冷冻离心机(上海,天美公司);TC-512型PCR扩增仪(英国,Techne公司);S-4800型扫描电镜(日本,日立公司)。
1.2拮抗菌YH6的分类鉴定
1.2.1形态特征观察在高氏1号培养基上28 ℃培养5~7 d,观察菌落形态、菌丝颜色及是否产生色素。
1.2.216S rDNA序列测定及分析采用微波法[8]提取拮抗菌株YH6总DNA,应用通用引物(F:5′-AGAGTTTGATCCTGGCTCAG-3′;R:5′-AAGGAGGTGATCCAGCCGCA-3′)进行16S rDNA的PCR扩增。克隆测序后,将测得的16S rDNA全序列提交GenBank数据库(Http://www.ncbi.nlm.nih.gov)获得序列登录号,并应用MEGA 5.0软件在Ezbiocloud(www.ezbiocloud.net)数据库中进行同源序列搜索,与已报道的放线菌模式菌株的16S rDNA全系列进行比对分析,建立系统发育树。
1.3YH6抑菌谱测定
采用牛津杯法分别测定菌株YH6发酵液的上清液对大肠杆菌和金黄色葡萄球菌的抑菌活性,以无菌培养液为对照。
1.4发酵培养基和发酵条件的优化
1.4.1最佳基础发酵培养基的筛选以A~D号培养基作为初始的发酵培养基,分别以10%的浓度接种100 mL菌株YH6的发酵液,置于28 ℃、120 r/min条件下振荡培养,5 d后发酵液经过8 000 r/min离心,取100 μL上清,并采用牛津杯法测定其对大肠杆菌和金黄色葡萄球菌的抑菌活性,筛选出最适的发酵培养基。
1.4.2发酵培养基的成分优化碳源:以“1.4.1”节中筛选出的最佳发酵培养基为基础,在其中分别用葡萄糖、蔗糖、可溶性淀粉、玉米粉、甘薯淀粉分别替换碳源,并以原始培养基作为对照。氮源:分别用大豆粉、酵母粉、牛肉膏、(NH4)2SO4等分别替换氮源,以原始培养基作对照。上述试验均在 28 ℃、120 r/min振荡培养条件下培养5 d,离心发酵液,并取上清液测定其活性,每个处理进行3次重复。根据试验结果选用4因素3水平的L9(34)正交试验优化筛选最佳发酵培养基组合。
1.4.3发酵条件的优化以“1.4.2”节得到的优化培养基为基础培养基,分别改变培养基的初始pH值(5.0、6.0、7.0、8.0、9.0)、发酵温度(21、25、28、31、34、37 ℃)和发酵时间(1、2、3、4、5、6、7、8、9、10 d),以发酵液上清对金黄色葡萄球菌的抑菌圈直径为指标,确定最佳pH值、发酵温度和发酵时间;在筛选出的最佳pH值、发酵温度、发酵时间的条件下改变接种量(1%、3%、5%、8%、10%、15%)、装液量(250 mL三角瓶分别装液25、50、75、100、125、150、175 mL)、转速(100、120、150、180、200 r/min)进行培养,发酵液经上述处理后测定对大肠杆菌和金黄色葡萄球菌的抑制活性,确定最佳发酵条件,每组处理重复3次。
2结果与分析
2.1拮抗菌YH6的生物学特性及分类鉴定
2.1.1形态学鉴定拮抗菌YH6在高氏1号培养基上气丝粉状,秸草色、乳脂色或微黄秸草色,基丝无色,有时反面微黄色。扫描电镜观察(图1)孢子丝非螺旋形,长条状,孢子圆柱形,表面光滑。
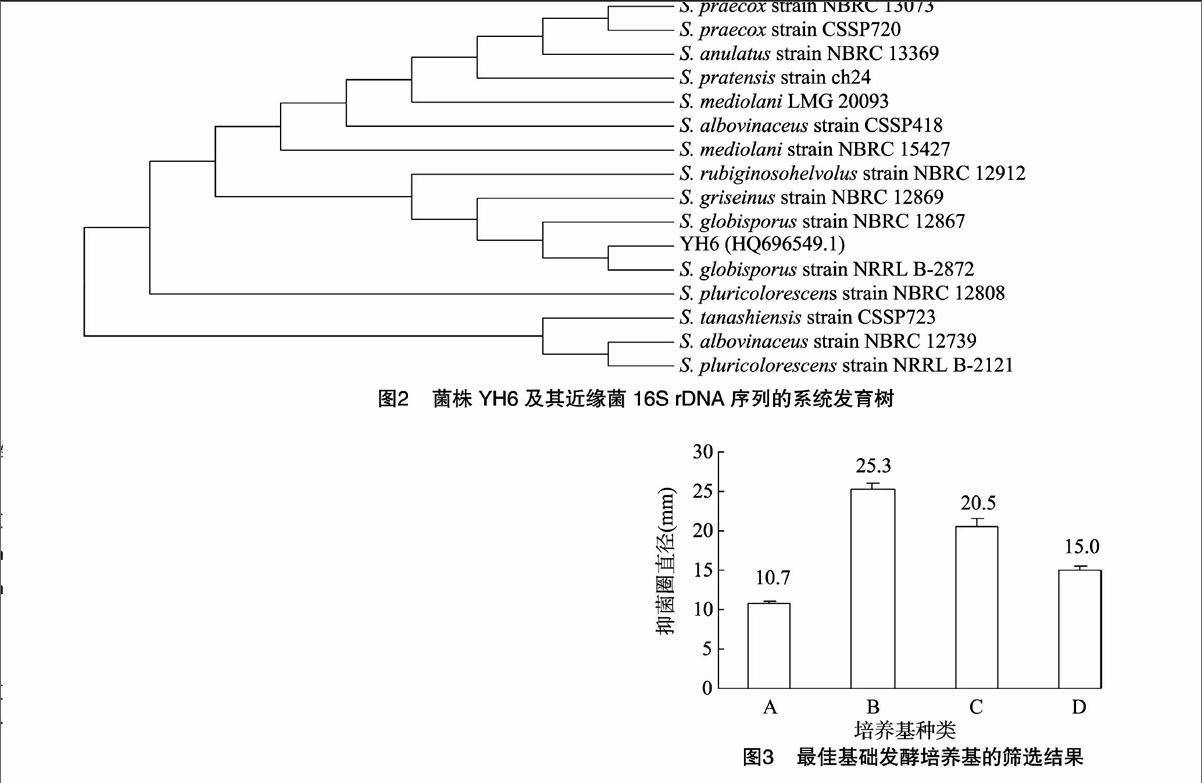
2.1.216S rDNA测序结果分析YH6总DNA经PCR扩增得到1条约为1.5 kb的特征条带,回收后连接转化,阳性克隆子菌液测序,得到序列长为1 431 bp,GenBank登录号为HQ696549 。将该序列与Ezbiocloud数据库中的相应序列进行比对,构建Neighbor-Joining系统发育树(图2),并结合形态特征,分析结果表明,YH6菌株与球孢链霉菌(Streptomyces globisporus)的同源性最高,初步将该菌鉴定为球孢链霉菌。
2.2发酵培养基组分的优化
2.2.1最佳发酵培养基的筛选利用A~D等4种培养基进行发酵培养,B培养基产生活性物质较多,抑菌圈直径可达253 mm;A培养基产生的活性物质最少,抑菌圈直径仅为10.7 mm;而C、D培养基产生活性物质的抑菌圈直径分别为20.5、15.0 mm(图3)。表明B培养基为最佳发酵培养基。
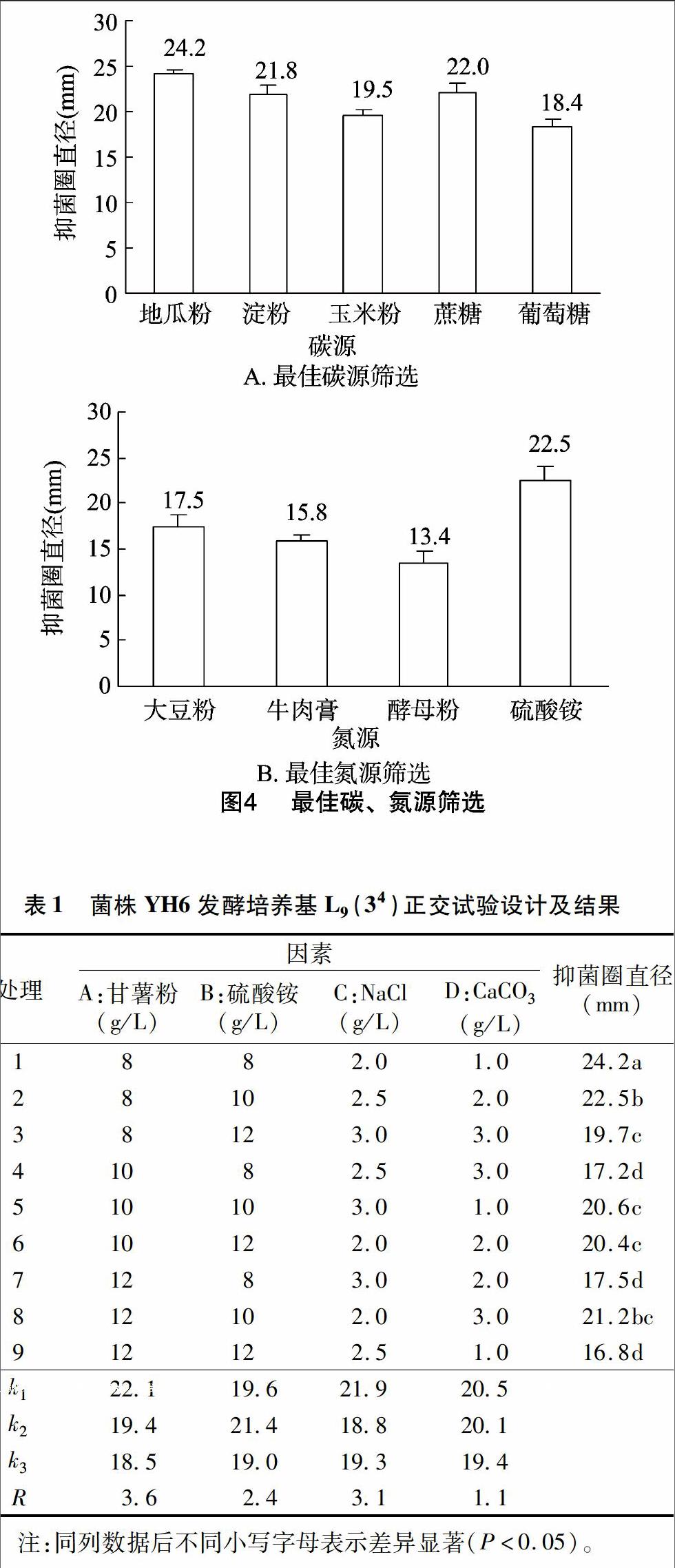
2.2.2最佳碳源、氮源的筛选不同碳源对YH6发酵液的抑菌效果见图4-A,从强到弱依次为甘薯粉>蔗糖>淀粉>玉米粉>葡萄糖,选择甘薯粉为最佳碳源;不同氮源抑菌活性见图4-B,从强到弱依次为硫酸铵>大豆粉>牛肉膏>酵母粉,因此选用硫酸铵作为最佳氮源。
2.2.3碳源、氮源、无机盐配比的正交优化根据单因素碳氮源筛选结果,选取4因素3水平的L9(34)正交表设计9种不同的培养基进行发酵培养试验,结果(表1)表明,甘薯粉对
活性物质产生影响最大,CaCO3 影响最小,其优化后的最佳发酵配方为A1B2C1D1,即甘薯粉8.0 g/L,硫酸铵 10.0 g/L,NaCl 2.0 g/L,CaCO3 1.0 g/L。
2.3发酵条件的优化
2.3.1初始pH值发酵培养基初始pH值对活性物质的产生影响较小,当初始发酵培养基pH值为8.0时,抑菌活性最强;在pH值为5.0时,活性物质产生达到最低值。与pH值自然的发酵液相比,pH值调为8.0时抑菌活性增加12.4%,因此发酵的最佳初始pH值为8.0(图5-A)。
2.3.2发酵温度培养温度对YH6产生活性物质的影响较大,在21~28 ℃抑菌活性缓慢增强,在28 ℃达到最大,当温度超过28 ℃时抑菌活性明显下降,因此,该菌株产生活性物质的最佳发酵温度为28 ℃(图5-B)。
2.3.3发酵时间拮抗菌YH6在优化得到的发酵培养基中培养3 d,抑菌圈直径达16 mm,培养时间为5 d时抑菌活性最强,抑菌圈直径可达28.5 mm;随着培养时间的增长,发酵液的抑菌活性逐渐降低,产生这种现象可能是由于发酵培养基中营养物质的消耗量增加而导致了菌株活性物质产量降低,同时活性产物的降解率提高所导致。因此,最佳培养时间选择5 d(图5-C)。
2.3.4接种量YH6发酵培养的接种量在1%~15%范围内均有一定的抑菌活性,当接种量为8%时抑菌活性最强,抑菌圈直径为27.6 mm,因此,YH6发酵培养过程中宜采用8%的接种量(图5-D)。
2.3.5装液量在装液量为50 mL(250 mL的三角瓶中装液50 mL)时,所得的发酵液具有较强的抑菌活性,随着装液量的逐渐增大,发酵液的抑菌活性则逐渐降低,这可能是由于发酵培养过程中,三角瓶中的空气含量减少影响了YH6产生活性物质的能力,说明该菌株在溶氧量较高的情况下容易产生活性物质。因此,培养的最佳装液量为50 mL/250 mL(图5-E)。
2.3.6转速当转速为120 r/min时抑菌活性最强,抑菌圈直径达到27.5 mm,转速过高或者过低都会影响菌株YH6活性物质的产生,产生这种现象可能是因为菌株YH6属于好氧菌,对于好氧菌调节转速可以达到增加溶氧量的目的,进而会提高活性物质的产量,但当转速过高时,会对菌体的结构产生破坏从而抑制了活性物质的产生。因此,最佳发酵转速选择120 r/min(图5-F)。
3结论与讨论
通过单因素试验和正交试验相结合,初步得到了适合摇瓶条件下菌株YH6发酵的培养基配方为:甘薯粉8.0 g/L、硫酸铵 10.0 g/L、蛋白胨3.0 g/L、NaCl 2.0 g/L、CaCO3 1.0 g/L;最适培养条件为:初始pH值为8.0、发酵时间5 d、发酵温度28 ℃、接种量8%、装液量50 mL/250 mL,转速为120 r/min。在此条件下,YH6的抑菌圈直径高达29.8 mm,比在原始B培养基上抑菌圈25.3 mm 有了明显提高。在优化培养条件时,发现该菌株最适培养基pH值为8.0左右,表明该菌株喜欢在偏碱性的环境中生长,温度在31 ℃以上时菌株抑菌活性显著减弱,说明该菌株不耐高温。
放线菌广泛存在于自然界中,种类繁多,是一类有着很大应用潜力的微生物资源,从Cohn发现放线菌至今,有大量关于放线菌是重要的医药和农药资源的报道。据报道,从海洋中分离获得的具有抗菌活性的放线菌多为Streptomyces、Micromonospora、Pseudonocardia等[9-12]。
本试验筛选出的来自大连海域的放线菌YH6对金黄色葡萄球菌具有很好的拮抗作用,经形态观察和16S rDNA序列分析将菌株YH6初步鉴定为球孢链霉菌。该菌株发酵液中活性代谢产物对大肠杆菌也有很好的抑制效果,因此具有较高的潜在价值。据报道,将该菌与其他菌种混合施入番茄幼苗可促进番茄地上部、地下部和整株鲜质量增加,根系活力增强和叶绿素含量提高[13]。此外,该菌对油菜菌核病有拮抗作用[14],对甜瓜、棉花、草莓等作物常见土传病害具有抑制作用[15]。因此,本试验优化了其发酵培养基配方及发酵条件,为进一步分离纯化其活性代谢产物以及开发高效生防制剂奠定基础,期望在优化其发酵工艺的基础上进一步研究抑菌机
制及在食品、农产品防腐上的应用效果,从而有利于发挥其绿色保鲜功能。
参考文献:
[1]高涛. 食品中金黄色葡萄球菌肠毒素及检测方法的研究进展[J]. 福建分析测试,2003,12(2):39-42.
[2]朱昌雄,谢德龄,倪楚芳. 农抗120防治西瓜枯萎病菌的室内药效试验[J]. 生物防治通报,1990,6(3):124-127.
[3]蒋细良,谢德龄,倪楚芳,等. 中生菌素的抗生作用[J]. 植物病理学报,1997,27(2):40-45.
[4]李晓虹,裴永娜,李学锋,等. 几株农用拮抗链霉菌的初步研究[J]. 微生物学杂志,2006,26(1):26-28.
[5]姜健,杨宝灵,鲁红凯,等. 海洋微生物生物活性物质的研究[J]. 云南大学学报:自然科学版,2004,26(增刊1):91-95.
[6]温占波,裴月湖,田黎. 海洋微生物产抑真菌、抑肿瘤次生代谢产物的初步研究[J]. 中国海洋药物,2003,22(6):6-9.
[7]窦会娟,李林珂,刘新胜,等. 高抑制金黄色葡萄球菌活性放线菌的分离及分子鉴定[J]. 安徽农业科学,2011,39(9):5076-5077.
[8]徐平,李文均,徐丽华,等. 微波法快速提取放线菌基因组DNA[J]. 微生物学通报,2003,30(4):82-84.
[9]陈义光,张晓蓉,张丽,等. 具抗菌活性海洋放线菌菌株JMC 06001的分离和鉴定[J]. 微生物学通报,2008,35(1):40-44.
[10]邵彦坡,方丽萍,魏少鹏,等. 海洋放线菌B5菌株发酵液抗菌谱及稳定性研究[J]. 西北农业学报,2007,16(3):248-251,256.
[11]刘姝,陆兆新,吕凤霞,等. 一株海洋放线菌的分类鉴定及抗菌活性研究[J]. 南京农业大学学报,2007,30(4):124-129.
[12]刘妍,李志勇. 海洋放线菌研究的新进展[J]. 生物技术通报,2005(6):34-39.
[13]宋金枝. 放线菌不同施入方式对连作番茄幼苗生长的影响[J]. 西北农业学报,2014,23(2):187-190.
[14]胡磊,牛世全,景彩虹,等. 拮抗油菜菌核病菌的链霉菌分离筛选与鉴定[J]. 中国油料作物学报,2013,35(1):69-73.
[15]赵娟,薛泉宏,杜军志,等. 广谱拮抗放线菌C28的鉴定及其对甜瓜蔓枯病的防治效果[J]. 西北农林科技大学学报:自然科学版,2012,40(9):65-71.蒋桂芳,宋力. 拮抗放线菌F2发酵液的稳定性[J]. 江苏农业科学,2015,43(9):184-185,330.

