高静水压处理对牛初乳中IgG的影响
任 杰,胡志和,*,孙振刚,武文起,冯永强,李金星
(1.天津市食品生物技术重点实验室,天津商业大学生物技术与食品科学学院,天津 300134;2.天津海河乳业有限公司,天津 300402)
高静水压处理对牛初乳中IgG的影响
任 杰1,胡志和1,*,孙振刚2,武文起2,冯永强2,李金星1
(1.天津市食品生物技术重点实验室,天津商业大学生物技术与食品科学学院,天津 300134;2.天津海河乳业有限公司,天津 300402)
采取不同的高静水压条件(处理压强、施压温度、保压时间)处理产犊后48 h内的牛 初乳,研究高静水压处理牛初乳对免疫球 蛋白G(immunoglobulin G,IgG)活性的影响。将牛初乳离心去除酪蛋白、乳脂肪等,取上清液进行高静水压处理,采用高效液相色谱法和十二烷基硫酸钠-聚丙烯酰胺凝胶电泳法(sodium dodecyl sulfa tepolyacrylamide gel electrophoresis,SDS-PAGE)对处理后的样 品进行检测。结果 表明:高静水压处理后的样品,经高效液相色谱仪检测,其与亲和色谱柱发生特 异性吸附的能力下降,IgG检出质量浓度降低;经SDS-PAGE检测和凝胶电泳成像仪扫描处理,不同处理条件下IgG的轻链和重链的质量变化不显著。因此,当牛初乳在200 MPa、30 ℃和20 min的高静水压处理条件下,IgG的活性最好,检出质量浓度为16.843 9 mg/mL。
牛初乳;免疫球蛋白G;高静水压;高效液相色谱;十二烷基硫酸钠-聚丙烯酰胺凝胶电泳
牛初乳富含维生素、矿物质和优质蛋白质等营养成分,以及生长因子等活性功能组分。牛初乳能抑制并消灭病原菌,增强人体免疫力、促进组织生长、减少对抗生素的依赖性,且无任何副作用[1-2],是替代人初乳的优良资源[3]。IgG是重要的免疫球蛋白,也是牛初乳中最重要的免疫因子,它占免疫球蛋白总组分的80%~90%[4],能部分取代人类母乳IgA的功能[5]。然而,牛初乳加工中常用的处理方式有冷冻干燥和喷雾干燥。由于牛初乳耐热性能差,加热至60 ℃以上即开始形成凝块,喷雾干燥对IgG等活性成分破坏较大、营养成分损失多;冷冻干燥灭菌效果差、生物安全性不佳。现采用高静水压技术(又称超高压技术)[6],该技术是一个纯粹利用物理作用处理食品的过程,其优势在于杀灭微生物的同时不破坏食品中的营养成分、色泽以及风味。
苏丹[7]、Puppo[8]等的研究表明,蛋白质经过高压处理后结构会发生变化,张和平等[9]在室温下高压处理牛乳20 min后发现,IgG的变性程度随着处理压强增大而增加。本实验采用高静水压技术处理牛初乳,研究其对牛初乳中IgG的影响,采用高效液相色谱法(high performance liquid chromatography,HPLC)对其进行检测,并辅以十二烷基硫酸钠-聚丙烯酰胺凝胶电泳法(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)检测L链和H链的质量变化,为牛初乳制品的研究和开发提供一定的参考。
1 材料与方法
1.1材料与试剂
牛初乳(产犊48 h内)由天津市武清区德兴隆奶业有限公司提供。
IgG标准品 北京成文免疫化学研究室;浓盐酸 天津市化学试剂批发公司;NaOH、KH2PO4、乙醇(色谱纯) 天津市赢达稀贵化学试剂厂;甲醇(分析纯)、冰乙酸(分析纯) 天津市风船化学试剂科技有限公司;L-5750 Sigma SDS、252859 Sigma Tris、G7126 Sigma甘氨酸 美国Sigma公司;实验用水均为超纯水。
1.2仪器与设备
HPP.L3-600/0.6超高压设备 天津市华泰森淼生物工程技术有限公司;Hi-Trap Protein G HP(1 mL)色谱柱 宜科思源科技有限公司;1500Q05/2000ES全自动四元梯度高效液相色谱仪 美国科学系统公司;3-16PK离心机 美国Sigma公司;KQ-250B超声波振荡器 上海五相仪器仪表有限公司;Bio-Rad凝胶电泳成像仪 美国Bio-Rad公司;JY-SCZ2+型电泳槽、JY600型电泳仪北京君意东方电泳设备有限公司。
1.3牛初乳的高静水压处理条件
初乳清的制备:牛初乳于4 ℃、5 000 r/min离心30 min除去脂肪,再将脱脂后的初乳继续于4 ℃、4 000 r/min离心35 min,弃去底部的酪蛋白沉淀和上层的残余油脂,即可得到初乳清[10]。
量取制备的初乳清装于聚乙烯塑料袋内,抽真空、密封后进行高静水压处理,采用HPLC法和SDS-PAGE法检测高压处理后初乳清样品中的IgG,对照组为未经高静水压处理的初乳清。
1.3.1处理压强对牛初乳中IgG的影响
施压温度为30 ℃,保压时间为20 min,处理压强分别选取100、200、300、400、500、600 MPa的条件处理初乳清。
1.3.2施压温度对牛初乳中IgG的影响
处理压强为350 MPa,保压时间为20 min,施压温度分别选取20、25、30、35、40 ℃的条件处理初乳清。
1.3.3保压时间对牛初乳中IgG的影响
处理压强为350 MPa,施压温度为30 ℃,保压时间分别选取10、20、30、40、50、60 min的条件处理初乳清。
1.4HPLC法检测IgG[11]
1.4.1溶液的配制
流动相A液:pH 6.5、0.05 mol/L的磷酸盐缓冲液;流动相B液:pH 2.5、0.05 mol/L的甘氨酸盐酸缓冲液。
实验用水和流动相先用0.45 μm微孔滤膜过滤,再经过超声波脱气30 min后再上样分析。
试样的处理和溶液的配制按照GB/T 5009.194—2003《保健食品中免疫球蛋白IgG的测定》进行操作,每个样品平行测定3 次,经0.45 μm微孔膜过滤后上样分析。
1.4.2HPLC分析条件
色谱柱:Pharmacia Hi-Trap Protein G柱,1 mL;流速:0.4 mL/min;柱温:25 ℃;波长:280 nm;进样体积:20 μL。梯度洗脱程序见表1。

表1 高效液相色谱法检测IgG的梯度洗脱程序Table1 Gradient elution conditions for IgG detection by HPLC
1.4.3绘制IgG标准曲线
称取IgG标准品,用流动相A液稀释成IgG的质量浓度分别为0.02、0.05、0.10、0.20、0.40 mg/mL的标准系列,临用时配制,经0.45 μm微孔膜过滤后上样分析,每个质量浓度分别设置3 个平行。根据紫外检测器读出波长280 nm处的吸光度,以IgG的质量浓度为横坐标,以峰面积为纵坐标,绘制IgG不同质量浓度的标准曲线。
1.4.4SDS-PAGE法检测牛初乳中的IgG
电泳条件:pH 8.8、12%分离胶和pH 6.8、5%浓缩胶,上样缓冲液是2×SDS缓冲液,电泳缓冲液是Tris-甘氨酸电泳缓冲液,上样量为10 μL,200 V恒压电泳70 min,染色40 min,脱色过夜。
条带含量检测:采用Bio-Rad凝胶电泳成像分析仪对条带进行凝胶成像处理,Quantity One软件分析条带含量。
1.5数据处理
数据分析和图表制作利用软件Quantity One和Excel 2007。
2 结果与分析
2.1 IgG的标准曲线及色谱图
本实验所得IgG质量浓度的标准曲线方程为:y=741 070x+652 107,相关系数R2=0.999 5,表明IgG在所设定的质量浓度范围内线性关系良好,结果具有较高的可信度。图1是IgG标准品的高效液相色谱图,图2是350 MPa、30 ℃保压20 min的高压处理条件下牛初乳样品中IgG色谱图。其中,未经高静水压处理的对照组样品中IgG的质量浓度平均值为30.977 mg/mL。

图1 IgG标准品色谱图Fig.1 Standard chromatogram of IgG
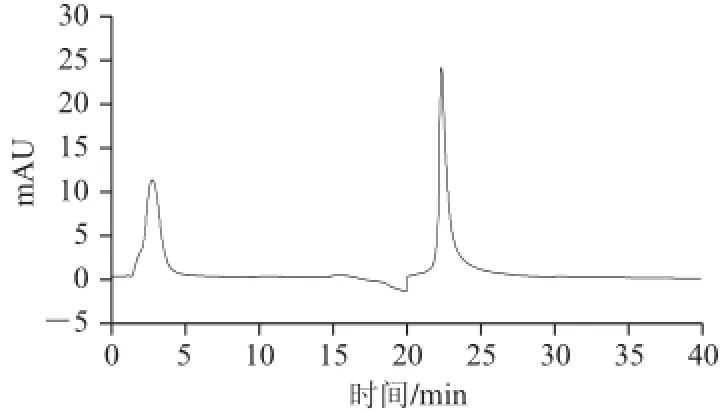
图2 350 MPa、30 ℃保压20 min的高压处理条件下牛初乳样品中IggGG色谱图Fig.2 Chromatogram of IgG in bovine colostrums treated with 350 MPa pressure at 30 ℃ for 20 min
2.2压强大小对牛初乳IgG活性的影响
当施压温度和保压时间分别为30 ℃和20 min时,选取100、200、300、400、500、600 MPa的压强条件处理初乳清,HPLC法检测结果如图3所示,SDS-PAGE法检测结果如图4、表2所示。
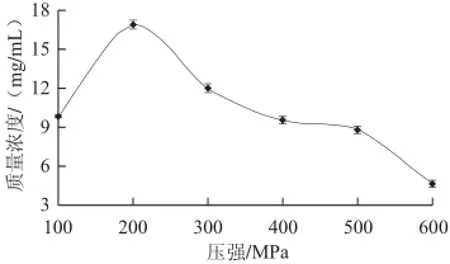
图3 30 ℃保压20 min条件下不同压强处理对牛初乳中IgG的影响Fig.3 Effect of different pressure treatments at 30 ℃ for 20 min on IgG concentration of bovine colostrums
由图3可知,将其与对照组初乳清中IgG的质量浓度进行比较,发现牛初乳经过高静水压处理后,用HPLC法检测质量浓度与对照组(30.977 mg/mL)相比明显下降。在实验压强范围内,当压强从100 MPa升高到200 MPa时,IgG的检出质量浓度增加显著;继续升高压强,IgG的检出质量浓度则逐渐减小;在200 MPa时,IgG的检测值最高,为16.843 9 mg/mL;在600 MPa时最低,为4.649 4 mg/mL。这种变化的原因可能是由于压强的变化导致蛋白质的分子结构发生变化,使其与亲和色谱柱发生特异性吸附的能力下降,而且操作压强越大,分子结构变化越严重,结合能力越弱[12]。
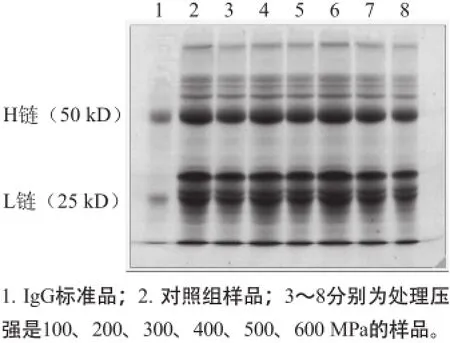
图4 30 ℃保压20 min条件下经不同压强处理后牛初乳的SDS-PAGE图谱Fig.4 SDS-PAGE electrophoresis patterns for bovine colostrums treated with different pressures at 30 ℃ for 20 min
SDS-PAGE检测结果如图4所示。根据SDS-PAGE原理,SDS多肽复合物在聚丙烯酰胺凝胶电泳中的迁移率只与多肽的分子质量有关,如条带1中下面是IgG的轻(L)链,上面是IgG的重(H)链,且H链的量要高于L链[13]。Quantity One软件分析IgG中L链和H链含量的比例结果如表2所示,L链和H链在不同处理压强下占各自泳道的含量几乎没有什么变化,比例虽然不一致,但相差不大,显著性分析结果亦显示L链和H链的质量变化不显著,说明高静水压处理并没有导致IgG质量的减少。
表2 30 ℃保压20 min条件下经不同压强处理后牛初乳中IgG的轻链和重链含量的比例Table2 Content ratios of light and heavy chains in IgG for bovine colostrums treated with different pressures at 30 ℃ for 20
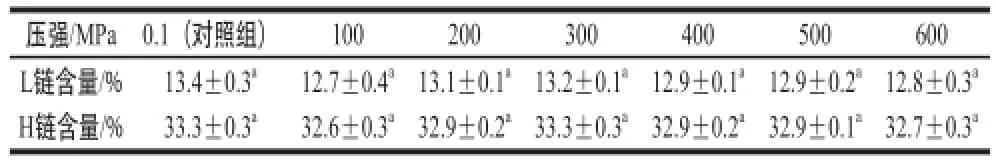
表2 30 ℃保压20 min条件下经不同压强处理后牛初乳中IgG的轻链和重链含量的比例Table2 Content ratios of light and heavy chains in IgG for bovine colostrums treated with different pressures at 30 ℃ for 20
注:a. 与对照组无显著性差异(P>0.05);b. 与对照组有显著性差异(P<0.05)。表3、4同。
压强/MPa0.1(对照组)100200300400500600 L链含量/%13.4±0.3a12.7±0.4a13.1±0.1a13.2±0.1a12.9±0.1a12.9±0.2a12.8±0.3aH链含量/%33.3±0.3a32.6±0.3a32.9±0.2a33.3±0.3a32.9±0.2a32.9±0.1a32.7±0.3a
2.3施压温度对牛初乳中IgG活性的影响
当处理压强和保压时间分别为350 MPa和20 min时,选取20、25、30、35、40 ℃的温度条件处理初乳清,高效液相色谱法检测结果如图5所示,SDS-PAGE法检测结果如图6和表3所示。

图5 350 MPa保压20 min条件下不同温度处理对牛初乳中IgG的影响Fig.5 Effect 350 MPa pressure treatment at different temperatures for 20 min on IgG concentration of bovine colostrums
由图5可知,与对照组(30.977 mg/mL)相比,经过高静水压处理以后,牛初乳中IgG的检出质量浓度下降。在所测温度范围内,牛初乳中的IgG在25 ℃时检出质量浓度最低,为3.131 6 mg/mL。当温度低于25 ℃时,IgG的检出质量浓度随着温度的升高而降低;当温度高于25 ℃时,变化趋势则与之相反;当温度达到40 ℃时,IgG的检出质量浓度明显提高,达到14.710 1 mg/mL。由于高压条件下温度对IgG空间的结构有影响[14],导致牛初乳中IgG的检出质量浓度发生变化。
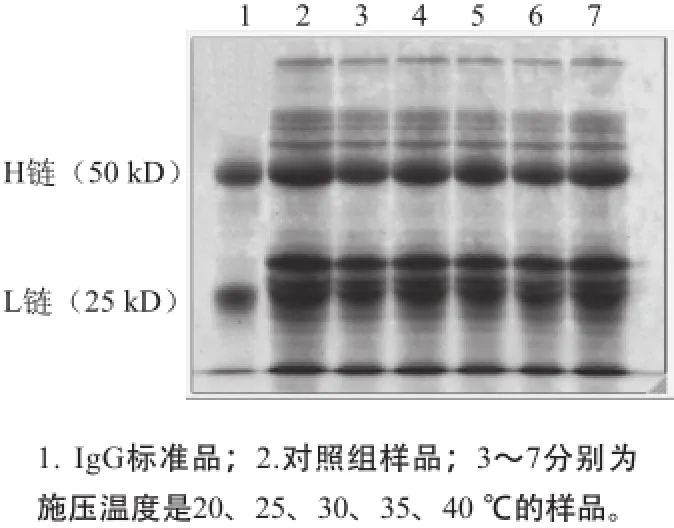
图6 350 MPa保压20 min条件下经不同温度处理后牛初乳的SDS-PAGE图谱AGEFig.6 SDS-PAGE electrophoresis patterns for bovine colostrums treated with 350 MPa pressure at different temperatures for 20 min
由图6可知,处理后样品的IgG的轻链和重链条带没有明显的不同,由表3可知,在不同的施压温度下,L链含量差仅为1.2%,H链含量差为1.0%,两者都没有明显的不同,说明高静水压处理对IgG中L链和H链的质量没有明显影响。
表3 350 MPa保压20 min条件下不同温度处理后牛初乳中IgG的轻链和重链含量Table3 Content ratios of light and heavy chains in IgG in bovinecolostrums treated with 350 MPa pressure at different temperatures for2 min

表3 350 MPa保压20 min条件下不同温度处理后牛初乳中IgG的轻链和重链含量Table3 Content ratios of light and heavy chains in IgG in bovinecolostrums treated with 350 MPa pressure at different temperatures for2 min
温度/℃对照组2025303540 L链含量/%12.5±0.4a13.0±0.3a12.8±0.3a13.4±0.3a12.2±0.4b13.0±0.3aH链含量/%34.6±0.4a35.2±0.4a34.9±0.3a35.4±0.5a34.4±0.4a34.9±0.1a
2.4保压时间对牛初乳中IgG活性的影响
当处理压强和施压温度为350 MPa和30 ℃时,分别选取10、20、30、40、50、60 min的时间条件处理牛初乳,HPLC法检测结果如图7所示,SDS-PAGE法检测结果如图8和表4所示。

图7 350 MPa施压温度30 ℃条件下不同时间处理对牛初乳中IgG的影响Fig.7 Effect of 350 MPa pressure treatment at 30 ℃ for different time periods on IgG concentration of bovine colostrums
对照组中IgG的检出质量浓度为30.977 mg/mL,而经高静水压处理后,由图7可知,牛初乳中IgG的检出质量浓度与对照组样品相比均比较低。在保压时间变化范围内,牛初乳中的IgG含量随着保压时间的延长而逐渐减少。当保压时间为10 min时,IgG的检出质量浓度为15.743 2 mg/mL;当保压时间达到60 min时,IgG的检出质量浓度为2.826 0 mg/mL,前后变化显著,说明保压时间对牛初乳中IgG与色谱柱结合活性影响较大。

图8 350 MPa施压30 ℃条件下经不同保压时间处理后牛初乳的SDS-PAGE图谱AGEFig.8 SDS-PAGE electrophoresis patterns for bovine colostrums treated with 350 MPa pressure at 30 ℃ for different time periods
表4 350 MPa施压30 ℃条件下不同保压时间处理后牛初乳中IgG的轻链和重链含量Table4 Content ratios of light and high chains in IgG in bovine colostrums treated with 350 MPa pressure at 30 ℃ for different timeprods
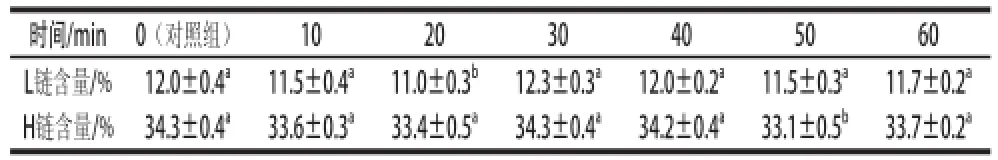
表4 350 MPa施压30 ℃条件下不同保压时间处理后牛初乳中IgG的轻链和重链含量Table4 Content ratios of light and high chains in IgG in bovine colostrums treated with 350 MPa pressure at 30 ℃ for different timeprods
时间/min0(对照组)102030405060 L链含量/%12.0±0.4a11.5±0.4a11.0±0.3b12.3±0.3a12.0±0.2a11.5±0.3a11.7±0.2aH链含量/%34.3±0.4a33.6±0.3a33.4±0.5a34.3±0.4a34.2±0.4a33.1±0.5b33.7±0.2a
由图8和表4可知,牛初乳IgG中L链和H链含量的比例之间的差值不大,显著性分析结果显示,当保压时间为20 min时,牛初乳IgG中L链的含量比例与对照组有显著性差别,当保压时间为50 min时,此时牛初乳中H链的含量比例与对照组有显著性差别,但平均值之间进行比较却相差不大,表明高静水压处理对IgG分子L链和H链的质量并没有影响。
3 讨 论
IgG分子是由两条L链和两条H链通过两个二硫键(—S—S—)连接所成[15],其结构区域分为C端的稳定区(C区)和N端的可变区(V区),可变区又分为超变区和骨架区[16]。HPLC法采用亲和色谱柱,免疫亲和固定相以蛋白质A为配位体,特异性结合IgG分子中的稳定区域Fc段[17]。高静水压处理后IgG的活性降低,因为高压可使IgG分子变性,IgG的Fc段与亲和色谱柱的固定相结合能力下降,检出质量浓度降低。Trujillo等[18]研究发现,高压处理会降低IgG的活性,与本实验中IgG的活性变化相符。酶联免疫法检测高压处理的牛初乳时,IgG活性出现一定的增加[19],这与HPLC法检测的结果存在差异。原因可能在于酶联免疫中抗原与抗体发生特异性结合的位置在超变区域[20];酶联免疫检测的样品未经离心处理,牛初乳中的脂肪等物质会在超高压处理时形成一定的保护作用。
Masuda等[21]采用SDS-PAGE检测经过高静水压处理牛初乳中的免疫球蛋白,IgG的L链和H链的含量并没有发生变化,这与本实验结果一致。高静水压处理后IgG的活性降低而L链和H链的含量却没有减少,其原因是高压处理导致IgG分子结构发生变化,而SDS-PAGE检测时IgG分子的L链和H链均被打开,其分子结构的改变并不影响电泳条带。
4 结 论
高压处理改变了IgG分子的高级结构,使其与亲和色谱柱发生特异性结合的能力下降,从而导致活性的降低,检出质量浓度下降,当处理压强为200 MPa、施压温度为30 ℃、保压时间为20 min时牛初乳中IgG的活性最强,检出质量浓度最高,但是超高压处理并不会破坏蛋白质分子的一级结构,IgG的质量不会发生变化。
[1] MICHAELIDOU A, STEIJNS J. Nutritional and technological aspects of minor bioactive components in milk and whey: growth factors,vitamins and nucleotides[J]. International Dairy Journal, 2006, 16(11): 1421-1426.
[2] SINDAYIKENGERA S, XIA Wenshui. Milk biologically active components as nutraceuticals: review[J]. Critical Reviews in Food Science and Nutrition, 2005, 45(7/8): 645-656.
[3] 赵圣国, 王加启, 刘开朗, 等. 乳及乳制品中IgG含量检测方法概述[C]//中国奶业协会2009年会论文集. 北京: 中国奶业协会, 2009: 115-116.
[4] FARRELL H M, Jr, JIMENEZ-FLORES R, BLECK G T, et al. Nomenclature of the proteins of cows’ milk-sixth revision[J]. Journal of Dairy Science, 2004, 87(6): 1641-1674.
[5] 赵明, 刘宁. 免疫调节功能性食品: 牛初乳[J]. 中国食物与营养,2006(5): 55-57.
[6] 桂仕林, 邢慧敏, 康小红, 等. 超高压对牛乳成分影响的研究进展[J].农产品加工, 2011(6): 67-69.
[7] 苏丹, 李树君, 赵凤敏, 等. 超高压处理对大豆分离蛋白结构的影响[J].食品科技, 2009, 34(12): 51-55.
[8] PUPPO M C, SPERONI F, CHAPLEAU N, et al. Effect of highpressure treatment on emulsifying properties of soybean proteins[J]. Food Hydrocolloids, 2005, 19(2): 289-296.
[9] 张和平, 德力格尔桑, 郭军, 等. 高压下牛乳IgG的变性及稳定化作用[J]. 食品科学, 1998, 19(4): 10-12.
[10] 马燕芬, 陈志伟, 魏晓兵, 等. 高效液相色谱法测定牛初乳中IgG含量的方法研究[J]. 饲料工业, 2007, 28(5): 33-38.
[11] 中国国家标准化管理委员会. GB/T 5009.194—2003 保健食品中免疫球蛋白IgG的测定[S]. 北京: 中国标准出版社, 2003.
[12] 徐丹, 马涛, 岳喜庆. 超滤法分离牛血清中IgG的研究[J]. 食品科学,1991, 56(4): 916-919.
[13] 胡晓苗, 余为一, 张丹俊. 犬血清IgG的纯化、抗体制备及其鉴定[J].安徽农业科学, 2008, 36(21): 8940; 9078.
[14] 张小平. 超滤法对牛初乳中IgG含量和活性的影响[J]. 乳业科学与技术, 2006, 28(1): 4-6.
[15] 李忠秋, 郭镇华, 吴赛辉, 等. 牛初乳中生长因子及抗菌因子的生物活性及其功能研究进展[J]. 中国奶牛, 2006(8): 43-45.
[16] INDYK H E, WILLIAMS J W, PATEL H A. Analysis of denaturation of bovine IgG by heat and high pressure using an optical biosensor[J]. International Dairy Journal, 2008, 18(4): 359-366.
[17] 于世林. 亲和色谱方法及应用[M]. 北京: 化学工业出版社, 2008: 159.
[18] TRUJILLO A J, CASTRO N, QUEVEDO J M, et al. Effect of heat and high-pressure treatments on microbiological quality and immunoglobulin G stability of caprine colostrum[J]. Journal of Dairy Science, 2007, 90(2): 833-839.
[19] 任杰, 胡志和, 吴子健, 等. 超高压处理对牛初乳中IgG活性的影响[J].食品工业科技, 2013, 34(20): 280-283.
[20] INDYK H E, WILLIAMS J W, PATEL H A. Analysis of denaturation of bovine IgG by heat and high pressure using an optical biosensor[J]. International Dairy Journal, 2008, 18(4): 359-366.
[21] MASUDA T, REHINARUDO H Y, SUZUKI K, et al. The effect of high hydrostatic pressure treatment on the preservability and the immunological activity of bovine colostrum[J]. Asian-Australasian Journal of Animal Sciences, 2000, 13(9): 1323-1328.
Effects of High Hydrostatic Pressure on IgG in Bovine Colostrum
REN Jie1, HU Zhihe1,*, SUN Zhengang2, W U Wenqi2, FENG Yongqiang2, LI Jinxing1
(1. Tianjin Key Laboratory of Food Biotechnology, College of Biotechnology and Food Science, Tianjin University of Commerce,Tianjin 300134, China; 2. Tianjin Haihe Dairy Co. Ltd., Tianjin 300402, China)
The objective of this study was to investigate the effects of high hydrostatic pressure on IgG in bovine colostrum. Bovine colostrum collected at 48 h after calving was treated under varying conditions of pressure, temperature and holding time, and subsequently centrifuged to remove casein, milk fat and other substances. The supernatant was treated with different high hydrostatic pressures, and the treated samples were analyzed by HPLC and SDS-PAGE electrophoresis. The HPLC results showed that for the sample treated by high hydrostatic pressure, the specific adsorption ability with affinity chromatography column was reduced and IgG was detected from it at a lower concentration. Moreover, the light and heavy chains of IgG were not changed significantly as shown by SDS-PAGE electrophoresis analysis and gel electrophoresis imaging scanner. Therefore, optimal IgG activity was obtained, and the detectable concentration was 16.843 9 mg/mL when bovine colostrum was treated with high hydrostatic pressure at 200 MPa and 30 ℃ for 20 min.
bovine colostrum; immunoglobulin G (IgG); high hydrostatic pressure; high performance liquid chromatography(HPLC); sodium dodecyl sulfate-polyacrylamide gel electrophoresis (SDS-PAGE)
TS525.41
A
1002-6630(2015)03-0063-05
10.7506/spkx1002-6630-201503012
2014-02-10
天津市科技计划项目(14ZCZDNC00017);天津市高等学校创新团队项目(TD12-5049)
任杰(1988—),女,硕士,研究方向为食品生物技术。E-mail:renjie9631@163.com
胡志和(1962—),男,教授,硕士,研究方向为专用功能食品。E-mail:hzhihe@tjcu.edu.cn

