酶解缫丝蚕蛹蛋白抗氧化肽的分离与稳定性研究
丁顺杰,罗金凤,丁晓雯,黄先智*
(1.西南大学食品科学学院,重庆市农产品加工及贮藏重点实验室,重庆 400715;2.西南大学蚕学与系统生物学研究 所,重庆 400715)
酶解缫丝蚕蛹蛋白抗氧化肽的分离与稳定性研究
丁顺杰1,罗金凤1,丁晓雯1,黄先智2,*
(1.西南大学食品科学学院,重庆市农产品加工及贮藏重点实验室,重庆 400715;2.西南大学蚕学与系统生物学研究 所,重庆 400715)
目的:研究酶解缫丝蚕蛹蛋白抗氧化肽的分离和稳定性,为其开发应用提供基础数据。方法:超滤分离酶解缫丝蚕蛹蛋白抗氧化肽,比色法测定其抗氧化能力。结果:超滤分级后得到分子质量为200~3 000 D的酶解缫丝蚕蛹蛋白抗氧化肽对O2-•、•OH、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基的IC50分别为18.85 mg/mL、3.13 mg/mL、35.23 μg/mL。该抗氧化肽经过4 h胃蛋白酶+胰蛋白酶处理前后对DPPH自由基清除率分别为81.05%、82.26%;在pH 4、8条件下处理1 h,对DPPH自由基清除率分别为98.02%、11.80%(100 μg/mL);在温度95 ℃条件下处理1 h,对DPPH自由基清除率为87.11%(100 μg/mL);用浓度为1.0 mol/L的NaCl处理6 h,相比对照组,对DPPH自由基清除率由51.58%下降到22.68%(60 μg/mL)。结论:超滤后得到的分子质量为200~3 000 D的酶解缫丝蚕蛹蛋白抗氧化肽的抗氧化能力比酶解原液有一定提高;且在酸性、高温、脱盐处理后对DPPH自由基的清除能力保持较好;胃肠道消化酶对其DPPH自由基清除能力的影响不显著(P>0.05)。
酶解缫丝蚕蛹蛋白;抗氧化肽;分离纯化;稳定性
机体氧化产生的自由基与人体衰老及许多疾病有关[1-2]。抗氧化肽由于其良好的抗氧化活性、低毒性、分子质量小、易吸收等特性而成为近年来研究的热点之一[3]。我国是世界最大的蚕茧生产国,年产鲜茧60余万 t[4]。蚕蛹是蚕茧缫丝后的主要副产物,其蛋白质含量丰富,占干蚕蛹质量的45%~55%[5]。蚕蛹蛋白质含有18 种氨基酸,其中8 种人体必需氨基酸含量占氨基酸总量的40%以上,高于世界卫生组织与联合国粮农组织提出的参考蛋白模式,且比例适当,是一种优质、丰富的蛋白源[6-7]。由于缫丝蚕蛹的理化、功能性质发生了改变和特殊腥味,不宜作为食品直接食用,因此目前缫丝蚕蛹多作为动物饲料,使其附加值没能得到充分发挥,如何更好地开发利用缫丝蚕蛹蛋白成为推动我国蚕桑产业发展的关键环节之一。
近年来,利用酶工程技术将蚕蛹蛋白开发为生物活性肽的研究时有报道[8-11],本实验室也通过酶处理技术对缫丝蚕蛹蛋白进行分解,得到了有较强抗氧化能力的肽混合物。本实验采用超滤分离技术,对酶解后的缫丝蚕蛹蛋白肽进行分离,考察得到的各组分抗氧化活性并对它们对多种理化因素的稳定性进行评价,为缫丝蚕蛹蛋白抗氧化肽的深入开发提供实验依据。
1 材料与方法
1.1材料与试剂
脱脂缫丝蚕蛹蛋白:自制。将干燥的缫丝蚕蛹粉碎,以石油醚作溶剂用索式提取器抽提12 h以去除其中的脂肪,将剩余物干燥、粉碎而得脱脂蚕蛹蛋白粗粉。
缫丝蚕蛹蛋白水解专用酶(酶活力为105U/g) 南宁东恒华道生物科技有限公司;牛血清白蛋白 上海伯奥生物科技有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、Folin-酚美国Sigma-Aldrich公司;其他试剂均为分析纯。
1.2仪器与设备
MSM-2008实验用超滤微滤膜分离装置、HPS-3聚醚砜卷式超滤柱、RO-1812芳香聚酰胺卷式纳滤柱 上海摩速科学器材有限公司;SHZ-Ⅲ真空泵 上海亚荣生化仪器厂;UV2000紫外-可见分光光度计 日本Shimadzu公司;ALPAAI-4LIC真空冷冻干燥机 美国Sigma-Aldrich公司;HD-5电脑核酸蛋白(紫外)检测仪、HL-2恒流泵、CBS-A程控全自动部分收集器 上海青浦沪西仪器厂;Elix10纯水机、Milli-Qbiocel超纯水机 美国Millipore公司。
1.3方法
1.3.1缫丝蚕蛹蛋白抗氧化肽的制备
根据本实验室前期的研究结果,取脱脂缫丝蚕蛹蛋白粗粉配制成7%的酶解底物,用1 mol/L的NaOH调节pH值为7.2,按质量分数3%的加酶量加入缫丝蚕蛹蛋白水解专用酶,53 ℃酶解4 h。酶解过程中不断滴加1 mol/L的NaOH或HCl以维持pH值稳定。沸水浴10 min灭酶结束酶解,流动水冷却,4 000 r/min离心15 min,收集上清液冷冻备用。测得上清液还原力吸光度为0.75,O2-・和DPPH自由基清除率分别为34.54%和79.38%。
1.3.2缫丝蚕蛹蛋白抗氧化肽的超滤分级
抽滤:将缫丝蚕蛹蛋白酶解液用0.45 μm有机滤膜抽滤,去除酶解液中的大颗粒杂质。超滤:将抽滤后酶解液上超滤分离装置进行超滤。超滤条件为压强0.25 MPa、常温,用截留分子质量为3 000 D有机超滤膜处理,得到分子质量大于3 000 D和小于3 000 D的超滤片段;将后者再用截留分子质量为100~200 D的有机滤膜处理,超滤条件为压强0.4 MPa、常温,得到分子质量为200~3 000 D组分和分子质量小于200 D的组分。收集酶解原液、分子质量大于3 000 D组分和200~3 000 D组分进行真空冷冻干燥,作为抗氧化活性检测样本备用。
1.3.3缫丝蚕蛹蛋白抗氧化肽抗氧化能力评价
1.3.3.1还原力的测定
参考Oyaizu[12]的铁氰化钾还原法测定还原力。将酶解原液、分子质量大于3 000 D和200~3 000 D的酶解组分分别配成0.1、0.3、0.5、1.0、2、5、10 mg/mL的溶液,同时分别配制0.005、0.01、0.03、0.05、0.1、0.2、0.4 mg/mL的VC溶液,作为阳性对照,在700 nm波长处测定吸光度。
1.3.3.2超氧阴离子自由基(O2-・)清除能力的测定
将酶解原液、分子质量大于3 000 D和200~3 000 D组分分别配成0.5、1、2、5、10、20、30 mg/mL的溶液,同时分别配制0.01、0.03、0.05、0.1、0.2、0.4 mg/mL的VC溶液,作为阳性对照。
测定方法参考文献[13-14]加以改进。吸取缫丝蚕蛹蛋白肽稀释液1.0 mL,加入2.5 mL的0.1 mol/L Tris-HCl缓冲溶液(pH 8.2),混匀,在25 ℃水浴保温10 min后加入10 μL 50 mmol/L的邻苯三酚(25 ℃水浴预热),迅速混匀并开始计时,每隔30 s在320 nm处测定吸光度A320nm,5 min后结束测定。作吸光度随时间变化的回归方程,其斜率为缫丝蚕蛹蛋白酶解液对邻苯三酚自氧化速率v2;以蒸馏水作空白对照,其斜率为蒸馏水邻苯三酚自氧化速率v1,按照公式(1)计算O2-・清除率,由对O2-・的清除率计算半数清除浓度(IC50)。

1.3.3.3羟自由基(・OH)清除能力的测定
[15-16]中的方法进行测定。将酶解原液、分子质量大于3 000 D和200~3 000 D组分分别配成0.5、1、2、5、10、20、30 mg/mL的溶液,同时分别配制0.01、0.03、0.05、0.1、0.2、0.4 mg/mL的VC溶液,作为阳性对照,由对・OH的清除率计算出其对・OH的IC50。
1.3.3.4DPPH自由基清除能力的测定
测定方法参考文献[17-18]加以改进。将酶解原液、分子质量大于3 000 D和200~3 000 D组分分别配成10、20、40、60、80、100、120、140、160、200 ☒g/mL的溶液,同时分别配制1、2、3、4、5、6、7、8、9、10 μg/mL的VC溶液,作为阳性对照。分别取3.0 mL缫丝蚕蛹蛋白酶解液于试管中,加入3.0 mL 20 μg/L DPPH自由基溶液(乙醇配制,避光保存)摇匀,放置30 min后在517 nm波长处测定其吸光度。在相同反应体系下分别测定空白对照组、样品颜色组干扰的吸光度,按照公式(2)计算DPPH自由基的清除率,由对DPPH自由基的清除率计算出其对DPPH自由基的IC50。
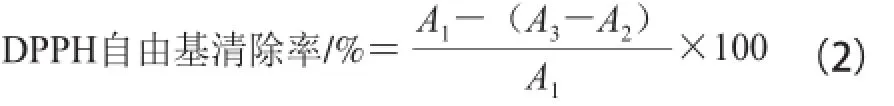
式中:A1为空白对照组的吸光度;A2为样品组吸光度;A3为样品颜色组干扰的吸光度。
1.3.4200~3 000 D的缫丝蚕蛹蛋白抗氧化肽稳定性检测
1.3.4.1对消化酶的稳定性检测[19]
对胃蛋白酶的稳定性:模拟人体自然生理消化过程,用pH 2.0 HCl-KCl缓冲液配制样品,根据样品质量,加入质量分数1%的胃蛋白酶,在37 ℃酶解3 h,酶解结束后在沸水浴中加热10 min终止反应,流动水冷却,5 000 r/min离心15 min,取上清液测定其对DPPH自由基的清除率,并做空白对照。
对胰蛋白酶的稳定性:在经过胃蛋白酶处理后的缫丝蚕蛹蛋白抗氧化肽中加入质量分数1%的胰蛋白酶,在37 ℃、pH 8.0条件下酶解3 h,在沸水浴中加热10 min终止反应,流动水冷却,5 000 r/min离心15 min,取上清液测定对DPPH自由基的清除率,并做空白对照。
1.3.4.2对pH值变化的稳定性检测
将缫丝蚕蛹蛋白抗氧化肽样品分别溶于pH值为2、4、6、8、10、12的Na2HPO4-柠檬酸缓冲溶液中配成质量浓度为100 μg/mL的溶液,用1 mol/L HCl和1 mol/L NaOH调节至相应pH值,用蒸馏水作对照,37 ℃保温5 h,每1 h测定其对DPPH自由基的清除率。
1.3.4.3对温度变化的稳定性检测
将缫丝蚕蛹蛋白抗氧化肽样品溶于超纯水中配成质量浓度为100 μg/mL的测试液,置于温度分别为25、35、45、55、65、75、85、95 ℃水浴保温3 h,室温作对照。每30 min取样在冰水浴中迅速冷却到室温,测定其对DPPH自由基的清除率。
1.3.4.4对NaCl溶液的稳定性检测
将缫丝蚕蛹蛋白抗氧化肽样品用浓度分别为0.2、0.4、0.6、0.8、1.0、1.2 mol/L的NaCl溶液配制为60 ☒g/mL的溶液,室温放置6 h,每1 h取样测定其对DPPH自由基的清除率。以蒸馏水作对照。
1.4数据处理
实验结果为3 次重复实验的平均值,采用Excel 2007、SPSS 17.0进行数据分析。
2 结果与分析
2.1超滤分级前后酶解缫丝蚕蛹蛋白抗氧化肽的抗氧化能力评价
2.1.1超滤分级前后各组分的还原力
多项研究表明,抗氧化活性与还原力存在正相关[20-22]。还原力可表示抗氧化物质提供电子的能力,还原能力强的物质是良好的电子供体,可以与自由基反应,通过提供电子使自由基变为稳定的物质,从而阻断自由基的链式反应,为物质清除活性氧等自由基或发挥抗氧化作用提供了可能[23]。

图1 超滤分离前后各组分的还原力Fig.1 Reducing power of the hydrolysate and its ultrafiltration fractions
由图1可知,缫丝蚕蛹蛋白抗氧化肽超滤分离前后各组分的还原力随着质量浓度的增加逐渐增大,存在明显的剂量-效应关系;达到一定质量浓度后,还原力不再增大。在质量浓度低于5 mg/mL时,分子质量为200~3 000 D组分的还原力高于酶解原液和分子质量大于3 000 D的组分;当质量浓度大于5 mg/mL后,酶解原液、分子质量大于3 000 D组分和200~3 000 D组分的还原力达到最高水平,吸光度为2.74且无显著性差异(P>0.05),与VC的最高还原力(A700nm=2.86)无显著性差异(P>0.05)。由此可见,在相对较低的质量浓度范围内,超滤后分子质量在200~3 000 D组分的还原力最高。
表1 超滤分级前后各组分及VC由基的ICTable1 ICthe hydrolysate and its ultrafiltration fractions in comparison to VC for scavenging three kinds of free radicals

表1 超滤分级前后各组分及VC由基的ICTable1 ICthe hydrolysate and its ultrafiltration fractions in comparison to VC for scavenging three kinds of free radicals
注:*. 与酶解原液相比,差异显著(P<0.05);**. 与酶解原液相比,差异极显著(P<0.01)。下同。
不同组分VC酶解原液>3 000 D组分200~3 000 D组分对O2-・的IC50/(mg/mL)0.03**17.94 23.59*18.85对・OH的IC50/(mg/mL)0.23**4.04 5.10* 3.13*对DPPH自由基的IC50/(μg/mL)2.09**53.77 96.73**35.23**
由表1可知,酶解缫丝蚕蛹蛋白抗氧化肽超滤后,对O2-・清除活性,分子质量大于3 000 D缫丝蚕蛹蛋白抗氧化肽有显著性降低(P<0.05),200~3 000 D的组分变化无显著性差异(P>0.05),这与王璇[16]的研究结果基本一致;对・OH清除活性,分子质量大于3 000 D的组分有显著性降低(P<0.05),分子质量为200~3 000 D的组分缫丝蚕蛹蛋白抗氧化肽有显著性提高(P<0.05);对DPPH自由基清除活性,分子质量大于3 000 D的组分有极显著性降低(P<0.01),分子质量为200~3 000 D缫丝蚕蛹蛋白抗氧化肽有极显著性提高(P<0.01)。
对缫丝蚕蛹蛋白抗氧化肽超滤前后各组分对4种自由基的清除能力的测定结果表明,在一定质量浓度范围内,分子质量为200~3 000 D缫丝蚕蛹蛋白抗氧化肽的还原力、・OH、DPPH自由基的清除活力显著(P<0.05)高于酶解原液和分子质量>3 000 D的组分,但远弱于VC抗氧化性;IC50值越小,自由基清除能力越强,其清除自由基能力大小顺序为DPPH自由基>・OH>O2-・。且在研究的质量浓度范围内,随着质量浓度增大,其清除能力也增大,具有较好的量效关系。因此有必要对分子质量为200~3 000 D的组分进行稳定性评价。
2.2缫丝蚕蛹蛋白抗氧化肽(200~3 000 D)的稳定性评价
2.2.1胃肠道消化酶对抗氧化肽稳定性的影响
消化酶是参与消化的酶的总称,其作用是将大分子物质水解为小分子物质从而被人体吸收,同时也会使部分肽类物质结构发生改变,影响其生理活性。为了解分子质量为200~3 000 D缫丝蚕蛹蛋白抗氧化肽对抗消化酶的能力,通过体外模拟人体胃肠道消化系统测定其对DPPH自由基清除率变化来评价其对胃蛋白酶、胰蛋白酶的抵抗能力。

表2 200~3 000 D组分经胃肠道消化酶处理前后对DPPH自由基清除率比较Table2 Comparisons of DPPH radical scavenging activities of 200-3 000 D peptides after being digested by pepsin alone or in combination with trypsin
由表2可知,200~3 000 D的缫丝蚕蛹蛋白抗氧化肽组分经胃蛋白酶水解后,对DPPH自由基的清除率下降了2.58%,无显著性差异(P>0.05);经胃蛋白酶与胰蛋白酶处理后,对DPPH自由基的清除率增加了1.11%,也未有显著性差异。实验结果表明,分子质量200~3 000 D的缫丝蚕蛹蛋白抗氧化肽能够耐受肠道蛋白酶的作用,可能被人体直接吸收而参与人体的抗氧化过程。
2.2.2pH值对抗氧化肽稳定性的影响
将分子质量200~3 000 D的缫丝蚕蛹蛋白抗氧化肽组分溶于不同pH值的缓冲溶液中,研究它们在不 同pH值条件下5 h内对DPPH自由基清除率的变化。

图2 pH值对200~3 000 D组分的DPPH自由基清除率的影响Fig.2 Effect of pH on DPPH radical scavenging activity of 200-3 000 D peptides
由图2可知,pH<4时,分子质量200~3 000 D的缫丝蚕蛹蛋白抗氧化肽对DPPH自由基清除能力随pH值增加而增加,pH 4时达到最大(100 μg/mL清除率98.02%);之后随着pH值增大,对DPPH自由基清除能力逐渐减小,pH 8时,处理1 h,DPPH自由基清除率最低为(11. 80±0.45)%。时间对其DPPH自由基清除率影响不显著。结果表明,在pH 2~7环境下,分子质量200~3 000 D的缫丝蚕蛹蛋白抗氧化肽对DPPH自由基清除能力相对较高且稳定,而在碱性环境中,其对DPPH自由基清除能力降低。
2.2.3温度对抗氧化肽稳定性的影响
由图3可知,分子质量200~3 000 D的缫丝蚕蛹蛋白抗氧化肽在45 ℃条件下具有较高的DPPH自由基清除活性,清除率为86%左右;随着温度的升高,DPPH自由基清除活性降低,温度为75~85 ℃时,清除能力降到最低,清除率为80%左右;当温度高于85 ℃后,清除活性得以恢复,在95 ℃条件下处理1h,对DPPH 自由基清除率为87.11%(100 μg/mL),且加热时间对其清除率没有显著性影响。这说明,在一定范围内温度对分子质量200~3 000 D的缫丝蚕蛹蛋白肽对DPPH自由基清除率影响不明显,它们可以耐受加工过程较高温度的处理。
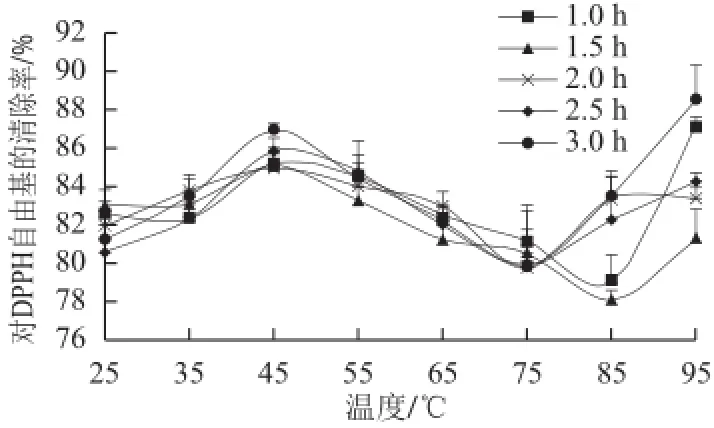
图3 温度对200~3 000 D组分DPPH自由基清除率的影响Fig.3 Effect of temperature on DPPH radical scavenging activity of 200-3 000 D peptides
2.2.4NaCl浓度对抗氧化肽稳定性的影响
由于食品加工过程经常用到NaCl,将分子质量200~3 000 D的缫丝蚕蛹蛋白肽分别溶于0.2、0.4、0.6、0.8、1.0、1.2 mol/L的NaCl溶液中,考察它们6 h内DPPH自由基清除率的变化,实验结果如图4所示。

图4 NaCl浓度对200~3 000 D组分DPPH自由基清除率的影响Fig.4 Effect of NaCl concentration on DPPH radical scavenging activity of 200-3 000 D peptides
由图4可知,不同浓度的NaCl对缫丝蚕蛹抗氧化肽对DPPH自由基清除率有较大影响。样品对DPPH自由基清除率呈现降-升-降的波动趋势。当NaCl为0、0.2、0.8 mol/L时,出现样品对DPPH自由基清除活性高峰;当NaCl浓度高于0.8 mol/L后,样品对DPPH自由基清除活性迅速降低,用1.0 mol/L的NaCl处理6 h,相比对照组,缫丝蚕蛹抗氧化肽对DPPH自由基清除率由51.58%下降到22.68%(60 μg/mL)。5 h和6 h处理时间对0.4、1.0 mol/L NaCl中样品DPPH自由基清除率有较大降低。由此可见,脱盐处理能较好保证分子质量200~3 000 D的缫丝蚕蛹蛋白肽的抗氧化性。
3 结 论
研究超滤分级后水解产物的还原力与清除自由基能力大小,分子质量200~3 000 D的抗氧化肽具有较好抗氧化活性,且大于酶解原液与分子质量大于3 000 D组分,其清除自由基能力由大到小为:DPPH自由基>・OH>O;在一定质量浓度范围内,其总还原力、O、・OH、DPPH自由基的清除能力随着其质量浓度增加而增加。
胃肠道消化酶 处理后对其DPPH自由基的清除率影响不明显,该抗氧化肽可能被人体胃肠道正常吸收而参与抗氧化过程;分子质量200~3 000 D的缫丝蚕蛹蛋白抗氧化肽的DPPH自由基清除能力在酸性环境下较高且稳定,而在碱性环境下较低;缫丝蚕蛹蛋白抗氧化肽耐热性较好,95 ℃加热3 h,DPPH自由基清除率仍保持80%以上;NaCl浓度对其DPPH自由基清除能力的影响趋势呈现波动性,NaCl浓度为0、0.2、0.8 mol/L时,缫丝蚕蛹蛋白抗氧化肽的DPPH自由基清除活性较高为53%左右(60 μg/mL)。
后续研究将对200~3 000 D的缫丝蚕蛹蛋白抗氧化肽采用柱层析法进一步分离纯化,对分离得到的新组分进行分子质量鉴定和抗氧化能力的深入研究。
参考文献:
[1] 王春霖, 郭芳, 王永利. 自由基与衰老[J]. 河北医科大学学报, 2005,26(4): 308-310.
[2] 刘时中. 自由基与衰老[J]. 生理科学进展, 1983, 14(2): 147-152.
[3] 王豪. 食源性抗氧化肽研究进展[J]. 天然产物研究与开发, 2012,24(11): 1680-1689.
[4] 何君, 李章宝, 唐汇清, 等. 湖南省桑树种质资源鉴定与育种研究概述[J]. 中国蚕业, 2012, 33(4): 8-11.
[5] 董烨平, 吴琼英. 蚕蛹蛋白开发与利用现状[J]. 农产品加工: 学刊,2010(6): 17-20.
[6] 吕汶骏, 赵钟兴, 廖丹葵, 等. 蚕蛹蛋白及其水解产物中氨基酸组成分析[J]. 食品科学, 2012, 33(12): 228-232.
[7] 王彦平, 刘洁, 吴予明, 等. 蚕蛹的营养成分分析[J]. 郑州大学学报:医学版, 2009, 44(3): 638-641.
[8] 闵建华, 李建科, 陈婷. 蚕蛹多肽的制备工艺及其体外抗氧化活性[J].食品科学, 2009, 30(14): 123-126.
[9] 赵钟兴, 廖丹葵, 孙建华, 等. 蚕蛹蛋白酶解产物体外抗氧化和降血压活性筛选及响应面工艺优化[J]. 食品科学, 2011, 32(23): 186-191.
[10] 李高扬, 崔堂兵, 陈亮. 蚕蛹蛋白酶解制备抗氧化肽的初步研究[J].现代食品科技, 2011, 27(7): 810-814.
[11] 张海祥, 魏兆军, 周乐春, 等. 响应曲面法优化动物蛋白酶水解脱脂蚕蛹蛋白的工艺[J]. 食品科学, 2009, 30(24): 188-192.
[12] OYAIZU M. Studies on products of the browning reaction. Antioxidative activities of browning reaction products prepared from glucosamine[J]. Japanese Journal of Nutrition, 1986, 44(6): 307-315.
[13] 王戈莎. 大米多肽的分离纯化及其抗氧化活性的研究[D]. 无锡: 江南大学, 2008.
[14] 周徐慧. 汉麻籽蛋白抗氧化肽的制备及其活性研究[D]. 无锡: 江南大学, 2008.
[15] 李锐达. 乳清抗氧化肽的制备及其生物活性研究[D]. 吉林: 东北林业大学, 2010.
[16] 王璇. 黑豆肽的制备及其抗氧化活性研究[D]. 郑州: 河南工业大学, 2012.
[17] 代衍峰. 抗氧化玉米肽的制备及其功能与结构关系的研究[D]. 无锡: 江南大学, 2008.
[18] 王宪泽. 生物化学实验技术原理和方法[M]. 北京: 中国农业出版社,2002: 108-109.
[19] 王伟. 可控酶解蚕蛹蛋白制备血管紧张素转换酶抑制肽及其构效关系的研究[D]. 杭州: 浙江大学, 2008.
[20] DUH P D. Antioxidant activity of burdock (Arctium lappa Linne): i ts scavenging effect on free-radical and active oxygen[J]. Jo urnal of the American Oil Chemists’ Society, 1998, 75(4): 455-461.
[21] CHANG H Y, HO Y L, SHEU M J, et al. Antioxidant and free radical scavenging activities of Phellinus merrillii extracts[J]. Botanical Studies, 2007, 48(4): 407-417.
[22] LI Y, JIANG B, ZHANG T, et al. Antioxidant and free radicalscavenging activities of chickpea protein hydrolysate (CPH)[J]. Food Chemistry, 2008, 106(2): 444-450.
[23] FERREIRA I C F R, BAPTISTA P, VILAS-BOAS M, et al. Freera dical scavenging capacity and reducing power of wild edible mushrooms from northeast Portugal: indiv idual cap and stipe activity[J]. Food Chemistry, 2007, 100(4): 1511-1516.
[24] KOU X, GAO J, XUE Z, et al. Purification and ident ification of antioxidant peptides from chickpea (Cicer arietinum L.) albumin hydrolysates[J]. LWT-Food Science and Technology, 2013, 50(2): 591-598.
[25] HALLIWELL B, GUTTERIDGE J M C. Role of free radicals and catalytic metal ions in human disease: an overview[J]. Methods in Enzymology, 1990, 186: 1-85.
[26] FARAGGI M, HOUEE-LEVIN C. Some aspects of the chemistry and biology of the superoxide radical anion[J]. Jou rnal de Chimie Physique et de Physico-Chimie Biologique, 1999, 96(1): 71-84.
[27] 许申鸿. 一种测定·OH产生与清除的新化学发光体系[J]. 分析 测试学报, 2000, 19(2): 11-13.
[28] JE J Y, QIAN Z J, BYUN H G, et al. Purificati on and characterization of an antioxidant peptide obtained from tuna backbone protein by enzymatic hydrolysis[J]. Process Biochemistry, 2007, 42(5): 8 40-846.
[29] ABRAHAM S, OUNDARARAJAN C C, VIVEKANANDHAN S, et al. Erythrocyte anti oxidant enzymes in Parkinson’s disease[J]. Indian Journal of Media Research, 200 5, 121(2): 111-115.
[30] REDON J, OLIVAMR, TORMOS C, et al. Antioxidant activities and oxidative s tress byproducts in human hypertension[J]. Hypertension,2003, 41(5): 1096-1101.
[31] SANCHEZ-MORENO C, DASHE J F, ICOTT T, et al. Decreased levels of plasma vitamin C and increased concentrations of inflammatory and oxidative stress markers after stroke[J]. Stroke,2004, 35(1): 163-168.
[32] JUN S Y, PARK P J, JUNG W K, et al. Purification and character ization of an antioxidative peptide from enzymatic hydrolysate of yellowfin sole (Limanda aspera) frame protein[J]. European Food Research and Technology, 2004, 219(1): 20-26.
Separation and Stability of Antioxidant Peptides from Silkworm Pupa Protein by Enzymatic Hydrolysis
DING Shunjie1, LUO Jinfeng1, DING Xiaowen1, HUANG Xianzhi2,*
(1. Key Laboratory of Agro-products Processing and Storage of Chongqing, College of Food Science, Southwest University,Chongqing 400715, China; 2. Insitute of Sericulture and Systems Biology, Southwest University, Chongqing 400715, China)
Objective: To study the separation and stability of antioxidant peptides produced by enzymatic hydrolysis of silkworm pupa protein with a commercial enzyme preparation. Methods: The antioxidant peptides derived from silkworm pupa protein were separated and purified by ultrafiltration. Their antioxidant activity was determined by colorimetry. Results: The antioxidant peptides with molecular weights of 200-3 000 D were obtained by ultrafiltration and their IC50for superoxide anion, hydroxyl, 1,1-diphenyl-2-picrylhydrazyl hydrate (DPPH) free radical were 18.85 mg/mL, 3.13 mg/mL,and 35.23 μg/mL, respectively. The DPPH free radical scavenging rate of the ant ioxidant peptides after treatment with both pepsin and trypsin for 4 h was increased from an initial level of 81.05% to 82.26%. The DPPH free radical scavenging rate of the antioxidant peptides at a concentration of 100 μg/mL was 98.02% and 11.80% after treatment at pH 4 and 8 for 1 h,and 87.11% after heat treatment at 95 ℃ for 1 h, respectively. The DPPH free radical scavenging rate at a concentration of 60 μg/mL was reduced from an initial level of 51.58% to 22.68% after 6 h of incubation in the presence of 1.0 mol/L NaCl. Conclusion: The 200-3 000 D antioxidant peptides generated by enzymatic hydrolysis of silkworm pupa protein were capable of effectively scavenging superoxide anion and DPPH free radical and had reducing power; their DPPH free radical scavenging activity in an acidic environment was higher than in an alkaline environment, and was effectively maintained by desalination but not significantly affected by digestive enzymes or temperature. Key words: enzymatic hydrolysis of silkworm pupa protein; antioxidant peptides; separation and purification; stability
TS218
A
1002-6630(2015)03-0035-06
10.7506/spkx1002-6630-201503007
2014-03-03
国家现代农业(蚕桑)产业技术体系建设专项(CARS-22-ZJ0503)
丁顺杰(1990—),男,硕士研究生,研究方向为食品工程。E-mail:dsjfreedom1990@163.com
黄先智(1965—),男,副研究员,博士,研究方向为蚕桑多元化利用。E-mail:popo1166@126.com

