结晶紫光谱探针法无标记检测Pb2+的DNA生物传感器
刘 萍, 陈凤英, 王香婷,于 燕, 熊泽东
(1.商洛学院化学工程与现代材料学院,陕西商洛 726000;2.陕西省尾矿资源综合利用重点实验室,陕西商洛 726000)
Pb2+对人体危害严重,它能在人体内累积而使人慢性中毒,会损伤肾和肝功能[1,2],并能导致血管受损和脑出血[3],甚至更严重地会改变基因表达,因此环境中Pb2+的检测是目前环境检测研究的热点之一。传统的Pb2+检测方法主要有紫外分光光度法、原子吸收法、原子荧光光谱法以及化学传感器[4 - 6]等。近年来,有关光学[7]和电化学传感器[8,9]方面的研究也有报道。其中荧光传感器以简单、灵敏等优点而广受关注。如利用Pb2+对RNA位点(8-17DNA酶中)的特异性识别,基于荧光共振能量转移标记荧光基团和猝灭基团的生物传感器[10 - 12]。此外,有报道将荧光基团和猝灭基团分别标记在凝血酶适配体(Thrombin Aptamer,TBA)的两端,基于Pb2+和Hg2+离子与适配体作用引起其构型改变,导致荧光共振能量转移现象发生,在同一体系分别检测Pb2+和Hg2+的传感器[13]。但是,目前报道的荧光适配体传感器很多需要在核酸适配体上标记荧光基团和(或)猝灭基团,实验操作比较复杂。因此,构建无需标记、简单、灵敏的生物传感器成为目前主要的研究任务。
本文利用Pb2+与TBA特异性结合形成G-四链体结构的特点,以结晶紫(CV)为指示剂构建了一种无需标记检测Pb2+的DNA生物传感器。CV自由分散在水溶液中,表现出弱的荧光,当CV与TBA作用后形成稳定的复合物(CV/TBA),荧光强度大大增强[14]。加入Pb2+后,TBA与Pb2+特异性结合形成G-四链体结构[15],CV从复合物中解离出来引起体系的荧光强度明显减小。据此,建立了一种无需标记检测 Pb2+的荧光光谱法。该传感器的建立为环境中重金属污染检测提供了一个较好的荧光分析方法。
1 实验部分
1.1 主要仪器及试剂
F-4600型荧光分光光度计(日本,日立高新技术那珂事业所);pHS-3B型pH计(上海精密科学仪器有限公司);T-214型电子天平(北京丹佛仪器有限公司);TG16离心机(湖南英泰仪器有限公司)。
TBA:5′-GGTTGGGCGTGGGTG-3′、 R-DNA:5′-ATGTACCGATCACTA-3′(上海生工生物技术有限公司合成),均用pH=7.0的10 mmol/L Tris-HAc缓冲溶液配制成100 μmol/L储备液;结晶紫(CV,天津纵横兴工贸);无水乙醇、冰乙酸、乙酸铅等试剂均为分析纯。实验用水均为超纯水。
1.2 实验方法
取10 μmol/L CV溶液于微量比色皿中,用荧光分光光度计检测其荧光光谱。保持CV的浓度不变,加入5 μmol/L TBA,混合均匀后放置25 min,再检测其荧光光谱,然后加入Pb2+,混合均匀,培育20 min,再进行荧光检测,观察荧光强度的变化。每次扫描均重复三次。荧光激发波长为570 nm,发射波长扫描范围为600~700 nm,激发狭缝10 nm,发射狭缝20 nm,光电倍增管电压900 V。
2 结果与讨论
2.1 荧光光谱特性
Pb2+能特异性结合TBA进而诱导其形成G-四链体,使得溶液中CV 荧光信号降低。实验测定了CV及其中依次加入TBA和Pb2+前后的荧光光谱,结果如图1所示。图中曲线a为CV的荧光光谱,曲线b为加入TBA后结晶紫的荧光光谱,曲线c为加入30 nmol/L Pb2+以后体系的荧光光谱。结果显示,CV本身荧光信号较低,与TBA混合后CV的荧光信号显著增加,加入Pb2+后,体系的荧光信变弱。
为了检验CV荧光信号的降低是否由于Pb2+的加入引起,实验考察了不同浓度Pb2+对CV的荧光信号的影响。结果CV的荧光发射光谱几乎没有变化。而在TBA/CV体系里加入Pb2+,荧光信号有明显的减弱,原因可能是TBA与Pb2+特异性结合形成G-四链体结构,CV从复合物中解离出来导致体系的荧光强度减小。
2.2 实验条件的优化
2.2.1DNA链的优化选择了任意序列的DNA链,考察DNA序列对检测体系的影响。将TBA换成R-DNA,加入不同浓度Pb2+后检测体系的荧光强度,结果如图2所示。 CV/R-DNA体系中加入不同浓度的Pb2+以后,几乎没有引起荧光信号的改变,而在CV/TBA体系中加入Pb2+,体系的荧光信号明显减弱。原因可能是Pb2+特异性结合TBA形成了G-四链体结构,释放出了与单链TBA结合的CV,引起荧光信号减弱。所以选择TBA做分子识别探针。
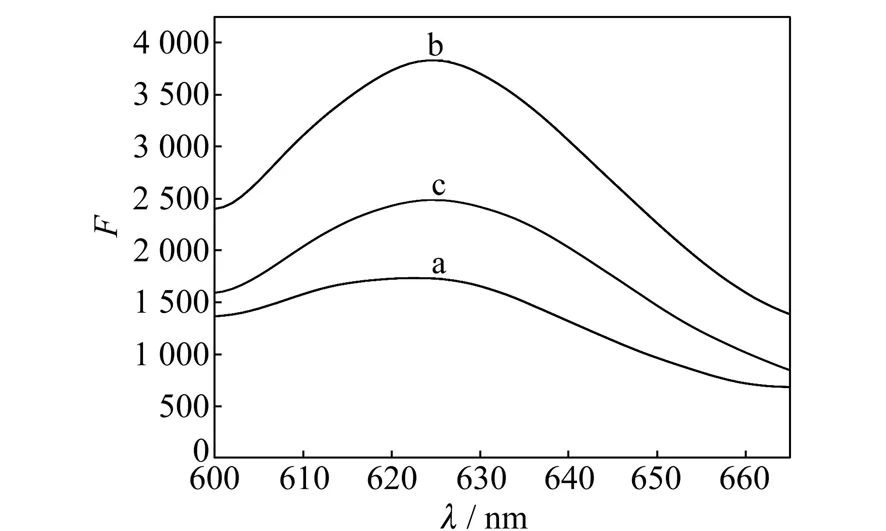
图1 10 mmol/L Tris-HAc缓冲液(pH=7.0)中CV/TBA与Pb2+的荧光光谱图Fig.1 Fluorescence spectra of CV/TBA and Pb2+ in 10 mmol/L Tris-HAc buffer solution(pH=7.0) (a) 10 μmol/L CV;(b) a +5 μmol/L TBA;(c) b+30 nmol/L Pb2+.
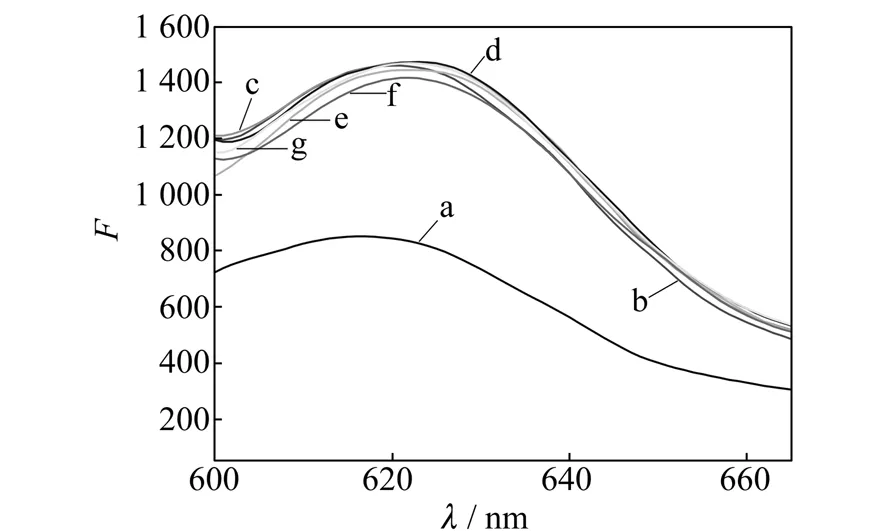
图2 10 mmol/L Tris-HAc缓冲液(pH=7.0)中CV/R-DNA与不同浓度Pb2+的荧光光谱图Fig.2 Fluorescence spectra of CV/R-DNA and Pb2+ with different concentration in 10 mmol/L Tris-HAc buffer solution(pH=7.0) (a)10 μmol/L CV;(b) a +5 μmol/L R-DNA;(c-f )b+5,10,20,30,50 nmol/L Pb2+.
2.2.2TBA与CV浓度比例的选择CV与TBA的浓度不同背景信号也不一样,会影响体系检测Pb2+的检测灵敏度。实验研究了不同浓度比的CV/TBA体系加入Pb2+后体系荧光强度的变化。结果显示二者浓度比为1∶2时,荧光强度变化值最大。
2.2.3稳定时间的选择考察了CV/TBA体系与Pb2+充分作用的稳定时间。结果表明在反应初期,随着时间的增加,体系荧光强度变化逐渐增加,待20 min后趋于稳定,后续实验均选择混合20 min后进行测定。
2.3 Pb2+的检测范围和灵敏度
向CV/TBA体系中加入Pb2+前后,体系的荧光强度会发生改变,通过荧光强度改变的量实现对Pb2+的定量检测。如图3所示,CV/TBA体系的荧光强度随Pb2+浓度的增大而降低,当加入50 nmol/L Pb2+后荧光强度的变化趋于稳定。体系荧光强度的变化值((F0-F)/F0)(Y)与Pb2+浓度(X)在5~50 nmol/L范围内成良好的线性关系。线性方程为:Y=0.01204X+0.03177,线性相关系数r=0.9984。该方法的线性范围较宽,检测限(S/N=3)为2.0×10-9mol/L,满足环境水样中铅污染的监测。
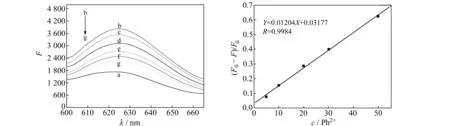
图3 CV/TBA体系与不同浓度Pb2+作用的荧光光谱图(左)和Pb2+的校准曲线(右)Fig.3 Fluorescence spectra of TBA/CV in the presentce of Pb2+ with different concentration(left) and the calibration plots for Pb2+ measurements(right) in 10 mmol/L Tris-acetate buffer(pH=7.0) (a)10 μmol/L CV;(b) a +5 μmol/L TBA;(c-f )b+5,10,20,30,50 nmol/L Pb2+.
2.4 共存离子的干扰实验
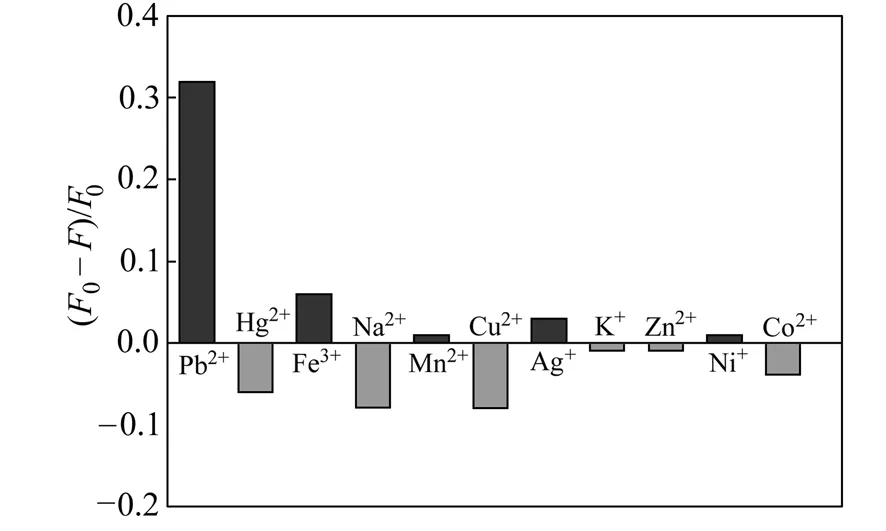
图4 CV/TBA体系对不同金属离子的响应Fig.4 Effect of different metal ions on the CV/TBA system
考察了当溶液中不存在Pb2+时,CV/TBA体系中500 nmol/L的Na+、Zn2+、Ni+、Co2+、Cu2+、K+和 50 nmol/L 的Pb2+、Fe3+、Hg2+、Mn2+、Ag+的影响。 如图4所示,其它金属离子对CV/TBA检测体系荧光强度影响不大。表明本方法对Pb2+具有良好的选择性。
2.5 水样中Pb2+的测定
为考察本方法的可行性,用设计的传感器检测了商洛市自来水样中的Pb2+。打开水管放水20 min后取样,煮沸5 min去除氯,按文献方法[16],通过标准加入法对样品中Pb2+进行检测,所得结果见表1。本地方自来水中未检出Pb2+。

表1 实际样品中的Pb2+分析结果(n=5)
3 结论
本文以TBA作为检测探针,CV作为荧光信号分子,利用TBA与Pb2+的特异性结合,构建了一种无需标记型检测Pb2+的荧光DNA生物传感器。该方法具有简单、快速、选择性好,无需标记,在均相溶液中检测等优点。

