基于磁性Fe3O4/Au-Pt纳米复合物构建甲胎蛋白免疫传感器的研究
朱宇萍, 周渝玲
(内江师范学院化学化工学院,四川内江 641000)
磁性纳米Fe3O4颗粒中含有交替排列的Fe2+和Fe3+,在电场作用下Fe2+很容易变为Fe3+,能够与蛋白质中的活性基团,如-COOH、-OH、-NH2等相互作用,并且不破坏其生物活性[1,2]。它被广泛应用在免疫传感器制备中。纳米金(nano-Au)、纳米铂(nano-Pt)除具有纳米材料普遍具有的大比表面积、高活性、稳定等通性外,还具有良好的生物相容性、良好的电子传递性能等特征。其优良的光学、电学性质,使得纳米金、纳米铂在生物分子的分析检测方面越来越受到人们的关注,成为分析化学的研究热点之一[3]。
本实验合成了纳米Au-Pt、纳米Fe3O4。以纳米Fe3O4为内核,通过萘酚(Nafion)中的磺酸根联接硫堇(Thionine,Thi)。Thi结构中含电活性基团,表现出优良的电化学特性,特别是在适当的酸性环境中有良好的电化学活性及可逆性[4]。利用Thi中巯基与纳米Au-Pt中Au形成Au-S键,从而制备Fe3O4/Au-Pt纳米复合物。将该复合物修饰在玻碳电极表面,构建了一种新型免疫传感器。
1 实验部分
1.1 仪器与试剂
CHI660C电化学工作站(上海辰华仪器公司);BRANSONIC200超声清洗仪(美国,BRANSON公司);pH计(奥豪斯仪器(上海)有限公司);FA2004A电子天平(上海精天电子仪器有限公司);微量取样器。
无水乙醇、HAc、NaAc、甲胎蛋白诊断试剂盒(郑州博赛生物技术股份有限公司),5% Nafion(美国Sigma公司),牛血清蛋白(BSA,上海博奥生物科技有限公司),FeCl2、柠檬酸三钠、硫堇(Thi,英国BIOFER公司),H2PtCl6(上海精细化工研究所)。试剂均为分析纯。实验用水为去离子水。
1.2 免疫传感器的制备
1.2.1磁性纳米Fe3O4的制备采用共沉淀法制备磁性纳米Fe3O4[5]。精确移取5 mL 0.1 mol/L Fe2+溶液于烧杯中与10 mL 0.1 mol/L Fe3+溶液充分混匀。将此混合溶液置于80 ℃水浴中,不断搅拌下将50 mL 2 mol/L NaOH溶液滴加其中,在此条件下反应30 min。放置冷却至室温。吸去上层清液,用去离子水多次洗涤,直至呈中性,即得纳米Fe3O4。
1.2.2纳米Au-Pt的制备将0.5 mL 1% HAuCl4滴加到50 mL水中,搅拌并加热至沸后,将0.8 mL 1%柠檬酸钠迅速加入其中,搅拌至酒红色,即制得纳米金溶液[6]。依次将0.5 mL 0.2 mol/L抗坏血酸和1.3 mL 1% H2PtCl6缓慢加入上述溶液中,继续加热搅拌20 min[7],即制得纳米Au-Pt混合溶液。
1.2.3Fe3O4/Au-Pt纳米复合物的制备向1 mL纳米Fe3O4中加入50 μL Nafion溶液,超声震荡20 min后,将0.5 mL Thi加入其中,继续超声20 min。再向上述溶液中加入1 mL制得的纳米Au-Pt,超声震荡15 min,静置,即得纳米Fe3O4/Au-Pt复合物,见图1。所得复合物密封置于4 ℃的冰箱中,备用。
1.2.4免疫传感器的制备将玻碳电极(GCE,Φ=4 mm)表面依次在0.3、0.05 μm的Al2O3糊中抛光成镜面,然后分别用去离子水、无水乙醇、去离子水各超声清洗5 min,于室温下晾干。用微量取样器移取Fe3O4/Au-Pt纳米复合物10 μL修饰于GCE表面,室温晾干。最后将修饰电极在4 ℃下置于anti-AFP溶液中浸泡16 h,并将电极置于0.25%的BSA溶液中浸泡30 min,以封闭电极上的非特异性吸附位点[8]。修饰好的电极置于4 ℃的冰箱中存放,备用。免疫传感器的制备过程见图2。
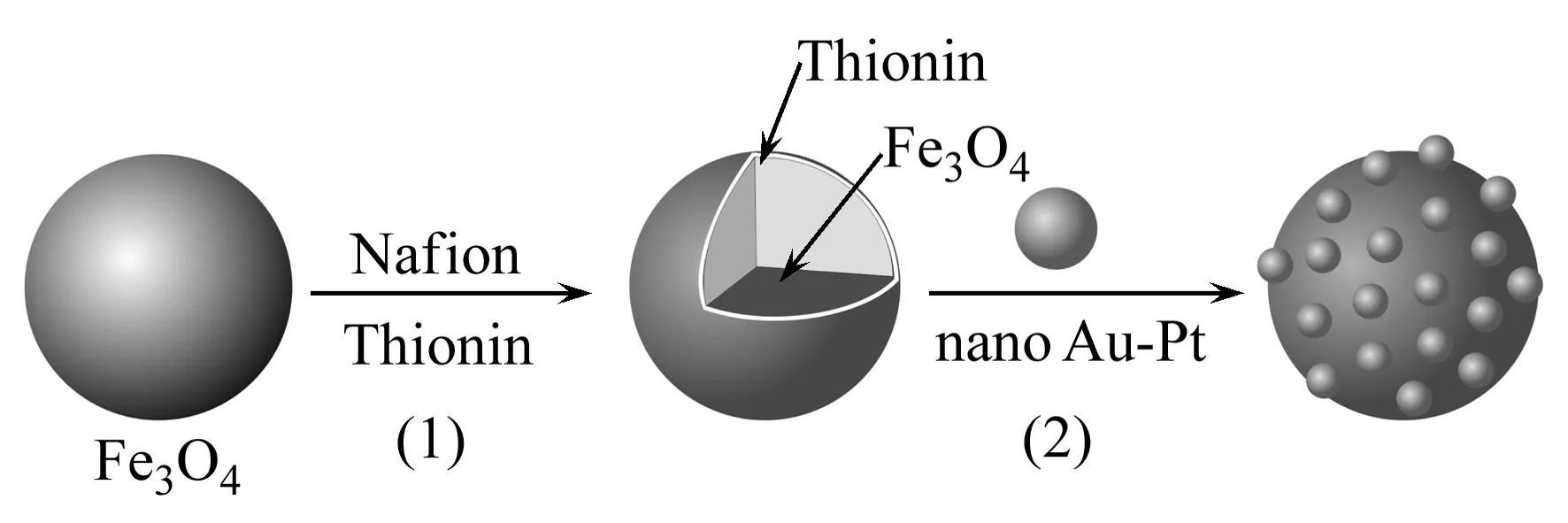
图1 Fe3O4/Au-Pt纳米复合物制备过程示意图Fig.1 Schematic illustration of preparation process of Fe3O4/Au-Pt nano complexes
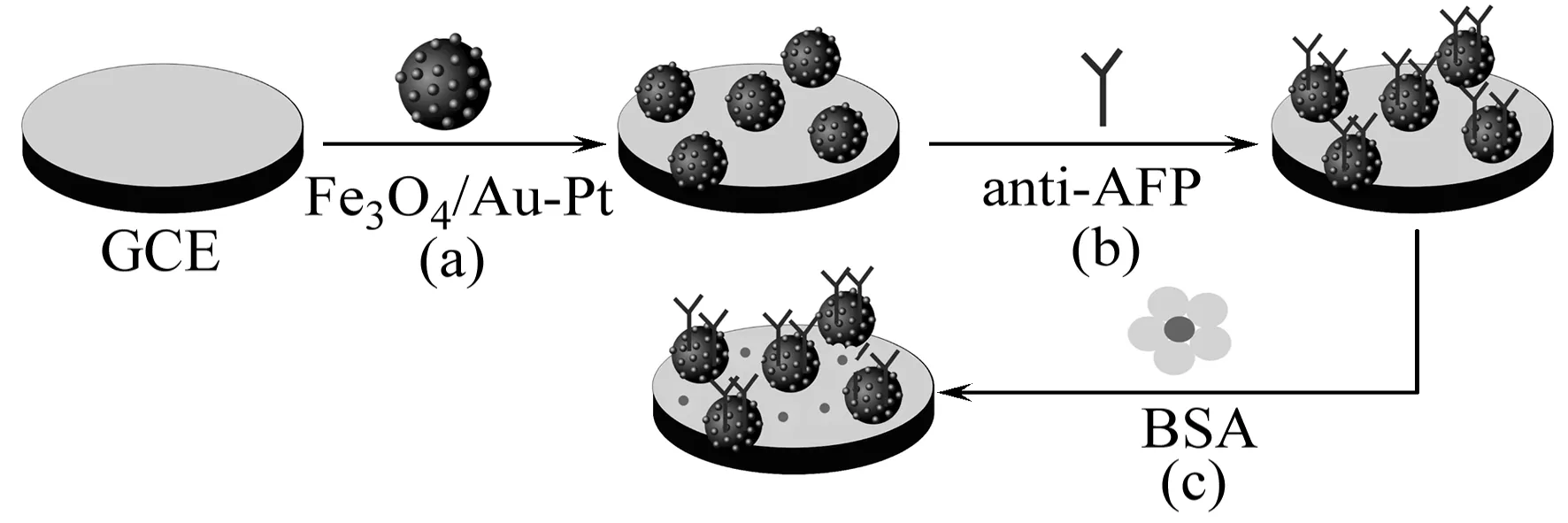
图2 免疫传感器的制备过程示意图Fig.2 Schematic illustration of the stepwise immunosensor fabrication process
1.3 实验方法
实验采取三电极体系:修饰GCE为工作电极,Ag/AgCl(饱和KCl)电极为参比电极,铂电极为对电极。采用循环伏安法(CV)对免疫传感器的制备过程及优化过程进行表征。以0.1 mol/L HAc-NaAc缓冲溶液作为测试底液。电位范围为-0.6~0.2 V,扫描速度为50 mV/s。
2 结果与讨论
2.1 电极在不同修饰过程中的电化学表征
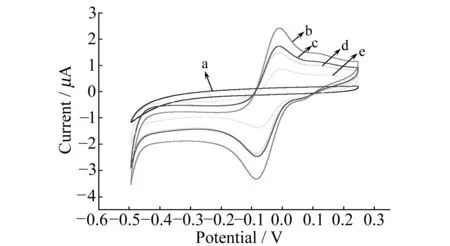
图3 电极修饰过程中的不同电极循环伏安图Fig.3 Cyclic voltammograms of different electrodes showing the modification process in 5 mL 0.1 mol/L HAc-NaAc(pH=5.5);scan rate:50 mV/s;potentials in the range of -0.6-0.2 V. a:GCE;b:GCE/(Fe3O4/Au-Pt);c:GCE/(Fe3O4/Au-Pt)/anti-AFP;d:GCE/(Fe3O4/Au-Pt)/anti-AFP/BSA;e:GCE/(Fe3O4/Au-Pt)/anti-AFP/BSA/AFP(10 ng/mL).
用CV法表征了电极在修饰过程中的电化学特性,见图3。将裸GCE置于HAc-NaAc缓冲溶液中,由于此时体系中无电子媒介体,因而无氧化还原峰(图3曲线a)。当纳米复合物Fe3O4/Au-Pt被修饰到GCE表面,因复合物中Thi有良好的导电性能[9],在图中可到见一对可逆的氧化还原峰(图3曲线b)。Fe3O4/Au-Pt纳米复合物中含有丰富的-NH2可与anti-AFP结合,使得氧化峰的电流值明显降低(图3曲线c)。这是由于抗体蛋白质被吸附在电极表面,从而阻碍了电子的传输[10]。用BSA封闭电极表面的非特异性吸附位点后(图3曲线d),可明显看到氧化峰电流值进一步减小。最后,将修饰电极置于10 ng/mL的AFP中孵育一定时间,生成的免疫复合物继续覆盖电极表面,阻碍电子传递,氧化峰电流值继续降低[11],见图3曲线e。说明纳米复合物成功修饰于电极表面。
将电极置于HAc-NaAc缓冲溶液(pH=5.5)中,于扫速分别为50、100、150、200、250、300、350、400、500、600 mV/s条件下进行CV扫描。实验表明,氧化峰峰电流值随扫速的增加而升高。其峰电流值与扫速的平方根呈线性关系,说明电极氧化还原受扩散过程控制[12]。
2.2 实验条件的优化
2.2.1缓冲溶液pH值的选择当pH值达到或接近蛋白质的等电点时,会导致抗原抗体发生非特异性沉淀。pH值过小则会导致抗原-抗体结合物解离[13]。在扫速为50 mV/s条件下,分别考察了pH值为4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5的缓冲溶液,结果显示免疫传感器在缓冲溶液pH值为5.5时,具有最大的响应电流值,故选择缓冲溶液pH值为5.5。
2.2.2孵育时间的优化实验中将同一支修饰电极置于10 ng/mL的AFP溶液中分别孵育1、2、5、8、10、15、18、20 min后,用CV法扫描。在孵育时间为18 min时,氧化峰电流有最大响应值,之后峰电流值逐渐减缓,说明孵育已达饱和[14]。所以,选择18 min为孵育的最佳时间。
2.2.3孵育温度的优化较低温度时,蛋白质分子活性低,抗原与抗体间的特异性反应耗时长;温度过高,则可导致抗体抗原失活。所以,控制适当温度可保证蛋白质分子活性高且反应速度较快,减少耗时[15]。将修饰电极在10 ng/mL的APF溶液中,先后置于15、20、25、30、35、37、40 ℃条件下孵育。当孵育温度为37 ℃时电极响应电流达到最大值,温度高于37 ℃后,氧化峰电流值趋于平缓,故孵育温度确定为37 ℃。
2.3 免疫传感器的响应特性
2.3.1免疫传感器在不同AFP浓度下的标准曲线在优化实验条件下,不同浓度AFP(0.05、0.1、0.5、1.0、5.0、10、20、50、80、100 ng/mL)的CV曲线见图4。随着AFP浓度增加,抗体抗原特异性反应所得的复合物覆盖电极表面的面积越大,电极的氧化峰电流响应值越低[16]。实验表明免疫传感器在AFP浓度为0.05~1.0 ng/mL与1.0~100 ng/mL两个范围内与峰电流值呈现良好的线性关系。在0.05~1.0 ng/mL范围内,线性回归方程为:i=0.97322-0.11735c;在1.0~100 ng/mL范围内,线性回归方程为:i=0.89015-0.00552c,见图5。该传感器的检出限为0.01 ng/mL。
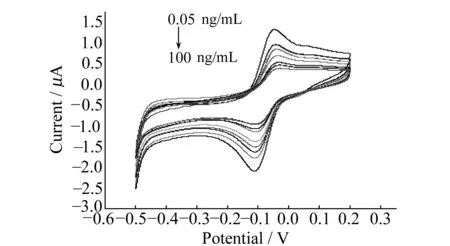
图4 免疫传感器在不同浓度AFP下的循环伏安图Fig.4 Cyclic voltammograms of immune sensor in different concentration of AFP antigen in 5 mL 0.1 mol/L HAc-NaAc(pH=5.5);scan rate:50 mV/s;potentials in the range of -0.6-0.2 V.
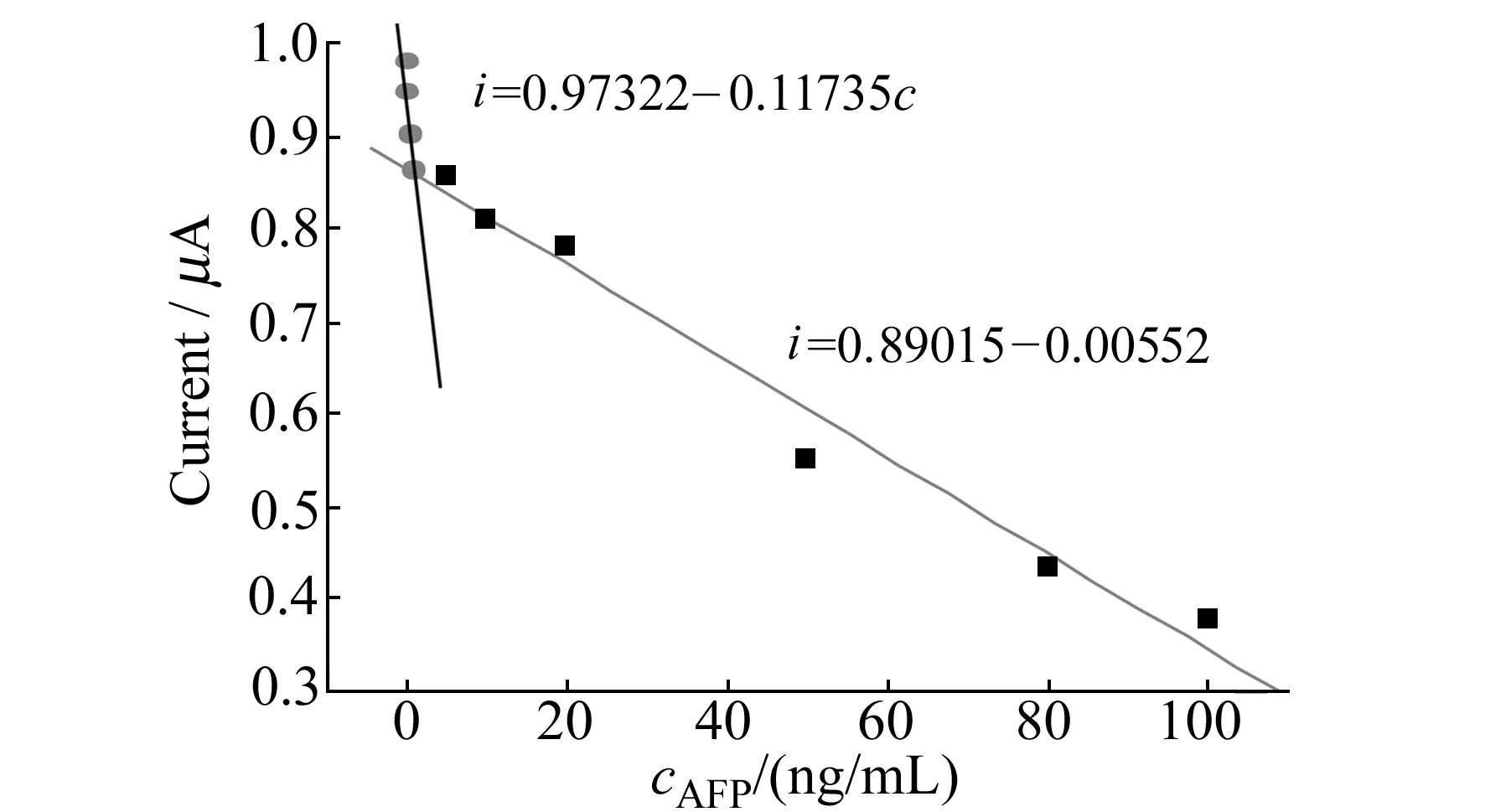
图5 不同AFP浓度与峰电流的线性关系Fig.5 The linear relationship between AFP concentration and peak currentin 5 mL 0.1 mol/L HAc-NaAc(pH=5.5);scan rate:50 mV/s;potentials in the range of -0.6-0.2 V.
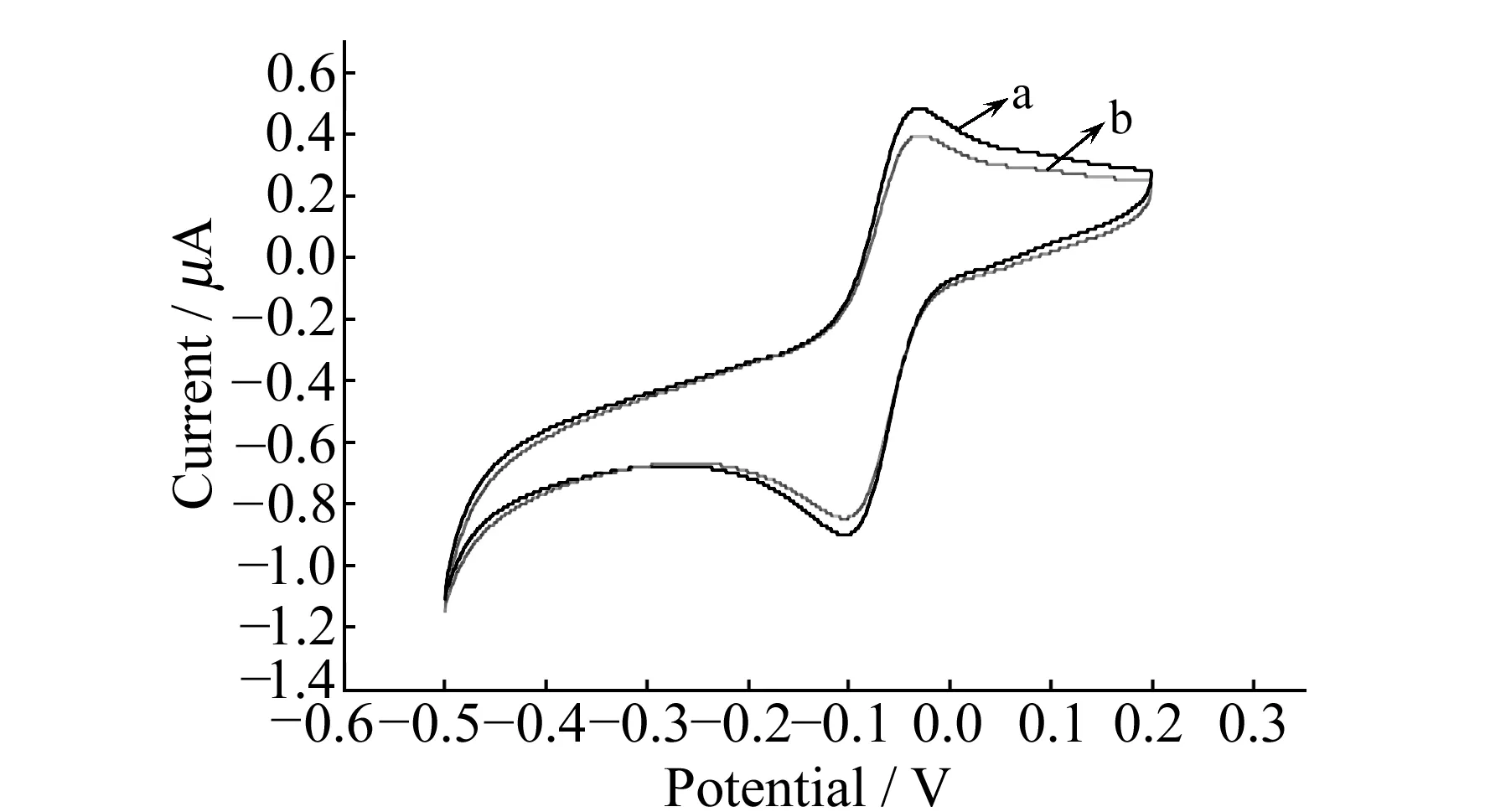
图6 免疫传感器的选择性Fig.6 The interference factors cyclic voltammograms of AFP standard sohition(a) and interferent species(b).
2.3.2免疫传感器的选择性将同一支免疫传感器先后置于10 ng/mL AFP抗原标准溶液(图6曲线a)和含有10 ng/mL AFP抗原模拟人体体液环境溶液中(图6曲线b),用CV法扫描。此次实验用于模拟人体体液环境的干扰物质有:牛血清蛋白、癌胚抗原、抗坏血酸、甘氨酸、半胱氨酸(每种干扰物浓度均为10 ng/mL)。由图可知,两次测量的响应电流无显著变化,表明这些物质的存在不会影响传感器的选择性。
2.3.3免疫传感器的稳定性和重现性将同一支免疫传感器通过连续100圈CV扫描,第1圈和第100圈的氧化峰电流之差仅为0.103 μA,说明该免疫传感器具有优异的稳定性。免疫传感器不使用时,悬置于缓冲液上方(4 ℃)。每隔6 d对同一支免疫传感器在相同条件下进行测试,经过21 d后,电极的响应电流开始略有下降,为初始值的94.7%。
3 结论
利用磁性Fe3O4/Au-Pt纳米复合物研制成一种新的电流型AFP免疫传感器。该免疫传感器制作简单,灵敏度高,稳定性好,重复性优良,响应时间快,线性范围较宽,也可适用于其他免疫物质的测定。

