妊娠期尼古丁暴露对子鼠脏器发育的影响
李园园,张 舫
(沈阳军区总医院 妇产科,辽宁 沈阳 110015)
论 著
妊娠期尼古丁暴露对子鼠脏器发育的影响
李园园,张 舫
(沈阳军区总医院 妇产科,辽宁 沈阳 110015)
目的 探讨妊娠期尼古丁暴露对小鼠子代脏器发育的影响。方法 昆明孕小鼠24只,随机分为对照组和1、2、4mg/kg尼古丁暴露组,各组小鼠自孕7 d至分娩,分别多点皮下注射1 mL生理盐水或尼古丁生理盐水溶液(尼古丁含量分别为1、2、4mg/kg),1次/d。子鼠哺乳喂养,21 d断乳。检测子鼠出生3、7、14、21、35d时的体重及子鼠5周龄时的脑、肝、心、脾、肾脏器系数及组织形态。结果 各尼古丁暴露组子鼠初始出生时体重均低于对照组(P<0.05),出生35d时,各组子鼠体重随尼古丁暴露剂量增高而降低(P<0.05);5周龄时,子鼠心肌纤维萎缩,心肌纤维间隙增大;肝细胞水肿;脾脏特征性结构边界不清,白髓面积变小,红髓面积增大等;大脑海马和肾组织未见明显异常。尼古丁暴露剂量达到2 mg/kg时,子鼠心脏和脾脏的脏器系数均显著上降(P<0.05)。结论 妊娠期尼古丁暴露导致子鼠多器官组织形态异常,这可能是尼古丁致生后远期慢性疾病发生的解剖学基础和发育源性病因。
妊娠期;尼古丁;子代;脏器发育;组织形态
尼古丁(nicotine),又称烟碱,是烟草中的主要毒性成分。流行病学调查显示,中国有烟民3.5亿人,被动吸烟人数高达7.7亿人,其中有20%~50%的妇女在妊娠期吸烟,而50%不吸烟的孕妇也存在被动吸烟[1]。尼古丁极易通过胎盘屏障,并在胎儿体内蓄积,从而影响胎儿的生长发育。而生命早期(胚胎期和生后早期)暴露于有害因素环境中可能影响发育编程,从而被机体“记忆”下来,对远期发育和成年期健康造成负面影响[2]。调查研究显示,母亲吸烟和产前尼古丁暴露可导致子代持续性新陈代谢系统与多组织器官异常,与子代生后远期多种慢性疾病发病可能存在因果关系[3-4]。然而,有关妊娠期尼古丁暴露对子代器官发育形态学影响的研究报道较少。本研究建立妊娠期尼古丁暴露小鼠模型,观察子鼠生长发育情况,检测子鼠(生后5周)重要脏器心、肝、脾、脑、肾的形态,为深入研究妊娠期尼古丁暴露对远期健康和疾病的影响提供依据。
1 材料和方法
1.1 主要试剂和仪器
尼古丁(纯度99%)购于北京伊普瑞斯科技有限公司。动物体重秤(精确度0.1 g)、电子天平(北京赛多利斯),倒置相差荧光显微镜(Olympus公司),数码显微镜照相系统、MiE3.1图像处理软件(山东易创电子有限公司)。
1.2 实验动物和分组染毒
10周龄昆明小鼠,雌鼠24只,雄鼠12只,30~35g,由大连医科大学动物中心提供[许可证号:SCXK(辽)2008-0002,20130715]。饲养环境温度20~25℃、湿度50%~60%、自然节律采光,普通饮食,自由进食和饮水。小鼠适应性饲养2 d后,雌鼠与雄鼠2∶1合笼,12 h后进行阴栓观察或阴道涂片,观察到阴栓或精子视为怀孕,并记录为孕期第0天。
将孕鼠随机分为4组,每组6只,分别为对照组和1、2、4mg/kg尼古丁暴露组。各组小鼠自孕7 d至分娩,分别皮下注射1 mL生理盐水或尼古丁生理盐水溶液(尼古丁含量分别为1、2、4mg/kg),1次/d。各组孕鼠自然分娩,子鼠出生后21 d断乳,自由进食水。
1.3 妊娠结局观察
各组孕鼠分娩时,记录各孕鼠产仔数、子鼠死胎数及畸形胎数。
1.4 子鼠体重检测
子鼠出生3、7、14、21、35d分别称量体重,测量3次取平均值为当天体重。
1.5 子鼠脏器系数检测
子鼠5周龄时,每组随机取子鼠6只,雌雄各半,脱颈处死,处死后立即分离脑、肝、心、脾、肾组织,生理盐水冲洗,滤纸拭干,称重,按公式[脏器系数=(脏器重量/体重)×100%]计算脏器系数。
1.6 子鼠脏器发育形态学检测
子鼠5周龄时,每组随机取子鼠6只,雌雄各半,全身灌流,留取脑、心、肝、脾、肾等器官,4%多聚甲醛液固定。蜡块包埋,HE染色。显微镜下观察、拍照。
1.7 统计学方法
2 结 果
2.1 妊娠期尼古丁暴露对妊娠结局的影响
对照组孕鼠产子鼠56只,1、2、4mg/kg尼古丁暴露组孕鼠分别产子鼠51、61、56只,各孕鼠产仔数均在8~13只之间,各组孕鼠产仔数间差异无显著性意义(P>0.05)。对照组和各剂量尼古丁暴露组孕鼠产子鼠均无死胎,无畸形。
2.2 妊娠期尼古丁暴露对子鼠体重的影响
如表1所示,与对照组相比,各组子鼠7日龄前体重低于对照组,差异有显著性意义(P<0.05)。随着子鼠的成长发育,1 mg/kg尼古丁孕鼠暴露对子鼠体重的影响逐渐降低,出现“生长追赶”现象,子鼠出生7 d后,1 mg/kg尼古丁暴露组与对照组子鼠体重差异无显著性意义(P>0.05);2 mg/kg和4mg/kg尼古丁暴露组子鼠在出生35d内,各时段体重均低于对照组,差异有显著性意义(P<0.05)。而且出生21 d后,随着尼古丁暴露剂量的增加,各组子鼠体重逐渐下降。
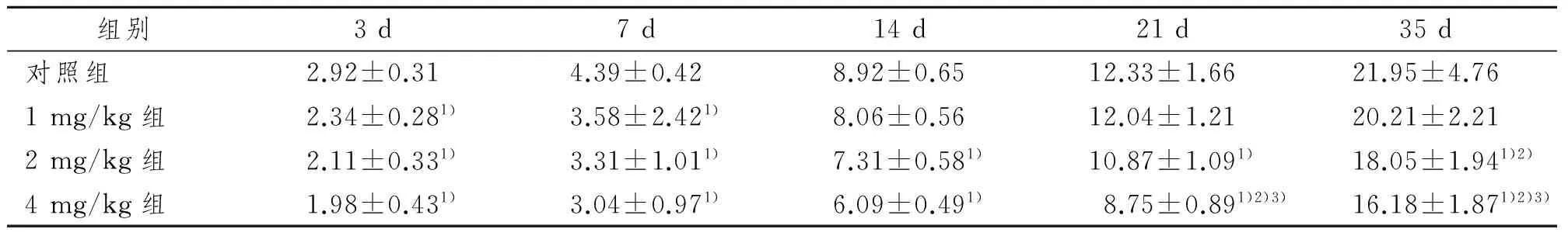
表1 妊娠期尼古丁暴露对子鼠体重的影响
2.3 妊娠期尼古丁暴露对子鼠脏器系数的影响
如表2所示,与对照组相比,妊娠期尼古丁暴露对子鼠肝脏、脑和肾脏脏器系数的影响均无显著性意义(P>0.05);尼古丁暴露剂量达到2 mg/kg时,子鼠心脏和脾脏的脏器系数均显著下降,差异有显著性意义(P<0.05),而且随着尼古丁暴露剂量的增加,子鼠心脏和脾脏的脏器系数逐渐下降。

表2 妊娠期尼古丁暴露对子鼠脏器系数的影响
2.4 妊娠期尼古丁暴露对子鼠脏器形态的影响
显微镜下可见,尼古丁暴露组子鼠心肌纤维横截面积较对照组缩小,心肌纤维出现萎缩,心肌纤维间隙增大,异常程度随尼古丁剂量增加而逐渐加重。见图1。
对照组子鼠脾脏白髓近圆形,分散,呈灰白点状,均匀致密蓝染,边缘区界线清楚,红髓位于白髓与边缘区之外,面积小,着色浅,呈条索状,内含大量红细胞(图2A和a)。尼古丁暴露组子鼠白髓面积减少,形态不规则,染色不均匀,边缘区界线不清,红髓面积增大,部分区域连接呈大片状,异常程度随尼古丁剂量增加逐渐加重(图2 B~D和b~d)。
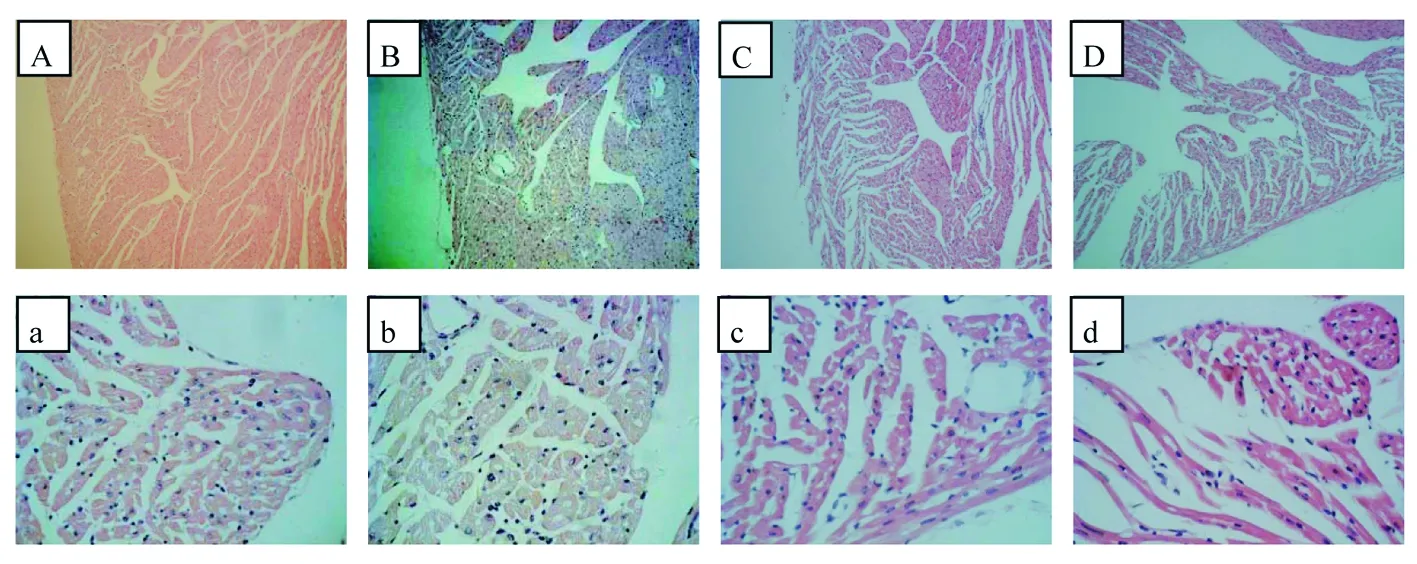
图1 妊娠期尼古丁暴露对子鼠心脏组织形态影响
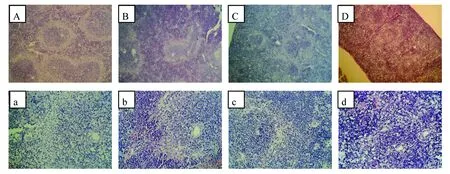
图2 妊娠期尼古丁暴露对子鼠脾脏组织形态影响
对照组子鼠肝板结构清晰,肝细胞排列致密,胞质均匀(图3A和a);尼古丁暴露组子鼠肝板结构不清,肝细胞出现轻度水肿,胞间见散在亮白区域,异常程度随尼古丁剂量增加逐渐加重(图3B~D和b~d)。
对照组子鼠大脑海马各区神经元排列整齐,细胞分层清晰,CA1区椎体细胞明显分化;尼古丁暴露组子鼠大脑海马结构与对照组无明显区别,未见病理改变。见图4。
对照组子鼠肾脏皮质、髓质结构清晰、完整,近曲小管、远曲小管以及肾小球形态正常(图5A和a);各尼古丁暴露组子鼠肾脏未见水肿、萎缩、炎细胞浸润等,与对照组比较无明显改变(图5B~D和b~d)。
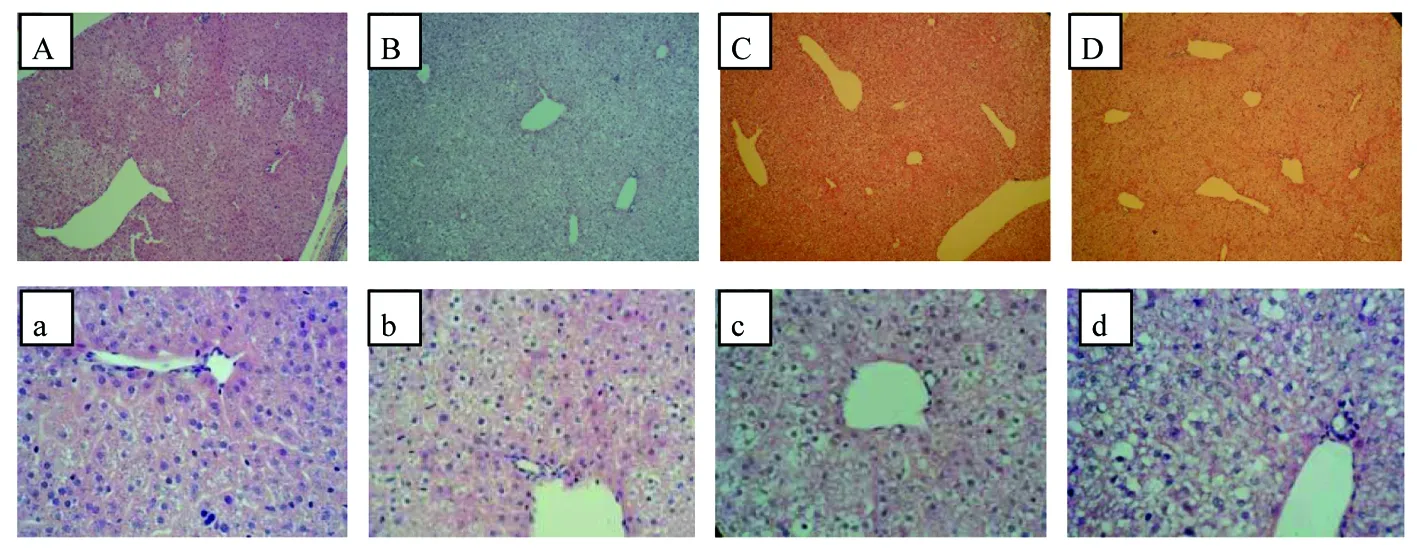
图3 妊娠期尼古丁暴露对子鼠肝脏组织形态影响

图4 妊娠期尼古丁暴露对子鼠大脑海马形态的影响
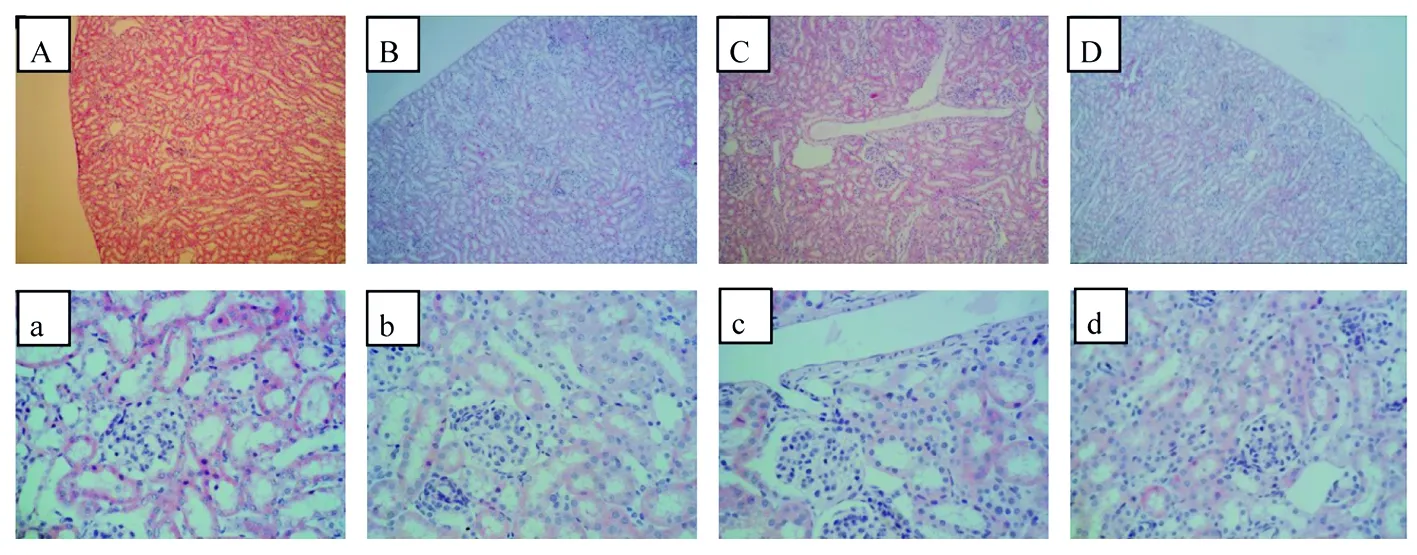
图5 妊娠期尼古丁暴露对子鼠肾脏组织形态影响
3 讨 论
生命早期(胚胎期和生后早期)是哺乳动物发育的关键时期,细胞处在快速生长和分化阶段,此期间的个体比生命中的任何时期都更易受到有害因素的影响,从而干扰多器官组织结构形成、功能建立,对远期健康造成负面影响[5]。流行病学和动物实验均证实,生命早期尼古丁暴露具有发育毒性,但有关生命早期尼古丁暴露对器官形成影响的研究鲜见报道。本研究对妊娠期小鼠进行不同剂量的尼古丁暴露,结果显示,实验组子鼠全部存活,没有死胎、畸形胎发生,提示实验剂量尼古丁尚不能影响小鼠妊娠结局。而小鼠出生后哺乳期生长体重的变化是一个较敏感的反映生长发育的指标[6],本研究结果显示,妊娠期小鼠尼古丁暴露使子鼠出生体重明显减低,且在同一生长发育阶段,随着染毒剂量的增加,实验组子鼠体重逐渐降低,提示妊娠期尼古丁暴露对子代体格发育具有负面影响。
研究表明,妊娠期尼古丁暴露可明显增加后代高血压病和冠心病的发生等[7];流行病学研究提示,妊娠期尼古丁暴露可显著增加“婴儿猝死综合症”的发病风险,而“婴儿猝死综合症”和异常的心脏传导系统以及恶性心律失常有密切关系[8]。上述文献提示,宫内尼古丁暴露可能与心血管疾病发生之间存在因果关系。本研究中,尼古丁暴露组断乳子鼠心脏组织形态受损,心肌纤维萎缩,心肌显微间隙增大,且上述改变随尼古丁暴露浓度升高而程度加重,提示生命早期尼古丁暴露可能影响子代心脏正常组织结构形成,对生后远期心血管功能可能造成负面影响。
哺乳动物脾脏具有造血和免疫两大功能,主要由其内的红髓和白髓组织结构完成。流行病学调查和动物实验有关尼古丁暴露对脾脏结构影响的研究报道鲜见,但尼古丁暴露人群免疫功能受损已得到证实。早在1977年,研究人员就提出吸烟对人体健康的多数有害作用都体现在对免疫系统的危害上。研究显示,在人和动物都发现吸烟与NK细胞的百分比及活性降低有关[9];猴子的脾细胞和人的白细胞经香烟烟雾处理后对有丝分裂原的反应能力降低[10];尼古丁单独也可以引起细胞免疫和体液免疫的改变,如可以降低炎症、降低脾细胞中抗体形成细胞的反应、降低T细胞受体介导的信号传导、低外周血单个核细胞的增殖等[11]。本研究中,尼古丁暴露组子鼠脾脏出现特征性结构边界不清,白髓面积逐渐变小,红髓面积逐渐增大等表现,提示生命早期尼古丁暴露可能影响子代脾脏正常组织结构形成,对生后远期免疫和造血功能可能造成负面影响。
前瞻性研究显示,吸烟与肝癌之间存在病因学联系,是肝癌发生的危险因素之一,吸烟人群肝癌发病率明显升高[12]。Wang等[13]报道,大鼠妊娠期尼古丁暴露所产子鼠肝脏发育迟缓,肝脏特征性酶表达水平降低,肝脏内发生氧化应激损伤。最近,Ma等[14]报道,妊娠期大鼠尼古丁皮下注射使得子代180日龄子鼠肝功能异常,血及肝内甘油三酯明显增高。本研究中,尼古丁暴露组子鼠肝脏出现水肿,并随尼古丁暴露浓度升高而程度加重,这种病理损伤对肝脏远期功能可能造成不良影响。
近期有动物模型证实,青少年时期的动物暴露于尼古丁会产生行为和电生理学的变化,并且会持续至成年[15]。文献报道,尼古丁不仅能抑制小鸡睫状神经节神经元和PC12细胞突起的生长[16], 还能抑制鸡胚胆碱能神经元树突的生长[17],提示尼古丁对脑发育中正常的细胞分裂后事件,如神经细胞突起生长及细胞迁移、识别等过程等,有干扰作用。流行病学资料表明,孕妇接触尼古丁会导致后代智力下降和中枢神经系统功能异常,如认知障碍、注意力涣散、学习和记忆能力低下、行为异常等,上述文献提示,妊娠期尼古丁暴露可能与子代神经精神疾病发生之间存在因果关系。但在本研究中,各尼古丁暴露组子鼠海马结构均未发现明显改变,这可能与观察靶点和检测水平有关。 孕期尼古丁暴露导致的子代生后远期认知功能异常,可能与大脑皮层发育异常有关;张海心等[19]报道,妊娠期尼古丁暴露使21日龄子鼠大脑组织神经细胞凋亡。在下一步工作中,本课题组将对各尼古丁暴露组子代小鼠的大脑皮层及海马组织的进行电镜观察及分子水平的检测,以明确妊娠期尼古丁暴露对子代小鼠神经系统发育的影响。
孕期不良环境对子代的跨代遗传效应已经被证实,但是其潜在的机制仍是近年来研究的热点。本研究结果提示,妊娠期尼古丁暴露可能影响子代心、肝、 脾组织形态形成,为深入研究尼古丁的发育毒性以及尼古丁对远期健康的影响积累了资料,提供了依据。然而,本研究只观察了子代重要脏器的形态,没有对相应脏器的功能和远期疾病发生进行追踪,其因果关系的确定尚需要进一步研究。
[1] 郭自景, 徐丹, 罗瀚文, 等. 孕期尼古丁暴露所致子2代小鼠神经内分泌代谢编程改变的可遗传效应[J]. 中国药理学与毒理学杂志, 2015, 2(2): 277-283.
[2] Imura H. Life course health care and preemptive approach to non-communicable diseases[J]. Proc Jpn Acad Ser B Phys Biol Sci, 2013, 89(10): 462-473.
[3] Somm E, Schwitzgebel VM, Vauthay DM, et al. Prenatal nicotine exposure and the programming of metabolic and cardiovascular disorders[J]. Mol Cell Endocrinol, 2009, 304(1-2): 69-77.
[4] Bublitz MH, Stroud LR. Maternal smoking during pregnancy and offspring brain structure and function: review and agenda for future research[J]. Nicotine Tob Res, 2012, 14(4): 388-397.
[5] Fudvoye J, Bourguignon JP, Parent AS. Endocrine-disrupting chemicals and human growth and maturation: a focus on early critical windows of exposure[J]. Vitam Horm, 2014, 94(4): 18-25.
[6] Chen Z, Kamei C. Facilitating effects of histamine on spatial memory deficit induced by scopolamine in rats[J]. Acta Pharmacol Sin, 2000, 21(9): 814-818.
[7] Yuan M, Cross SJ, Loughlin SE, et al. Nicotine and the adolescent brain[J]. J Physiol, 2015, 593(16): 3397-3412.
[8] Neary MT, Breckenridge RA. Hypoxia at the heart of sudden infant death syndrome?[J]. Pediatr Res, 2013, 74(4): 375-379.
[9] Almanzar G, Eberle G, Lassacher A, et al. Maternal cigarette smoking and its effect on neonatal lymphocyte subpopulations and replication[J]. BMC Pediatr, 2013, 13(1): 57-62.
[10] Jubri Z, Latif AA, Top AG, et al. Perturbation of cellular immune functions in cigarette smokers and protection by palm oil vitamin E supplementation[J]. Nutr J, 2013, 12(1): 2-10.
[11] Liu Z, Han B, Li P, et al. Activation of α7nAChR by nicotine reduced the Th17 response in CD4(+)T lymphocytes[J]. Immunol Invest, 2014, 43(7): 667-674.
[12] 杨万水, 高静, 高姗, 等. 吸烟与肝癌前瞻性研究的荟萃分析[J]. 肿瘤, 2010, 30(3): 247-249.
[13] Wang T, Chen M, Yan YE, et al. Growth retardation of fetal rats exposed to nicotine in utero: possible involvement of CYP1A1, CYP2E1, and P-glycoprotein[J]. Environ Toxicol, 2009, 24(1): 33-42.
[14] Ma N, Nicholson CJ, Wong M, et al. Fetal and neonatal exposure to nicotine leads to augmented hepatic and circulating triglycerides in adult male offspring due to increased expression of fatty acid synthase[J]. Environ Toxicol, 2014, 275(1): 1-11.
[15] Lydon DM, Wilson SJ, Child A, et al. Adolescent brain maturation and smoking: what we know and where we′ re headed[J]. Neurosci Biobehav Rev, 2014, 45(5): 323-342.
[16] Kang L, Tian MK, Bailey CD, et al. Dendritic spine density of prefrontal layer 6 pyramidal neurons in relation to apical dendrite sculpting by nicotinic acetylcholine receptors[J]. Front Cell Neurosci, 2015, 9(1): 398-405.
[17] Britto LRG, Lindst rom JM, Torrao AS. Nicotine and A-bungarotoxin midigy the dendritic growth of cholinocept ive neurons in the developing chick tectum[J]. Dev Brain Res, 2003, 143(1): 115-118.
[18] Sepehri G, Parsania S, Hajzadeh MA, et al. The effects of co-administration of opium and morphine with nicotine during pregnancy on spatial learning and memory of adult male offspring rats[J]. Iran J Basic Med Sci, 2014, 17(9): 694-701.
[19] 张海心, 薛晓东, 翟秀岩. 宫内暴露尼古丁对生后小鼠大脑皮层神经细胞凋亡的影响[J]. 解剖科学进展, 2005, 11(4): 295-297.
Effect of nicotine exposure during maternal pregnancy on organ development of offspring mice
LI Yuan-yuan, ZHANG Fang
(DepartmentofObstetricsandGynecology,GeneralHospitalofShenyangMilitaryAreaCommand,Shenyang110015,China)
Objective To investigate the effects of nicotine exposure during pregnancy on organ development of offspring mice. Methods Twenty-four pregnant Kunming mice were randomly and evenly divided into four groups. Mother mice were subcutaneously injected with nicotine saline at 0, 1, 2, 4mg/kg daily from gestation day 7 to childbirth. Body weight of offspring was monitored from birth to postnatal 35days. Offspring brain, heart, liver, spleen, and kidney were observed under microscope. Results Compared with the control, the weights of offspring in nicotine exposure groups were all decreased (P<0.05). At the postnatal day 35, the weights decreased with the increasing of nicotine concentration. The atrophy in myocardial fibers, hydropic degeneration in liver cells, and obscure characteristic structure of spleen with atrophic white pulp and expanded red pulp were found under microscope. Conclusion Nicotine exposure during pregnancy could result in abnormal morphology in multiple organs of offspring mice, which might be the anatomical basis and pathogeny of chronic diseases in later life.
pregnancy; nicotine; offspring; organ development; organ structure
10.11724/jdmu.2015.06.06
李园园(1968-),女,辽宁沈阳人,副主任医师。
张 舫,主治医师。E-mail:1120430265@qq.com
R135.1
A
1671-7295(2015)06-0541-06
李园园,张舫. 妊娠期尼古丁暴露对子鼠脏器发育的影响[J].大连医科大学学报,2015,37(6):541-546.
2015-08-17;
2015-11-13)

