水杨酸对沙打旺幼苗耐盐性的影响
王宝增等

摘要:以沙打旺(Astragalus adsurgens Pall.)幼苗为材料,采用200 mmol/L NaCl 并添加不同浓度水杨酸(SA,0.2、0.4、0.6、0.8、1.0 mmol/L)的处理方法,通过测定沙打旺幼苗耐盐生理指标,确定外源SA对沙打旺幼苗耐盐生理特性的影响。结果表明,一定浓度的SA能明显提高盐胁迫下沙打旺幼苗叶片脯氨酸和可溶性糖含量;增强盐胁迫下沙打旺幼苗叶片过氧化物酶(POD)和过氧化氢酶(CAT)活性,降低叶片丙二醛(MDA)含量;提高盐胁迫下沙打旺幼苗的根系活力。0.6 mmol/L SA处理效果最为明显。说明外源SA能够调节沙打旺幼苗有机渗透调节物质含量和抗氧化酶系活性以及根系活力,缓解盐胁迫对沙打旺幼苗的伤害。
关键词:沙打旺(Astragalus adsurgens Pall.);水杨酸(SA);耐盐性
中图分类号:S551 文献标识码:A 文章编号:0439-8114(2015)18-4525-04
DOI:10.14088/j.cnki.issn0439-8114.2015.18.033
土壤盐渍化是一个全球性的问题,全球有20%的耕地和近半数的灌溉土地都受到不同程度的盐害威胁[1]。盐胁迫不但使植物吸水困难,还破坏植物活性氧产生与清除系统的动态平衡,启动脂质过氧化作用,破坏膜脂和膜蛋白,从而影响植物的生长发育。在目前人口不断增加、耕地日趋减少的情况下,提高作物的耐盐性是开发利用盐碱地最根本、最经济和最有效的方法[2]。
水杨酸(Salicylic acid,SA)是植物体内普遍存在的一种酚类次生代谢物质,1992年被确定为植物激素[3]。SA能够影响植物体内的许多生理过程,包括气孔开闭、种子萌发、离子吸收、质膜透性等[4]。近年来的研究表明,SA与植物非生物胁迫的抗性密切相关[5]。外源SA通过提高番茄[6]、菜豆[6]、大麦[7]、甜瓜[8]等作物细胞的抗氧化酶活性,增强了这些作物对低温、高温、渗透胁迫和重金属离子的耐受性。适当浓度的外源SA还能明显提高盐胁迫下荞麦[9]、玉米[10]、黑麦草[11]和阿月浑子幼苗[12]的耐盐性。
沙打旺(Astragalus adsurgens Pall.),又名直立黄芪、斜茎黄芪,是豆科黄芪属的多年生草本植物,同时也是优质的牧草和绿肥原料。沙打旺耐盐碱,抗逆性强,是中国北方地区水土保持及快速绿化荒山的先锋草种。近年来,生态环境建设及畜草业发展对沙打旺的需求不断增大。笔者对沙打旺幼苗的耐盐机理已做过初步探讨[13]。然而,关于SA与沙打旺耐盐性之间的关系尚缺乏研究。本试验通过研究SA对沙打旺耐盐能力的影响,明确SA缓解沙打旺盐害的生理机制,为提高沙打旺耐盐性提供理论依据。
1 材料与方法
1.1 材料培养和处理
挑选大小一致、子粒饱满的沙打旺种子,用2%的次氯酸钠消毒8 min,然后用自来水与蒸馏水分别冲洗3次,用滤纸吸干种子外附水分。将种子置于垫有湿纱布的培养皿中,26 ℃培养箱培养。待幼苗长到3 cm左右,移栽到盛有干净细沙的塑料盆中,浇灌Hoagland营养液,于温室中培养。温室昼夜温度(25±5) ℃/(15±5) ℃,每天光照14 h,光照强度约为(700±100) μmol/(m2·s),相对湿度60%~70%。培养4周后,选取生长势一致的幼苗,分成3组:第1组只供给Hoagland营养液,作对照处理;第2组采用200 mmol/L NaCl 溶液(NaCl 溶于Hoagland 营养液)处理,作NaCl 处理;第3组在200 mmol/L NaCl处理的基础上分别添加不同浓度SA(0.2、0.4、0.6、0.8、1.0 mmol/L),作SA+NaCl 处理。处理7 d后取样进行生理指标测定,每个处理设3个重复。
1.2 测定方法
脯氨酸含量采用酸性茚三酮染色法[14],可溶性糖含量采用苯酚法[15],丙二醛(MDA)含量采用硫代巴比妥酸法[16],根系活力采用TTC法[17],过氧化物酶(POD)、过氧化氢酶(CAT)活性参照陈建勋等[18]的方法测定。
1.3 数据处理
所有数据以平均值±标准差表示,采用SPSS15.0进行方差分析和差异显著性检验。
2 结果与分析
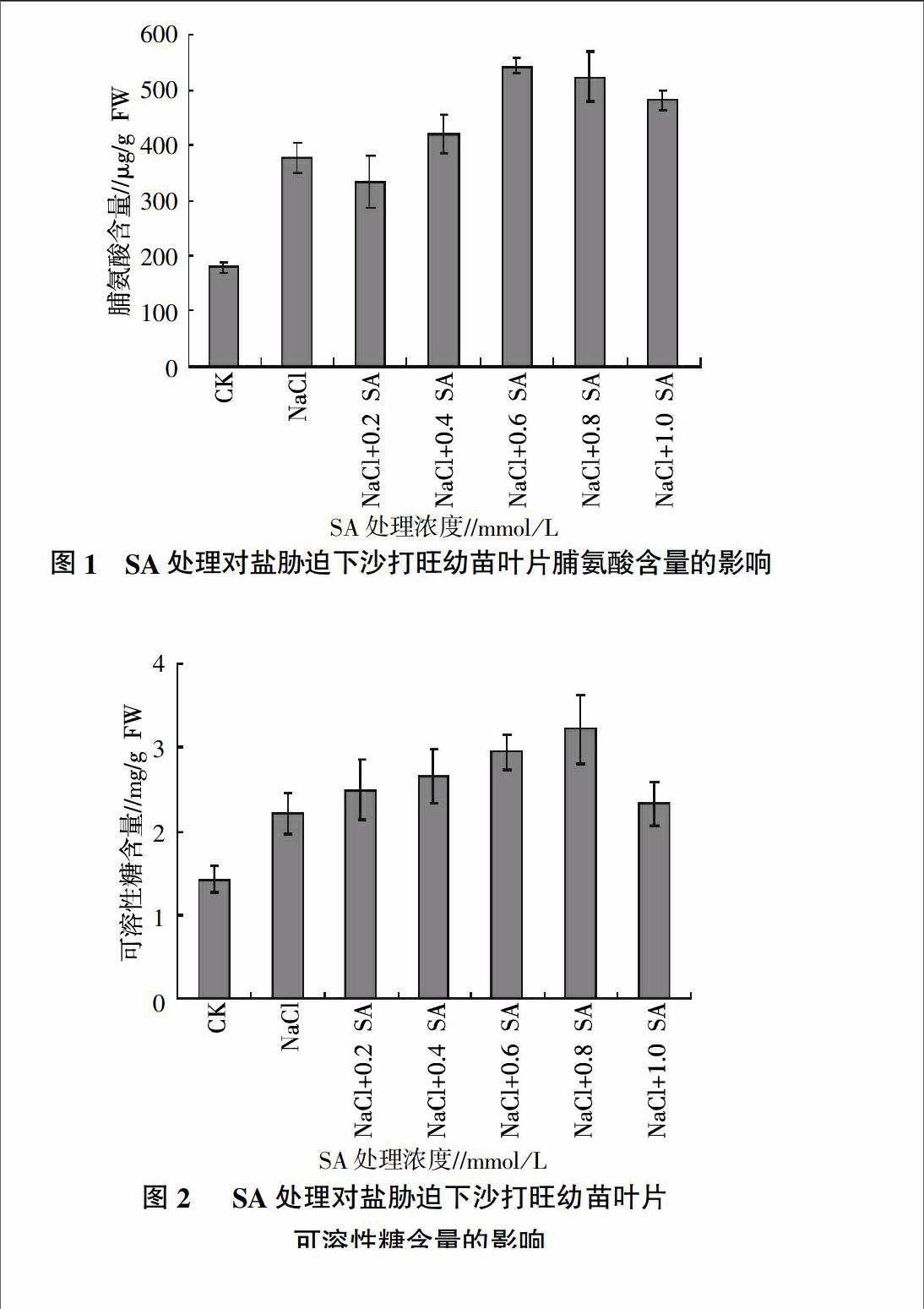
2.1 外源SA处理对盐胁迫下沙打旺叶片脯氨酸含量的影响
由图1可知,与对照组相比,NaCl处理的沙打旺幼苗叶片脯氨酸含量明显增加;添加不同浓度SA,其脯氨酸含量均明显高于对照。与单纯NaCl胁迫比较,除了较低浓度的SA(0.2 mmol/L)处理组含量降低(P>0.05)外,其余各处理脯氨酸含量均有增加,0.6~0.8 mmol/L SA组增加较为明显,分别比单纯盐胁迫增加了44.1%(P<0.01)和38.7%(P<0.01)。
2.2 外源SA处理对盐胁迫下沙打旺幼苗叶片可溶性糖含量的影响
由图2可见,SA处理组的沙打旺幼苗其可溶性糖含量变化趋势与脯氨酸基本一致,可溶性糖含量随外源SA浓度增加也呈现出先升高后降低的趋势。在0.4~0.8 mmol/L SA浓度范围内,其可溶性糖含量比单纯NaCl胁迫依次增加了19.3%(P>0.05)、35.9%(P<0.05)、44.8%(P<0.01)。
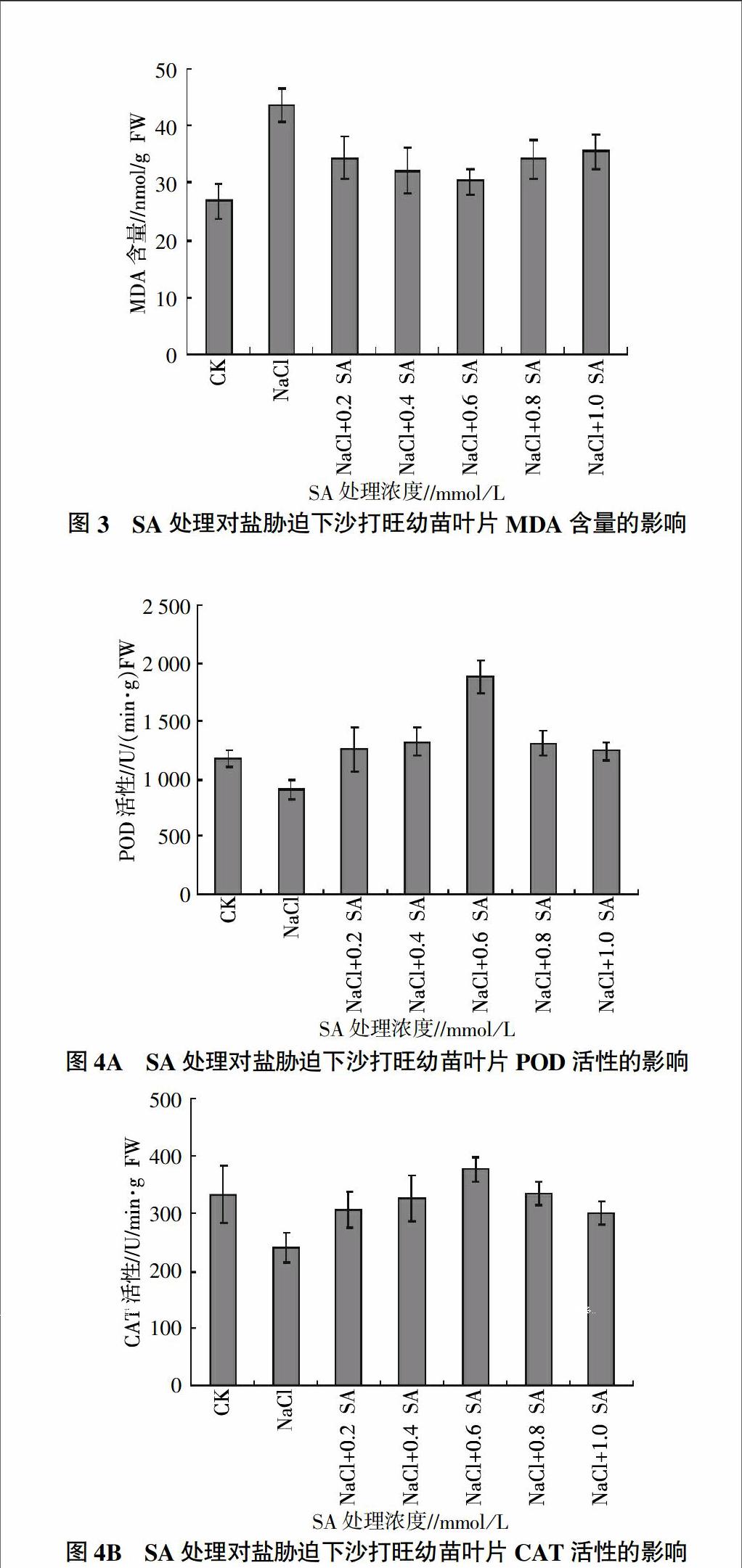
2.3 外源SA处理对盐胁迫下沙打旺幼苗叶片MDA含量的影响
由图3可见,NaCl胁迫使沙打旺幼苗叶片MDA含量增加。添加不同浓度SA后,MDA含量虽然仍高于对照组,但与单纯NaCl胁迫相比,均有不同程度降低,从低到高5个SA浓度处理组,其MDA含量比单纯NaCl处理分别降低了20.7%(P<0.05)、26.0%(P<0.05)、30.6%(P<0.01)、21.4%(P<0.05)、18.6%(P<0.05)。
2.4 外源SA处理对盐胁迫下沙打旺幼苗叶片POD、CAT活性的影响
盐胁迫降低了沙打旺幼苗叶片POD活性(图4A)和CAT活性(图4B)。添加不同浓度的SA后,两种酶的活性均有不同程度的增加,且和单纯NaCl胁迫比较,均表现出随SA浓度增加先升高后降低的趋势。其中,不同浓度SA处理组的沙打旺幼苗POD活性均高于对照(图4A),而不同浓度SA处理组沙打旺幼苗的CAT活性基本与对照持平(图4B)。0.6 mmol/L SA处理组沙打旺幼苗POD活性和CAT活性增幅最大,分别比单纯盐胁迫增加了106.2%(P<0.01)和56.7%(P<0.01)。
2.5 外源SA处理对盐胁迫下沙打旺幼苗根系活力的影响
由图5可见,盐胁迫使沙打旺幼苗根系活力降低,而SA处理在一定程度上缓解了这种抑制效应。添加SA的处理组其幼苗根系活力均高于单纯NaCl处理组,且不同SA浓度下幼苗根系活力增幅不同,0.4~0.8 mmol/L SA处理下幼苗根系活力增幅较为明显,分别比NaCl处理增加了38.5%(P<0.01)、53.6%(P<0.01)、29.5%(P<0.05)。
3 讨论
积累有机溶质进行渗透调节是植物适应盐胁迫的重要机制[19]。由于盐胁迫往往引起胞质Na+升高,Na+通过离子区域化作用被运输到液泡内使胞质免受伤害,胞质则积累脯氨酸、可溶性糖等相容性溶质来维持渗透平衡[20]。本研究表明,一定浓度的SA处理可使沙打旺幼苗叶片脯氨酸和可溶性糖含量明显增加,以加强渗透调节能力(图1、图2),这与尚庆茂等[21]的结果一致。积累渗透调节物质,有利于增强沙打旺胞质的亲水吸附能力,降低细胞的渗透势,防止盐胁迫下的细胞失水,从而减轻植物盐害。关于外源SA提高植物脯氨酸含量的原因已有相关报道。Misra等[22]在小扁豆的研究中,证实了SA可激活脯氨酸合成酶(P5CR)活性,同时抑制脯氨酸氧化酶(ProDH)活性,因而导致脯氨酸的积累。而关于可溶性糖含量的增加,Shakirova等[23]认为外源SA可通过增强不溶性糖的水解反应来提高细胞可溶性糖含量,进而发挥重要的渗透调节作用。由此可以看出,SA通过介导脯氨酸合成、降解的调控以及不溶性糖类的水解反应来提高二者含量,从而提高沙打旺对盐胁迫的适应。
在正常条件下,植物细胞活性氧的产生和清除处于动态平衡之中,因此活性氧处于低水平。盐胁迫下,植物细胞活性氧会大量积累,过多的活性氧与膜脂不饱和脂肪酸发生氧化作用,导致脂质的过氧化,进而损害膜结构和功能的完整性,而MDA就是脂质过氧化的最终产物。此外,活性氧也会破坏DNA、蛋白质、叶绿素等分子。活性氧积累及其过氧化作用被认为是盐胁迫伤害的又一重要机制[24]。POD和CAT作为清除活性氧的抗氧化酶类,其活性高低直接影响植物细胞活性氧水平。本研究中,外源SA能够提高沙打旺幼苗叶片POD、CAT活性(图4A、图4B),有效抑制了活性氧的产生。再结合MDA含量,SA处理明显降低了盐胁迫下沙打旺幼苗叶片MDA的含量(图3),其原因可能是外源SA激活了抗氧化酶共同的转录因子,诱导抗氧化酶的表达[25]。Pancheva等[26]的研究认为SA可以在植物细胞膜疏水区积累,通过降低细胞电解质外渗率,减轻膜脂过氧化作用,保护蛋白质及保持膜结构的完整性,从而缓解逆境胁迫造成的膜伤害。
根系不仅负责植物体对水分、矿物质的吸收,同时也负责植物体许多重要物质的同化、转化或合成,根系活力强弱直接影响植物体的生命活动。盐胁迫首先影响到的就是根系,所以根系活力的检测就成为检验植株受害程度的一个重要指标[27]。从本研究可以看出,盐胁迫使沙打旺幼苗根系活力降低,外施SA逆转了这种变化趋势(图5),这与董慧等[11]在黑麦草、张彦[27]在番茄中的研究结果一致。说明一定浓度的SA可以通过提高盐胁迫下沙打旺幼苗的根系活力,进而增强其耐盐能力。
综上所述,SA能够提高沙打旺幼苗的耐盐性,主要由于SA可以提高其脯氨酸和可溶性糖含量,促进抗氧化酶活性,降低脂质过氧化,提高根系活力,这些因素共同作用,缓解了盐胁迫对沙打旺幼苗的抑制作用。需要明确的是,SA对植物耐盐性的效应随施用浓度的差异而变化[28,29],因此,在探讨水杨酸调节植物耐盐性机制时应注意水杨酸浓度的选择。
4 结论
外源施用SA,能够提高盐胁迫下沙打旺幼苗叶片脯氨酸、可溶性糖含量,增强其POD、CAT活性,降低其MDA含量,提高其根系活力。对于缓解NaCl胁迫,改善植株生长发育具有重要作用。从本试验可以看出,0.4~0.8 mmol/L SA 处理效果较明显,其中,0.6 mmol/L SA处理效果最佳。
参考文献:
[1] ZHU J K.Plant salt tolerance[J]. Trends in Plant Science, 2001,6(2):66-71.
[2] 何俊瑜,任艳芳.水杨酸对盐胁迫下叶用莴苣幼苗生长抑制的缓解效应[J].中国蔬菜,2010(8):30-35.
[3] RASKIN I. Salicylate, a new plant hormone[J]. Plant Physiology, 1992,99(3):799-803.
[4] EL-TAYEB M A. Response of barley grains to the interactive effect of salinity and salicylic acid[J]. Plant Growth Regulation, 2005,45(3):215-224.
[5] KHAN M I R, KHAN N A. Salicylic acid and jasmonates: Approaches inabiotic stress tolerance[J]. Journal of Plant Biochemistry Physiology,2013,1:e113.
[6] SENARATNA T,TOUCHELL D,BUNN E,et al.Acetyl salicylic acid(aspirin)and salicylic acid induce multiple stress tolerance in bean and tomato plants[J].Plant Growth Regulation,2000, 30(2):157-161.
[7] METWALLY A, FINKEMEIER I, GEORGI M, et al. Salicylic acid alleviates the cadmium toxicity in barley seedlings[J].Plant Physiology,2003,132(1):272-281.
[8] 张永平,范红伟,杨少军,等.外源水杨酸对镉胁迫下甜瓜幼苗生长、光合作用和活性氧代谢的缓解效应[J].植物生理学报,2014,50(10):1555-1562.
[9] 杨洪兵,孙 萍.外源水杨酸和茉莉酸对荞麦幼苗耐盐生理特性的效应[J].植物生理学报,2012,48(8):767-771.
[10] ISMAIL M A. Alleviation of salinity stress in white corn(Zea mays L.) plant by exogenous application of salicylic acid[J]. American Journal of Life Sciences,2013,1(6):248-255.
[11] 董 慧,段小春,常智慧.外源水杨酸对多年生黑麦草耐盐性的影响[J].北京林业大学学报,2015,37(2):128-135.
[12] BASTAM N,BANINASAB B,GHOBAD C.Improving salt tolerance by exogenous application of salicylic acid in seedlings of pistachio[J].Plant Growth Regulation, 2013,69(3):275-284.
[13] 王宝增,王 棉,田 薇,等.沙打旺对盐胁迫的生理响应[J].广东农业科学,2013,40(19):57-59.
[14] 张志良,瞿伟菁,李小方.植物生理学实验指导[M].第四版.北京:高等教育出版社,2009.
[15] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[16] 林植芳,李双顺,林桂珠,等.水稻叶片的衰老与超氧物歧化酶活性及脂质过氧化作用的关系[J].植物学报,1984,26(6):605-615.
[17] 张蜀秋.植物生理学实验技术教程[M].北京:科学出版社,2011.
[18] 陈建勋,王晓峰.植物生理学实验指导[M].第二版.广州:华南理工大学出版社,2006.
[19] 刘建新,王金成,王瑞娟,等.KCl对NaCl胁迫下燕麦幼苗活性氧代谢和渗透溶质积累的影响[J].植物研究,2015,32(2):233-239.
[20] MUNNS R,TESTA M.Mechanisms of salinity tolerance[J]. Annual Review of Plant Biology, 2008,59:651-681.
[21] 尚庆茂,宋士清,张志刚,等.水杨酸增强黄瓜幼苗耐盐性的生理机制[J].中国农业科学,2007,40(1):147-152.
[22] MISRA N,SAXENA P. Effect of salicylic acid on proline metabolism in lentil grown under salinity stress[J]. Plant Science, 2009, 177(3):181-189.
[23] SHAKIROVA F M, SAKHABUTDINOVA A R, BEZRUKOVA M V, et al. Changes in the hormonal status of wheat seedlings induced by salicylic acid and salinity[J]. Plant Science, 2003, 164(3): 317-322.
[24] FADZILLA N M, FINCH R P, BURDON R H. Salinity, oxidative stress and antioxidant responses in shoot cultures of rice[J].Journal of Experimental Botany, 1997,48(2):325-331.
[25] AGARWAL S,SAIRAM R K,SRIVASTAVA G C, et al. Role of ABA, salicylic acid,Calcium and hydrogen peroxide on antioxidant enzymes induction in wheat seedlings[J].Plant Science,2005,169(3):559-570.
[26] PANCHEVA T V,POPOVA L P,UZUNOVA A N. Effects of salicylic acid on growth and photosynthesis in barley plants[J].Journal of Plant Physiology,1996,149(1-2):57-63.
[27] 张 彦.外源水杨酸对盐胁迫下番茄幼苗生理特性的影响[J].北方园艺,2013(12):8-11.
[28] 王玉萍,董 雯,张 鑫,等.水杨酸对盐胁迫下花椰菜种子萌发及幼苗生理特性的影响[J].草业学报,2012,21(1):213-219.
[29] 蔡传杰,陈善娜,尹 梅,等.水杨酸对香荚兰抗逆相关酶的活性和丙二醛含量的影响[J].云南植物研究,2003,25(6):700-704

