慢性间歇低氧对大鼠牙周炎模型血清及牙龈组织中白细胞介素-18和低氧诱导因子-1α的影响
王斌 王小琴
山西医科大学第一医院口腔科,太原 030001
牙周炎是影响口腔健康的重要疾病,其致病机制除了细菌的直接侵入,细菌毒素及代谢产物也可破坏牙周组织,引起炎症反应和免疫反应,产生一系列炎症介质。阻塞性睡眠呼吸暂停低通气综合征(obstructive sleep apnea-hypopnea syndrome,OSAHS)是表现为睡眠时严重打鼾,呼吸暂停或憋气并会引起各重要器官、系统功能改变的一种疾病。目前已经发现,牙周炎和OSAHS有密切关系[1-2]。牙周炎患者中白细胞介素(interleukin,IL)-18和低氧诱导因子(hypoxia-inducible factor,HIF)-1α的表达明显升高[3-4];而OSAHS患者血清中IL-18水平也明显高于正常人群,且随着疾病严重程度的增加而增加[5]。有实验[6]发现,慢性间歇低氧诱发了HIF-1α表达升高,而慢性间歇低氧是OSAHS的一个显著特征,由此推断,IL-18、HIF-1α与牙周炎和OSAHS可能存在某种联系。目前关于牙周炎和OSAHS的研究还较少,本研究通过建立模拟OSAHS的间歇低氧条件下的大鼠牙周炎模型,观察IL-18和HIF-1α在血清和牙龈组织中的表达,探讨牙周炎和OSAHS发病相关的可能机制。
1 材料和方法
1.1 材料
1.1.1 主要实验材料和仪器 水合氯醛,大鼠IL-18酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒、大鼠HIF-1α ELISA试剂盒(武汉博士德生物工程有限公司)。动物间歇低氧仓(山西医科大学第一医院),测氧仪(浙江电化分析仪器厂);医用氧气(太原市欣易得气体厂)和高纯度氮气(北方气体有限公司)。
1.1.2 实验动物 5周龄健康雄性SD大鼠32只,质量(200±20) g,由山西医科大学实验动物中心提供。
1.2 实验方法
1.2.1 动物分组及建模 将32只大鼠适应性喂养1周,节律性光照,用随机数字表法将其分为4组:常氧对照组(A组)、常氧牙周炎组(B组)、低氧对照组(C组)、低氧牙周炎组(D组),每组8只,分笼饲养。A组:普通饲料喂养。B组和D组:10%的水合氯醛腹腔麻醉后,用0.2 mm的结扎丝结扎于大鼠双侧上颌第二磨牙牙颈部,尽量置于龈沟内,每周检查一次结扎丝,如有脱落应再行结扎;1周内逐渐增加高糖食物比例直至完全代替普通饲料,每日用高糖粉质饲料喂养。C组和D组:参考杜晓燕等[7]的方法,将大鼠放入间歇低氧舱内,每天缺氧时间为8 h。在实验期间,氮气和氧气在电磁阀的控制下循环输入低氧舱,每个循环为90 s,通过测氧仪监测低氧舱内的氧体积分数,最低为9%,最高为21%。低氧舱的低氧程度相当于临床上OSAHS患者中、重度水平。实验共历时8周。
1.2.2 牙周临床指数检查 8周后,所有大鼠禁食12 h以上,麻醉后先拆除其结扎丝,用牙周探针测量各组大鼠双侧上颌第二磨牙的出血指数(bleeding index,BI)及牙周附着丧失(attachment loss,AL)并作记录。BI的测定采用Mazza(1981)计分标准,AL为釉牙骨质界至牙周袋底的距离。先用牙周探针测量牙周袋深度,当探针退出时测得釉牙骨质界到龈缘的距离,两者相减为AL。每颗牙测量颊侧近中、颊侧中央、颊侧远中3个位点,两侧牙共测量6个位点,取均值。上述所有操作均由同一医师进行。
1.2.3 影像学检查和组织切片制作 实验结束后,用断头法处死实验动物,解剖取出上颌骨磨牙段。将上颌骨在多聚甲醛溶液中固定48 h,运用牙科X线机对取出的上颌骨进行影像学检查,观察牙槽骨吸收情况;然后用脱钙液脱钙2周,经脱水、包埋后制作切片,苏木精-伊红(hematoxylin-eosin,HE)染色。
1.2.4 牙龈组织及血清中IL-18、HIF-1α的检测 大鼠空腹下,腹主动脉取血,3 000 r·min-14 ℃下离心15 min,取上清液,装入EP管中,标号,-70 ℃保存。牙龈组织样本取自第二磨牙周围牙龈组织,用冰生理盐水冲洗,滤纸吸干后称重,制备组织匀浆(牙龈组织与盐水体积比为1∶9)3 000 r·min-14 ℃下离心15 min,取上清液,标号,-70 ℃保存。血清复温至室温,牙龈组织上清液用生理盐水稀释为1%的匀浆样本(体积比1∶9),分别使用IL-18、HIF-1α ELISA试剂盒对其进行检测。以OD值为横坐标,IL-18、HIF-1α的标准品浓度为纵坐标,得到曲线方程:IL-18为Y=27.066x2+331.50x-10.997(R2=0.999 5),HIF-1α为Y=16.596x2+96.513x-2.257 7(R2=0.999 7);通过曲线获得各样本的质量浓度。
1.2.5 数据分析方法 应用SPSS 19.0统计软件进行分析。各组BI总体比较采用Kruskal-Wallis H检验,组间两两比较采用Nemenyi检验,定量资料AL及ELISA结果组间比较采用方差分析,D组血清及牙龈组织中IL-18、HIF-1α质量浓度与AL的相关性采用Spearman相关分析,检验水准为双侧α=0.05。
2 结果
2.1 牙周临床指数检查
各组大鼠的BI检测结果见表1:A组与B组之间,C组与D组之间的差异均有统计学意义(P<0.05);而B组与D组之间,A组与C组之间的差异无统计学意义(P>0.05)。D组AL与其余3组之间的差异有统计学意义,B、C组AL值与A组之间的差异亦有统计学意义(P<0.05)。

表1 4组大鼠的BI和AL测量结果Tab 1 The results of BI and AL in four groups of rats n=8
2.2 影像学观察
4组大鼠的X线检查结果见图1:A组牙槽骨无明显吸收(图1A);B组有一定程度的牙槽骨吸收,牙周膜间隙明显增宽(图1B箭头示);C组牙槽骨有一定的骨质吸收(图1C箭头示);D组结扎区牙槽骨有较明显的骨质吸收,部分根分叉暴露(图1D箭头示)。
2.3 组织学观察
4组大鼠牙周组织HE染色结果如图2所示:A、C组根分叉区牙槽骨基本正常,B、D组根分叉区可见牙槽骨的骨吸收陷窝增加,牙周纤维紊乱、破坏,牙周组织破坏严重。
2.4 IL-18、HIF-1α质量浓度的测定
4组大鼠IL-18、HIF-1α的质量浓度见表2:B、C组的IL-18、HIF-1α质量浓度明显高于A组(P<0.05),D组高于其他3组,差异均有统计学意义(P<0.05)。

图1 4组大鼠牙槽骨的X线片Fig 1 X-ray images of alveolar bone in four groups of rats
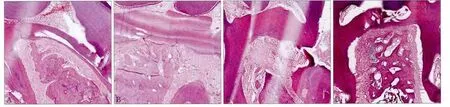
图2 4组大鼠上颌第二磨牙根分叉区组织学观察 HE × 40Fig 2 Histological observation of the furcation of maxillary second molars in four groups of rats HE × 40
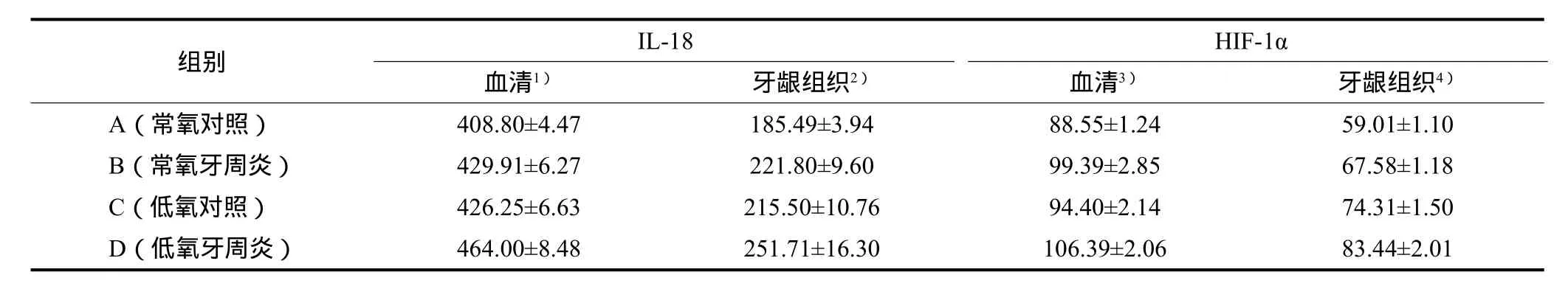
表2 4组大鼠血清及牙龈组织中IL-18、HIF-1α的表达Tab 2 Expression of IL-18 and HIF-1α in serum and gingival tissues in four groups of rats pg·mL-1, n=8,x±s
2.5 D组血清及牙龈组织中IL-18、HIF-1α质量浓度与AL的相关性
经Spearman相关性检验,D组血清中IL-18、HIF-1α质量浓度与AL呈正相关,相关系数r分别为0.792和0.753(P<0.05),D组牙龈组织中IL-18、HIF-1α质量浓度与AL也呈正相关,相关系数r分别为0.817和0.779(P<0.05)。
3 讨论
牙周炎是一种涉及到免疫炎症反应的疾病,而OSAHS也是与炎症相关的疾病。Ahmad等[8]发现:中重度牙周炎和OSAHS的发生有密切关系。间歇性低氧是OSAHS的一个显著特征。Ryan等[9]认为,OSAHS的间歇低氧/复氧可能是引起炎症反应的主要因素,引起炎症的主要有两条通路:1)依赖核转录因子-κB(nuclear factor-κB,NF-κB)产生炎症介质,从而形成炎症反应通路;2)依赖HIF-1产生的适应性通路。Burioka等[10]也认为:间歇性低氧能通过激活NF-κB信号通路,产生炎症细胞因子。基于此,本实验通过测定炎症因子IL-18和HIF-1α来研究牙周炎和OSAHS发病相关的可能机制。
IL-18是重要的促炎细胞因子,与多种疾病关系密切。牙周炎患者的龈沟液及血清中IL-18水平均要明显高于正常组[3,11]。有学者[12]对IL-18与牙周炎发生进行Meta分析,发现二者存在相关性,可作为预测牙周炎发展过程的一个生物学指标。但是,目前仍然无充足的证据来解释IL-18在牙周炎发生发展中所起的作用。Yoshinaka等[13]认为,IL-18是通过CD4+T细胞产生核转录因子κB受体活化因子配体(receptor activator of nuclear factor-κB ligand, RANKL)引起牙槽骨丧失,从而导致牙周炎发生。
HIF-1是一种氧调控转录因子,在哺乳动物的生理疾病的发病机制中发挥重要作用[14]。HIF-1由α和β两个亚单位构成,与多种疾病密切相关[15-16]。在组织低氧的情况下,可以诱导HIF-1α蛋白水平增加。Ng等[17]认为,由于炎症牙周组织的血管微循环受阻,白细胞浸润增加,牙周组织氧含量失调,产生的一些炎症介质如肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)可以激活HIF-1通路,导致牙周组织中HIF-1α表达增加。有学者[18]通过氯化钴模拟低氧实验发现,低氧通过激活HIF-1α促进牙周成纤维细胞的凋亡。这些实验均提示HIF-1α在牙周炎发展中起重要作用。
本实验成功建立了慢性间歇低氧牙周炎大鼠模型,可以观察到间歇低氧牙周炎组大鼠牙龈组织糜烂,影像学和组织学观察显示牙周组织破坏在4组中最为严重。BI结果显示,低氧对照组与常氧对照组、低氧牙周炎组与常氧牙周炎组的差异均无统计学意义,考虑可能是样本量较小的缘故。此外,低氧对照组与常氧对照组相比,低氧牙周炎组与常氧牙周炎组相比,AL的差异均有统计学意义,说明间歇低氧能促进牙周附着丧失,加重牙周炎症。同时,低氧对照组血清及牙龈组织中IL-18、HIF-1α质量浓度较常氧对照组,低氧牙周炎组较常氧牙周炎组均有显著升高(P<0.05),与苏晓丽等[6]的部分研究结果一致。此外,低氧牙周炎组IL-18、HIF-1α的质量浓度和AL存在正相关(P<0.05)。这些结果均说明慢性间歇低氧能促进牙槽骨的附着丧失,加重牙周炎症,并且与IL-18、HIF-1α的表达有关。慢性间歇低氧诱导IL-18、HIF-1α表达的增加,可能是OSAHS加重牙周炎的机制之一。目前,关于慢性间歇低氧诱导IL-18的机制仍不清楚。Li等[5]认为可能的机制是:1)许多细胞因子如IL-1β、TNF-α、IL-6诱导IL-18的表达;2)重复的夜间血氧不足和氧化应激反应直接诱导IL-18表达。有研究[19]表明,慢性间歇低氧可能通过激活NF-κB炎症通路,使TNF-α、IL-8等炎症细胞因子的浓度升高。由此推断,慢性间歇低氧可能通过激活NF-κB炎症通路,进而诱导IL-18表达的增加,从而加重牙周炎症。
本文探讨了慢性间歇低氧条件下大鼠血清及牙龈中IL-18、HIF-1α质量浓度的变化,为研究OSAHS患者牙周炎的发病机制提供了相关依据,但OSAHS和牙周炎都是多因素作用的炎症性疾病,其具体机制有待进一步研究。
[1]Keller JJ, Wu CS, Chen YH, et al. Association between obstructive sleep apnoea and chronic periodontitis: a population-based study[J]. J Clin Periodontol, 2013, 40(2):111-117.
[2]Seo WH, Cho ER, Thomas RJ, et al. The association between periodontitis and obstructive sleep apnea: a preliminary study[J]. J Periodont Res, 2013, 48(4):500-506.
[3]Pradeep AR, Hadge P, Chowdhry S, et al. Exploring the role of Th1 cytokines: interleukin-17 and interleukin-18 in periodontal health and disease[J]. J Oral Sci, 2009, 51(2):261-266.
[4]陈慧. 乏氧诱导因子在牙周炎牙龈中的表达研究[J]. 牙体牙髓牙周病学杂志, 2013, 23(10):633-635.
[5]Li C, Zhang XL, Liu H, et al. Association among plasma interleukin-18 levels, carotid intima- media thickness and severity of obstructive sleep apnea[J]. Chin Med J, 2009,122(1):24-29.
[6]苏晓丽, 彭殊蓉, 贺若曦, 等. 慢性间断低氧模型大鼠动脉内膜损伤及相关途径分析[J]. 中南大学学报: 医学版,2013, 38(7):676-680.
[7]杜晓燕, 胡良冈, 范小芳, 等. 大鼠间断低氧-复氧模拟睡眠呼吸暂停综合征模型的建立[J]. 实验动物与比较医学,2007, 27(1):11-14.
[8]Ahmad NE, Sanders AE, Sheats R, et al. Obstructive sleep apnea in association with periodontitis: a case-control study[J]. J Dent Hyg, 2013, 87(4):188-199.
[9]Ryan S, McNicholas WT. Intermittent hypoxia and activation of in fl ammatory molecular pathways in OSAS[J]. Arch Physiol Biochem, 2008, 114(4):261-266.
[10]Burioka N, Koyanagi S, Fukuoka Y, et al. In fl uence of intermittent hypoxia on the signal transduction pathways to in fl ammatory response and circadian clock regulation[J].Life Sci, 2009, 85(9/10):372-378.
[11]Sánchez-Hernández PE, Zamora-Perez AL, Fuentes-Lerma M, et al. IL-12 and IL-18 levels in serum and gingival tissue in aggressive and chronic periodontitis[J]. Oral Dis, 2011,17(5):522-529.
[12]Li ZG, Li JJ, Sun CA, et al. Interleukin-18 promoter polymorphisms and plasma levels are associated with increased risk of periodontitis: a meta-analysis[J]. In fl amm Res, 2014,63(1):45-52.
[13]Yoshinaka K, Shoji N, Nishioka T, et al. Increased interleukin-18 in the gingival tissues evokes chronic periodontitis after bacterial infection[J]. Tohoku J Exp Med, 2014, 232(3):215-222.
[14]Semenza GL. HIF-1 and mechanisms of hypoxia sensing[J].Curr Opin Cell Biol, 2001, 13(2):167-171.
[15]韩波, 李龙江, 代炜. 低氧诱导因子-1α在原发性颊黏膜鳞癌中的表达及意义[J]. 华西口腔医学杂志, 2007, 25(1):5-7.
[16]朱桂全, 梁新华. 低氧诱导因子-1α在骨关节炎发病机制中的研究进展[J]. 国际口腔医学杂志, 2008, 35(3):325-328.
[17]Ng KT, Li JP, Ng KM, et al. Expression of hypoxia-inducible factor-1α in human periodontal tissue[J]. J Periodontol,2011, 82(1):136-141.
[18]Song ZC, Zhou W, Shu R, et al. Hypoxia induces apoptosis and autophagic cell death in human periodontal ligament cells through HIF-1α pathway[J]. Cell Prolif, 2012, 45(3):239-248.
[19]McNicholas WT. Obstructive sleep apnea and in fl ammation[J]. Prog Cardiovasc Dis, 2009, 51(5):392-399.

