盐度对生物阴极微生物燃料电池脱氮除碳及产电性能的影响
刘 明 金春姬,2 孙若晨
(1.中国海洋大学环境科学与工程学院,山东 青岛 266100;2.中国海洋大学 海洋环境与生态教育部重点实验室,山东 青岛 266100)
水资源的短缺是全世界面临的主要问题,沿海城市的海水代用是解决问题的一个重要途径[1]。但是海水的利用势必会产生含盐废水,会对微生物的物理和生化性能造成影响,导致微生物渗透压改变,从而影响生物处理的性能[2]。
微生物燃料电池(MFC)是将微生物充当为催化剂,将化学能转化成电能的系统[3]。其去除污染物同时产电的性能得到国内外学者的关注[4-8]。生物阴极MFC[9](BCMFC)使用微生物代替化学物质作为催化剂,解决了二次污染、催化剂中毒以及投资过高等问题。目前BCMFC已被证明能够处理多种类型的废水[10-12]。近几年,研究者的目光集中在BCMFC脱氮除碳同时产电的研究上,使用阳极微生物降解有机物,阴极微生物实现同时硝化反硝化[10-13]。使用 BCMFC 处理含盐废水时,适当盐度的增加会提高MFC的产电性能[14],但是盐度过高会影响阳极和阴极微生物的新陈代谢[15],从而影响BCMFC去除污染物能力和产电性能。
本实验配制不同浓度模拟海水,阴极采用间歇曝气模式,研究了在盐度影响下,BCMFC脱氮除碳及产电性能,进行了COD和氨氮去除的动力学和硝化反硝化酶活性的分析,以期为BCMFC处理含盐废水提供参考。
1 实验部分
1.1 实验装置
实验采用双室 MFC构型[16],如图1所示。由两个长方形有机玻璃构成,两个极室净容积为0.5 L。阳极材料为碳布,表面积为35 cm2,阴极材料是表面积为35 cm2的光谱纯石墨板,阴极室中填充1 cm×1 cm×1 cm的碳毡,有效阴极体积约为0.2 L。中间采用有效表面积为48 cm2的质子交换膜(PEM)将阳极室与阴极室分开。使用钛丝将电极相连接,外接22~22 000 Ω电阻箱。
1.2 实验设计
启动5个不同盐度的BCMFC,盐度分别为0%、10%、30%、50%和70%海水比例(相对于海水盐度的百分比,由海水晶提供,每升模拟废水中分别含有0、3.5、10.5、17.5、24.5 g 海水晶)。每升模拟废水中除了加入相应的海水晶外,含有乙酸钠(2.0 g/L)、NaHCO3(1.0 g/L)、NH4Cl(0.3 g/L)、NaH2PO4·2H2O(6.08 g/L)、Na2HPO4·12H2O(21.8 g/L)及微生物所需的微量营养物质[17]。温度维持在30±1℃。启动过程采用间歇运行,逐步提高盐度的方法。经过3个月的启动期,改为阳极室使用蠕动泵连续供水,阴极保持启动时的间歇曝气模式。在1个周期内阴极运行的顺序是进水0.5 h,曝气6 h,停止曝气2 h,出水0.5 h。将阳极室的出水收集到密闭容器中,阴极运行1个周期后再将阳极出水倒入阴极。
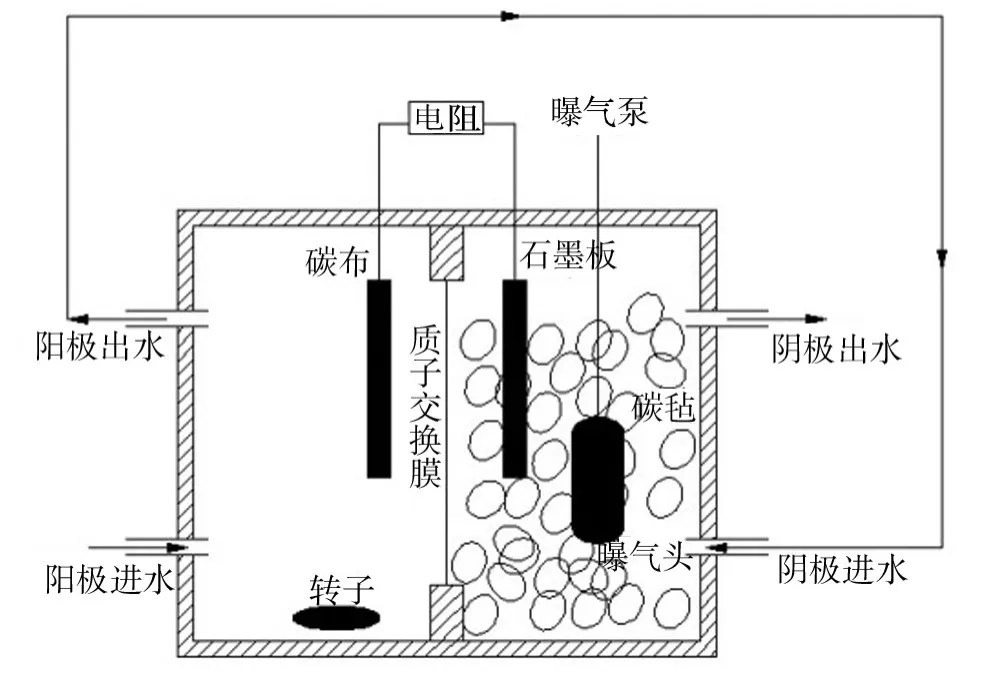
图1 BCMFC实验装置
1.3 分析方法
实验电压使用信号采集器采集,采集器每隔1min将数据传递给电脑储存电压数据。通过改变外接电阻值测得电压数据,经过公式(1)和(2)计算得出电流密度和功率密度,以电流密度为横坐标,分别以电压和功率密度为纵坐标绘制得到极化曲线与功率密度曲线。硝化反硝化酶的活性是以NH4Cl和Na2NO2作为测量指标,表征单位时间内,单位微生物所含蛋白质中NH4+-N或NO2--N增加或减少的物质的量。
电流密度JA(mA/m3):

式中,I为电流(A);VA为阳极室体积(m3)。
功率密度PA(mW/m3):
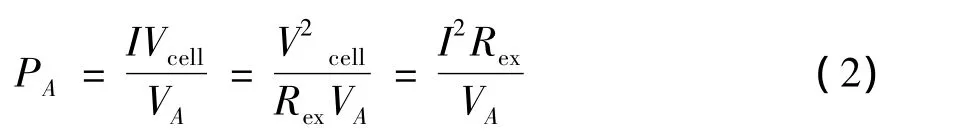
式中,Vcell为电池电压(V);Rex为外接电阻(Ω)。
COD、NH4+-N、NO2--N和NO3--N等化学指标的测定方法均是国家标准方法。硝化反硝化过程中主要参与的酶有氨单加氧酶(AMO)、亚硝酸盐氧化酶(NOR)、硝酸盐还原酶(NR)以及亚硝酸盐还原酶(NIR),其测定活性见文献[18]。实验所用试剂均为分析纯。
2 结果与讨论
2.1 盐度对BCMFC三氮变化的影响
成功启动5个不同盐度的BCMFC,阳极连续进水,阳极的出水进入阴极,阴极按照SBR工艺运行,控制阴极进水时的溶解氧浓度为5.0 mg/L。外接500 Ω电阻,反应温度维持在30±1℃。实验中分别取阳极进水、阳极出水(阴极进水)、曝气停止以及阴极最后出水,4个不同时间段的水样测试。盐度对阴阳两室脱氮的影响见图2所示。
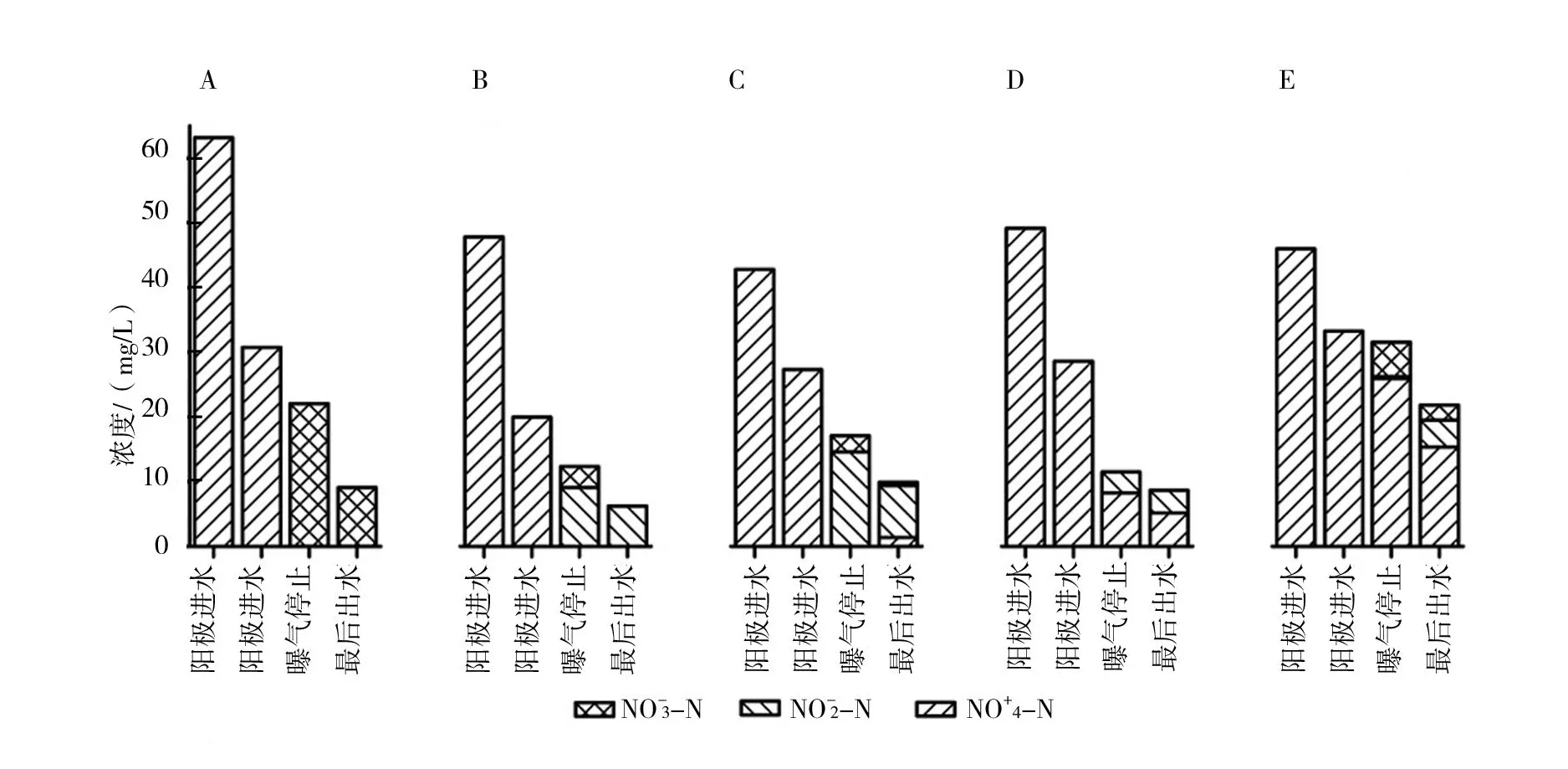
图2 不同盐度下BCMFC三氮浓度的变化(图中A、B、C、D和E分别表示海水比例为0%、10%、30%、50%和70%盐度)
由图2可知,氮在阳极出水中主要以氨氮形式存在,受盐度的影响,阳极微生物去除氨氮的性能变差,出水中氨氮的浓度随着盐度的增加而升高。曝气时阴极发生硝化反应,在0%海水比例时,阴极室中的氮以硝态氮的形式存在,10%海水比例时,亚硝酸盐出现并积累,曝气结束时浓度达到12.64 mg/L。30%海水比例时,亚硝酸盐的积累量达到最大,为20.26 mg/L。然而当盐度超过30%海水比例时,亚硝酸盐的积累量随着盐度的增加而变小。可能原因是亚硝酸盐细菌和硝酸盐细菌对盐的耐受性不同[19],首先抑制硝酸盐细菌的活性,导致亚硝酸盐转成硝酸盐的过程变缓甚至停止,所以会造成亚硝酸盐的积累。随着盐度继续增加,亚硝酸盐细菌亦受到盐度的抑制作用,从而导致在盐度≥50%海水比例时,亚硝酸盐的浓度也减少。曝气停止后,阴极发生反硝化反应,相比于0%海水比例的全程硝化反硝化过程,盐度为10%海水比例则变成了短程硝化反硝化过程,缩短反硝化的时间。但是盐度≥30%海水比例,反硝化微生物受到抑制,反硝化效果变差。最后出水中,三氮之和记为总氮(TN)浓度分别为9.13 mg/L、8.62 mg/L、11.71 mg/L、11.98 mg/L以及30.21 mg/L,去除率分别为 85.54%、86.99%、80.23%、82.41% 以及 52.55%。可以明显看出当盐度大于30%海水比例时,BCMFC的脱氮性能受到抑制。
2.2 盐度对BCMFC化学需氧量去除的影响
BCMFC运行过程中COD(进水COD浓度约为1 600 mg/L)去除率的变化见图3所示。
从图3可以看出,盐度<50%海水比例时,BCMFC对COD的去除效果大致相同,当盐度≥50%海水比例,盐度抑制BCMFC降解有机物。盐度<50%海水比例时,阳极出水中COD的去除率变化不大,均能达到89%以上。当海水比例升高至50%时,去除率降至77%左右,70%海水比例盐度下,COD去除率降至69%。曝气停止时COD的浓度分别为19、22、82、104、326 mg/L,去除率分别为 99%、98%、95%、94%、80%。从图3还可以看出,在氧气足够的情况下,仅有70%海水比例盐度的BCMFC的COD去除率较差。最后出水中COD浓度分别为13、9、38、51、229 mg/L,去除率分别为 99%、99%、98%、97%、86%。以上现象说明盐度对阳极和阳极微生物有抑制作用。原因是微生物在盐度较高的条件下,会生成保护机制,分泌胞外聚合物保护细胞,平衡渗透压,或者改变酶的代谢途径以求生存,这些过程需要能量,所以微生物用于繁殖的能量变少,生长缓慢,生物量变少,COD去除效果自然降低。
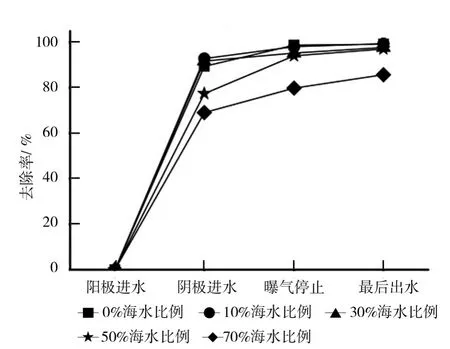
图3 不同盐度下BCMFC的COD去除率的变化
2.3 盐度对BCMFC产电性能的影响
极化曲线与功率密度曲线能够很好的反应BCMFC产电过程中内阻和输出功率随盐度的变化。由于不曝气的时候改变了DO的量,电压值很小,输出电流直线下降,功率密度也不大,所以本文所测的极化曲线与功率密度曲线均是在曝气阶段测试的。不同盐度下的BCMFC极化曲线和功率密度曲线见图4。
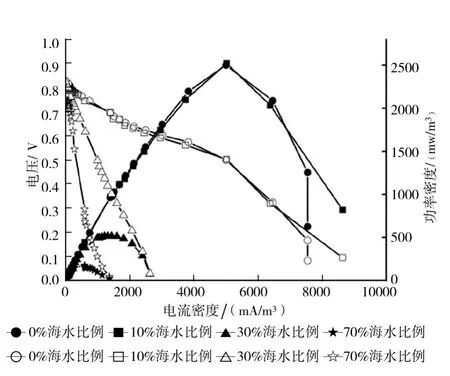
图4 不同盐度下BCMFC极化曲线和功率密度曲线(图中实心图标表示功率密度,空心图标表示极化曲线)
从图4可以看出,BCMFC的输出功率及内阻受盐度的影响较大。0%海水比例下,最大功率密度为2 500 mW/m3,根据全电路Ohm定律[3]计算出0%海水比例下的内阻为160 Ω。随着盐度的增加,功率密度有所上升,为2 520 mW/m3,内阻为151 Ω。原因是盐度的加入,增加BCMFC的电导率,减少欧姆损失。参比电极与双极膜间由于溶液传导而引起的欧姆损失可由公式(4)计算[20]

式中,dw为溶液宽度(cm);I为电流密度,A/cm2;S为溶液的电导率(S/cm)。当溶液宽度(即极间距)固定不变时,增加电导率会使欧姆损失减少,从而提高功率密度。但是图4可以明显看出,当盐度为30%海水比例及70%海水比例时,最大输出功率分别为515 mW/m3和175 mW/m3,内阻分别为600 Ω和1 352 Ω。最大输出功率密度随着盐度的增加而下降,内阻上升至10%海水比例的4倍和9倍。原因是:(1)在盐度的作用下,虽然增加了电导率,但是电导率增加到一定程度就达到饱和,不能很大程度的增加功率密度和减少内阻。而且添加的海水晶中含有大量的Cl-,会对微生物有毒害作用,使阴阳两极的产电微生物受到抑制,所以导致输出功率密度变小,内阻变大;(2)微生物和海水晶会堵塞PEM,从而导致阳极到阴极质子的传递速率降低,引起输出功率变小。
2.4 不同盐度下BCMFC基质降解动力学分析
实验使用自配污水,成分较为单一,实验过程中保持参数恒定,所以认为基质的降解动力学与基质的浓度有关,因此可以用简单动力学对BCMFC阳极降解有机物和阴极对氨氮去除过程加以描述,通过讨论零级、一级和二级三种动力学方程及其回归系数,来确定基质降解的反应级数和所对应的反应速率常数。比较不同盐度下反应速率常数,进一步解释盐度对有机物和氨氮去除过程的影响。
零级反应动力学方程:

一级反应动力学方程:

二级反应动力学方程:

式中Ct表示t时间的基质浓度;C0表示基质的初始浓度;t表示时间;k0、k1、k2分别表示零级、一级、二级反应速率常数。
2.4.1 阳极有机物降解动力学分析
在盐度影响下,阳极有机物降解动力学分析见表1。
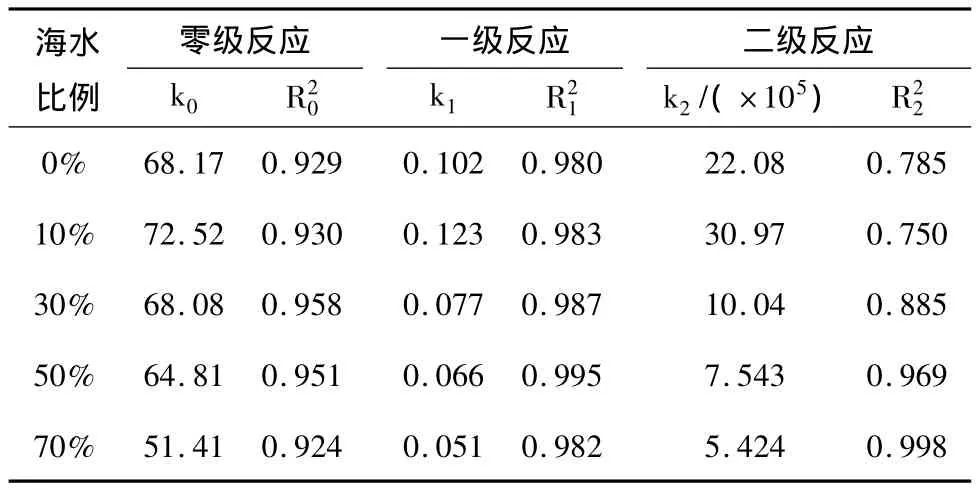
表1 不同盐度下阳极COD降解的反应动力学级数、反应速率常数及回归系数
由表1可知,0%海水比例下,一级反应方程拟合较好(R21=0.980),零级次之(R20=0.929),二级最差(R22=0.785)。相同的现象也发生在盐度为10%、30%和50%海水比例。这原因可能是由于底物乙酸钠是一种单一类型的易降解有机物质。所以呈现出的动力学反应级数较为简单。特殊的是在盐度为70%海水比例时,R22(0.998)>R21(0.982)>R20(0.924)。原因可能是受到盐度的影响,阳极微生物的种类与其他盐度下的不同,产生代谢途径不一样。比较不同盐度下的k1,随着盐度增加,k1先上升后下降,盐度为10%海水比例的k1是70%海水比例的2.4倍。说明10%海水比例下,阳极微生物降解COD的速率最快,所以在相同时间内出水中的COD浓度最低。
2.4.2 阴极氨氮去除动力学分析
在盐度影响下,阴极氨氮去除的反应动力学方程及回归系数见表2。
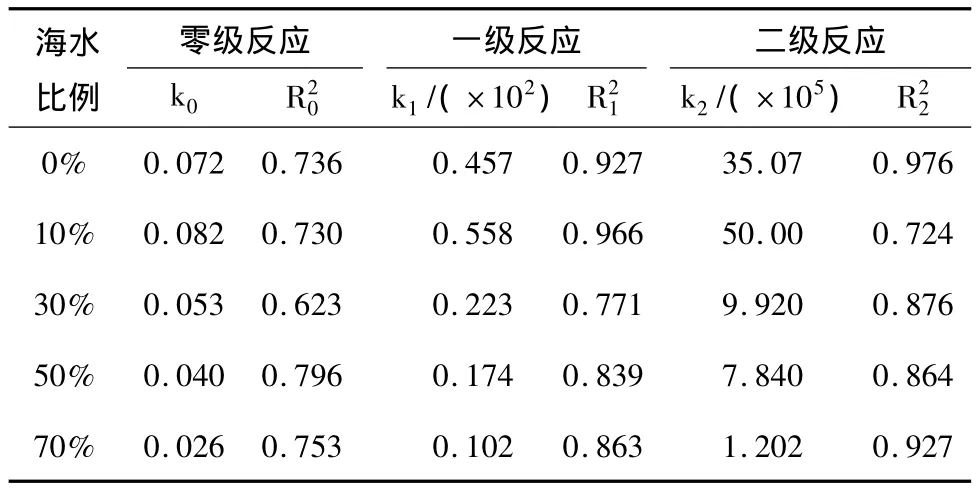
表2 不同盐度下阴极NH+4-N去除的反应动力学级数、反应速率常数及回归系数
由2表可知,比较5种盐度下的反应级数变化,除了海水比例为0%和10%是一级反应外,其他盐度下均为二级反应。10%海水比例下的k1是70%海水比例的5倍。说明盐度不仅影响了阴极氨氮的去除速率,而且可能影响了氨氮在阴极去除的途径,从图2三氮的变化也可以看出。因为盐度影响了阴极的亚硝酸盐细菌与硝酸盐细菌的活性,由于两者的耐盐性不同,随着盐度的增加,硝酸盐细菌的活性受到抑制,出现亚硝酸盐的积累;当盐度继续增加,抑制了亚硝酸盐细菌的活性,阻碍了阴极的亚硝酸化的进程,降低了氨氮转化速率以及影响了阴极微生物的代谢途径。
2.5 硝化反硝化酶的活性
硝化反硝化过程中参与的酶:AMO、NIR、NR以及NIR的活性,见表3。
由表3可知随着盐度增加,AMO在盐度≥50%海水比例时,活性下降。从图2也可以看出,在海水比例为50%和70%时,二者的硝化过程产生的亚硝酸盐的浓度小于海水比例为10%和30%的情况。NOR在盐度为0%~30%海水比例范围内变化不大,当盐度≥50%海水比例时,NOR活性下降,说明盐度对硝酸盐细菌产生影响。从NR和NIR的变化可以看出,高盐度对反硝化细菌活性起到的抑制性作用。这也与图2所示一样,随着盐度增加反硝化性能变差。
3 结论
实验结果表明,BCMFC的阴极采用间歇曝气模式,使得BCMFC去除COD和NH+4-N的同时能够实现脱氮。
盐度为10%海水比例时,BCMFC脱氮除碳及产电性能最佳,TN去除率为86.99%,COD去除率为99%,最大输出功率为2 520 mW/m3,内阻为151 Ω。COD和NH+4-N符合一级反应动力学,反应速率常数最大。
BCMFC适宜的盐度范围为盐度≤30海水比例,盐度≥50%海水比例影响TN和COD的去除率,内阻增大至10%海水比例盐度的9倍左右,输出功率下降。随着盐度增加,反应级数由一级变为二级且反应速率常数减小;硝化反硝化酶的活性受到明显的抑制。
[1]尤作亮,蒋展鹏.海水直接利用及其环境问题分析[J].给水排水,1998,24(3):64 -67.
[2]于德爽,李津,陆婕.MBR工艺处理含盐污水的试验研究[J].中国给水排水,2008,24(3):5 -8.
[3]Logan B E,Hamelers B,Rozendal R,et al.Microbial fuel cells:methodology and technology[J].Environmental science& technology,2006,40(17):5181-5192.
[5]尤世界,赵庆良,姜珺秋.废水同步生物处理与生物燃料电池发电研究[J].环境科学,2006,27(9):1786-1790.
[6]詹亚力,王琴,闫光绪,等.高锰酸钾作阴极的微生物燃料电池[J].高等学校化学学报,2008,29(3):559-563.
[7]李方,金春姬,崔灿洙,等.微生物燃料电池技术处理含铬废水的实验研究[J].中国海洋大学学报(自然科学版),2013,43(12):081 -086.
[8]Wang Y,Niu C G,Zeng G M,et al.Microbial fuel cell using ferrous ion activated persulfate as a cathodic reactant[J].international journal of hydrogen energy,2011,36(23):15344-15351.
[9]Bergel A,Féron D,Mollica A.Catalysis of oxygen reduction in PEM fuel cell by seawater biofilm[J].Electrochemistry Communications,2005,7(9):900-904.
[10]Virdis B,Rabaey K,Rozendal R A,et al.Simultaneous nitrification,denitrification and carbon removal in microbial fuelcells[J].Water research,2010,44(9):2970-2980.
[11]Zhang G,Zhao Q,Jiao Y,et al.Biocathode microbial fuel cell for efficient electricity recovery from dairy manure[J].Biosensors and Bioelectronics,2012,31(1):537-543.
[12]Park D H,Laivenieks M,Guettler M V,et al.Microbial utilization of electrically reduced neutral red as the sole electron donor for growth and metabolite production[J].Applied and environmental microbiology,1999,65(7):2912-2917.
[13]Xie S,Liang P,Chen Y,et al.Simultaneous carbon and nitrogen removal using an oxic/anoxic-biocathode microbial fuel cells coupled system[J].Bioresource technology,2011,102(1):348 -354.
[14]印霞棐,刘维平,袁霞静.连续流生物阴极微生物燃料电池废水处理与产电性能[J].水处理技术,2014,40(1):52-55.
[15]罗勇,骆海萍,覃邦余,等.盐度对MFC产电及其微生物群落的影响[J].中国环境科学,2013,33(5):832-837.
[16]于辉.过硫酸盐阴极型微生物燃料电池降解活性艳蓝及产电性能的研究[D].大连:中国海洋大学,2014.
[17]Lovely,D R,Phillips,E J,Novel mode of microbial energy metabolism:organism carbon oxidation coupled to dissimilatory reduction of iron and manganese[J].Appl.Environ.Microbiol.1988,54(6):1472–1480.
[18]Zheng X,Wu R,Chen Y.Effects of ZnO nanoparticles on wastewater biological nitrogen and phosphorus removal[J].Environmental science & technology,2011,45(7):2826-2832.
[19]Chen G H,Wong M T,Okabe S,et al.Dynamic response of nitrifying activated sludge batch culture to increased chloride concentration[J].Water research,2003,37(13):3125-3135.
[20]Ter Heijne A,Hamelers H V M,De Wilde V,et al.A bipolar membrane combined with ferric iron reduction as an efficient cathode system in microbial fuel cells[J].Environmental science& technology,2006,40(17):5200-5205.

