HIF-1α表达对晚期非小细胞肺癌患者化疗敏感性的影响*
王胜德危芬兰
(1. 江西省鹰潭市人民医院铁路分院肿瘤科 鹰潭 335000;2. 江西省鹰潭市人民医院肿瘤科 鹰潭 335000)
HIF-1α表达对晚期非小细胞肺癌患者化疗敏感性的影响*
王胜德1**危芬兰2
(1. 江西省鹰潭市人民医院铁路分院肿瘤科 鹰潭 335000;2. 江西省鹰潭市人民医院肿瘤科 鹰潭 335000)
目的:探讨HIF-1a表达对晚期非小细胞肺癌(NSCLC)患者的化疗敏感性。方法:选取我院收治的晚期NSCLC化疗患者92例,采用免疫组织化学法检测HIF-1a的表达,分析HIF-1a表达与化疗疗效的关系。结果:HIF-1a主要表达于肺癌细胞胞核及胞质,呈明显的异质性;HIF-1a不同表达患者间化疗有效率和疾病控制率比较差异无统计学意义(P>0.05)。结论:HIF-1a的表达状态与化疗近期疗效无明显相关性,尚不能确定为晚期NSCLC患者化疗疗效的预测因子。
缺氧诱导因子-1a 非小细胞肺癌 化疗 敏感性
肺癌是全球累积危险性最高的恶性肿瘤,其在所有的恶性肿瘤中预后最差,而其中超过80%的肺癌为非小细胞肺癌(non-small cell lung cancer,NSCLC)[1]。恶性肿瘤细胞生长迅速、代谢快,肿瘤组织血流灌注相对减少,造成肿瘤内局部组织有显著的缺氧区域 ,且肿瘤细胞缺氧程度可在一定程度上反应恶性程度及局部复发情况[2]。本研究通过检测晚期NSCLC患者缺氧诱导因子-1a(hypoxia induction factor-1a,HIF-1a)表达水平,探讨其与化疗疗效的相关性。
1 资料和方法
1.1 一般资料
选取我院2009年4月-2011年4月收治的非小细胞肺癌患者92例,按2003年第六版美国癌症联合委员会(American Joint Committee on Cancer,AJCC)对非小细胞肺癌的分期法[3]均为Ⅳ期,经支气管镜取组织病理确诊,入组前未行放疗及化疗。排除低氧性疾病,如慢性阻塞性肺病、肺心病、哮喘急性发作、呼吸衰竭等。其中男58例,女34例;年龄39~75岁,平均(55.8±6.2)岁;中鳞癌48例,腺癌38例,大细胞癌6例;肺内转移42例,肝脏转移22例,肾上腺转移12例,远处淋巴结转移12例,软组织转移4例。
1.2 方法
所有患者化疗采用吉西他滨联合顺铂的方案:吉西他滨1000 mg/m2,静脉滴注30~60 min,第l、8、15天;顺铂100 mg/m2,静脉滴注,30~60 min,每28 d重复。化疗期间常规给予水化和止吐治疗,并严密观测患者血常规,若白细胞降低至(1.0~2.0)×109/L和(或)血小板降低至(50~75)×109/L时,则将吉西他滨剂量减少25%。根据患者情况顺利给予6~8个疗程后判定疗效。
1.3 观察指标
采用免疫组化法检测患者非小细胞肺癌组织中HIF-1a的表达情况,鼠抗人HIF-1a单克隆抗体和免疫组化检测盒均购自福州迈新生物技术开发公司。以PBS代替一抗为阴性对照,已知阳性切片作为阳性对照,实验操作步骤严格按照试剂盒说明书进行。判定标准[4]:综合染色强度和阳性细胞数量进行评定:① 着色强度根据无着色、浅黄色、棕色、棕褐色分别为0~3分;② 阳性细胞数量:观察10个高倍镜视野(10×40倍)阳性细胞所占比例,≤5%为0分,6%~25%为1 分,26%~50% 为2分,51%~75%为3分,≥76%为4分。表达强度为两项计分乘积:阴性(-):0~1分,弱阳性(+):4~7分,阳性(++):5~8分,强阳性(+++):>8分。
1.4 疗效判定标准[5]
完全缓解(complete response,CR):所有病灶完全消失;部分缓解(partial response,PR):肿块缩小≥50%;稳定(stable disease,SD):肿块缩小<50%或增大<25%;进展(pmgressive disease,PD):一个或多个病灶增大≥25%或出现新的病变。
1.5 统计学处理
采用SPSS 13.0软件分析数据。计数资料采用χ2检验,P<0.05为差异有显著性意义。
2 结果
HIF-1a在NSCLC组织中主要表达于胞核,表现为程度不等的染色,呈黄色或棕黄色颗粒,胞质中偶有表达。92例患者中HIF-1a阳性54例,阳性表达率为58.70%,其中化疗有效率为40.74%,疾病控制率为77.78%;HIF-1a阴性38例,阳性表达率为41.30%,其中化疗有效率为42.11%,疾病控制率为73.68%。不同表达患者间化疗有效率和疾病控制率比较差异无统计学意义(表1)。
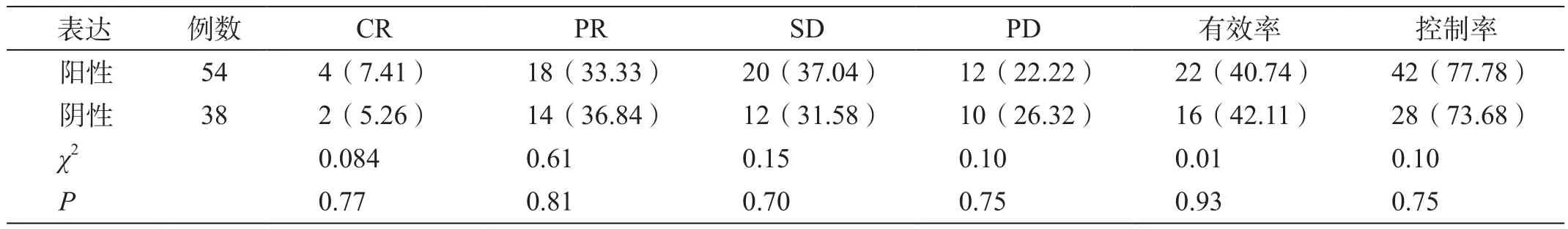
表1 HIF-1a在NSCLC组织中的表达[例(%)]
3 讨论
目前,晚期NSCLC患者的化疗药物与肿瘤细胞基因及细胞因子之间可发生相互作用,基因和各种细胞因子的表达情况与临床治疗疗效密切相关。乏氧是肿瘤细胞的基本特征,其可影响肿瘤细胞的生长、分裂、增生、增殖、转移以及对化疗、放疗的敏感性。其中造成对多种化疗药物耐药的机制为大多数抗癌药物主要作用于快速分裂相的细胞,而缺氧使肿瘤细胞停滞在G1期,对化疗药物不敏感[6]。此外缺氧增加细胞内参与解毒和药物代谢的酶类表达,加快化疗药物的代谢排出,从而降低了治疗效果。
HIF-1a是人体细胞内的一类介导缺氧适应性反应的转录因子,其结构中的氧依赖性降解结构域成为细胞对生长微环境中氧变化的灵敏感受器。HIF-1a可与核内的多种基因转录启动子上游的乏氧反应元件结合,其在维持肿瘤细胞的新血管生成、能量代谢、促进肿瘤增殖和转移中具有重要作用[7-8]。HIF-1a是瘤内乏氧的内源性标记物,正常细胞中HIF-1a被泛素化蛋白水解酶降解而保持较低的稳定浓度。当细胞处于乏氧状态时,HIF-1a泛素化降解过程减少导致其堆积在细胞浆,并进入细胞核与核内的多种基因转录的启动子上游的乏氧反应元件结合,表达迅速增强,促进肿瘤细胞的局部浸润转移、细胞过度和永久性增殖、细胞增殖周期比率改变、肿瘤新生血管的生成等,并因氧气与营养物质缺乏而使细胞抵抗凋亡[9-10]。相关研究证实,在NSCLC组织中,肿瘤迅速增殖引起的局部缺氧和抑癌基因突变均可能使肿瘤组织中的HIF-1a呈过度表达,而肿瘤组织内的基质细胞和邻近的正常组织则未见HIF-1α的表达[11-12]。HIF-1a表达预示肿瘤化疗抵抗,其诱导产物如血管内皮生长因子、碳酸纤酶、乳酸脱氢酶、等均直接与化疗抵抗相关[13]。
本研究结果显示,HIF-1a主要表达于肺癌细胞胞核及胞质,呈明显的异质性。但HIF-1a不同表达患者间化疗有效率和疾病控制率比较差异无统计学意义。由此表明,HIF-1a的表达状态与化疗近期疗效无明显相关性,尚不能确定为晚期NSCLC患者化疗疗效的预测因子。考虑与研究样本偏小有关,具体相关性尚有待于进一步探讨。
[1] She J, Yang P, Hong Q, et al. Lung cancer in China: challenges and interventions [J]. Chest, 2013, 143(4): 1117-1126.
[2] Furrukh M, Burney IA, Kumar S, et al.Improving outcomes in advanced lung cancer:maintenance therapy in non-smallcell lung carcinoma[J]. Sultan Qaboos Univ Med J, 2013, 13(1): 3-18.
[3] Pugh CW. Oxygen sensing in cancer[J]. Ann Med, 2003, 35(6): 380-390.
[4] 奚蕾, 沈伟生, 曹向明. 非小细胞肺癌患者化疗前后血清肿瘤标志物、HIF-1α、VEGF的变化及相关性研究[J]. 成都医学院学报, 2014, 9(2): 139-142.
[5] Park S, Ha SY, Cho HY, et al. Prognostic implications of hypoxia-in-ducible factor-1α in epidermal growth factor receptor-negative non-small cell lung cancer [J]. Lung Cancer, 2011, 72(1): 100-107.
[6] 赵航, 刘东屏. HIF-1α与实体性肿瘤发生及临床关系的研究进展[J]. 现代肿瘤医学, 2013, 21(9): 2134-2137.
[7] 谷依学, 李汉贤, 王汉群, 等. 缺氧诱导因子1α及血管内皮生长因子的表达与胃癌生物学行为的关系[J]. 南华大学学报(医学版), 2005, 33(1): 13-15.
[8] Singh-Gupta V, Joiner MC, Runyan L, et al. Soy isoflavones augment radiation effect by inhibiting APE1/Ref-1 DNA repair activity in non-small cell lung cancer [J]. J Thorac Oncol, 2011, 6(4): 688-698.
[9] Jackson AL, Zhou B, Kim WY. HIF, hypoxia and the role of angiogenesis in non-small cell lung cancer[J]. Expert Opin Ther Targets, 2010, 14(10): 1047-1057.
[10] Kuo WH, Shih CM, Lin CW, et al. Association of hypoxia inducible factor-1α polymorphisms with susceptibility to nonsmall-cell lung cancer[J]. Transl Res, 2012, 159(1): 42-50.
[11] 沈红, 崔进, 秦湧, 等. 晚期非小细胞肺癌患者化疗前后血清HIF-1α和VEGF的变化及临床意义[J]. 现代肿瘤医学, 2015, 23(6): 791-793.
[12] 夏冬平, 曾玉兰, 宋松林, 等. 非小细胞肺癌患者介入治疗前后血清HIF-1a、VEGF的变化及相关性研究[J]. 现代肿瘤医学, 2012, 20(6): 1201-1203.
Effect of HIF-1α expression on the chemotherapeutic sensitivity of patients with advanced non small cell lung cancer*
WANG Shengde1**, WEI Fenlan2
(1. Department of Oncology, Railway Branch, The People’s Hospital of Yingtan City, Jiangxi Province, Yingtan 335000, China;
2. Department of Oncology, The People’s Hospital of Yingtan City, Jiangxi Province, Yingtan 335000, China)
Objective: To investigate the effect of the expression of HIF-1a on the chemotherapeutic sensitivity of patients with advanced non-small cell lung cancer (NSCLC). Methods: Ninety-two cases of patients with advanced NSCLC chemotherapy in our hospital were selected. The expression of HIF-1a was detected by immunohistochemistry and the relationship between the expression of HIF-1a and the efficacy of chemotherapy was analyzed. Results: HIF-1a was mainly expressed in the cytoplasm and nucleus of lung cancer cells, and its expression showed significant heterogeneity. There was no significant difference in the effective rate and the disease control rate between patients with different expression (P>0.05). Conclusion: The status of HIF-1a expression was not correlated with the short-term efficacy of chemotherapy, and is not a predictor for the efficacy of chemotherapy in patients with advanced NSCLC.
hypoxia inducible factor-1a; non small cell lung cancer; chemotherapy; sensitivity
医药论坛
R730.23; R734.2
B
1006-1533(2015)17-0041-02
2015年江西省卫生计生委科技计划(项目编号:20151555)
**
王胜德,主治医师。研究方向:非小细胞癌。E-mail:wsd20021290@163.com
2015-04-26)

