胰岛素抵抗对2型糖尿病患者周围神经病变的影响
马丽辉
河北邯郸中心医院 邯郸 056001
流行病学文献显示[1],我国成年人糖尿病患病率近年来呈逐年增高趋势,患病率高达9.6%左右。糖尿病周围神经病变(DPN)是一种2型糖尿病(T2DM)最常见的微血管病变并发症,胰岛素抵抗作为2型糖尿病患者发病的中心环节,目前被认为与中枢性神经病变如阿尔兹海默症等密切相关[2],但对胰岛素抵抗程度与T2DM合并周围神经病变发病关系的研究方面报道较少。本研究通过分析T2DM患者餐前及OGTT后血糖及胰岛素的变化规律,探讨胰岛素抵抗对2型糖尿病患者周围神经病变的影响。
1 资料与方法
1.1 研究对象 选取2012-06—2014-06我院收治的2型糖尿病患者161例为研究对象,男90例,女71例;平均年龄(54.3±6.1)岁;糖尿病病程(9.5±2.0)a。排除标准:严重的肝肾功能障碍,自身免疫系统疾病、肿瘤、长期吸烟史及并发下肢动脉硬化性狭窄或者闭塞患者;按照是否合并周围神经病变将患者分为糖尿病周围神经病变组(DPN组,n=102)和非糖尿病周围神经病变组(NDPN组,n=59)。
1.2 诊断标准 (1)2型糖尿病诊断标准参照 WHO于1999年制定的糖尿病诊断标准,具体标准为:空腹血糖(FBG)≥7.0mmol/L,或糖耐量试验(OGTT )2h血糖>11.1mmol/L或随机血糖>11.1mmol/L,再依据病史、OGTT胰岛素分泌曲线以及酮症倾向判定T2DM;(2)DPN诊断依据周围神经病变的症状及体征,通过肌电图判断周围神经损害,同时排除非糖尿病因素造成的神经病变,如酗酒及药物造成的神经毒性作用、颈腰椎病变、脑梗死等。
1.3 研究方法
1.3.1 一般资料收集:包括患者年龄、性别、血压值、体质量、身高、臀围及腰围,计算患者体重指数(BMI)及腰臀比(WHR)。
1.3.2 实验室检测:所有入院的T2DM患者均接受口服糖耐量试验(OGTT);尿酸、总胆固醇 (TC)、血甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、血糖由日本产日立7170型全自动生化分析仪测定;糖化血红蛋白(HbAlc)应用PRIMUS公司生产的高压液相测定仪测定;血清C肽及胰岛素(IRI)由化学发光法测定。计算糖暴露指数(GEI)=(HbAlc)1/2×糖尿病病程;应用稳态模型姨岛素抵抗指数(HOMA-IR)表示患者空腹时胰岛素敏感性:HOMA-IR=空腹血糖×空腹胰岛素/22.5。应用Matsuda指数表示糖负荷后胰岛素敏感性。肌电图检查采用NDI-092肌电图仪(上海海神公司),周围神经损害判定标准为神经传导速度下降≥20%。
1.4 统计学方法 应用SPSS 17.0统计软件进行分析,计量资料以¯x±s表示,采用成组t检验处理;计数资料以率或构成比表示,采用χ2检验;糖尿病周围神经病变相关因素分析采用二分类非条件Logistic回归模型进行分析,P<0.05为差异有统计学意义。
2 结果
2.1 2组一般资料比较 DPN组年龄、糖尿病病程、HbA1c、LDL-C水平高于NDPN组,差异有统计学意义(P<0.05)。见表1。
2.2 2组OGTT结果比较 DPN组 Matsuda指数、HOMA-IR、空腹血糖及胰岛素水平[OGTT(0min)]高于 NDPN组(P<0.05),OGTT(120min)胰岛素水平显著低于 NDPN组(P<0.05)。见表2。
2.3 糖尿病周围神经病变相关因素的Logistic回归分析Logistic回归分析提示:年龄、空腹血糖、胰岛素水平、HOMA-IR、Matsuda指数与患者周围神经病变的发生呈正相关(P<0.05),而OGTT(120min)胰岛素水平与其呈负相关(P<0.05)。见表3。

表1 2组一般资料比较 (¯x±s)
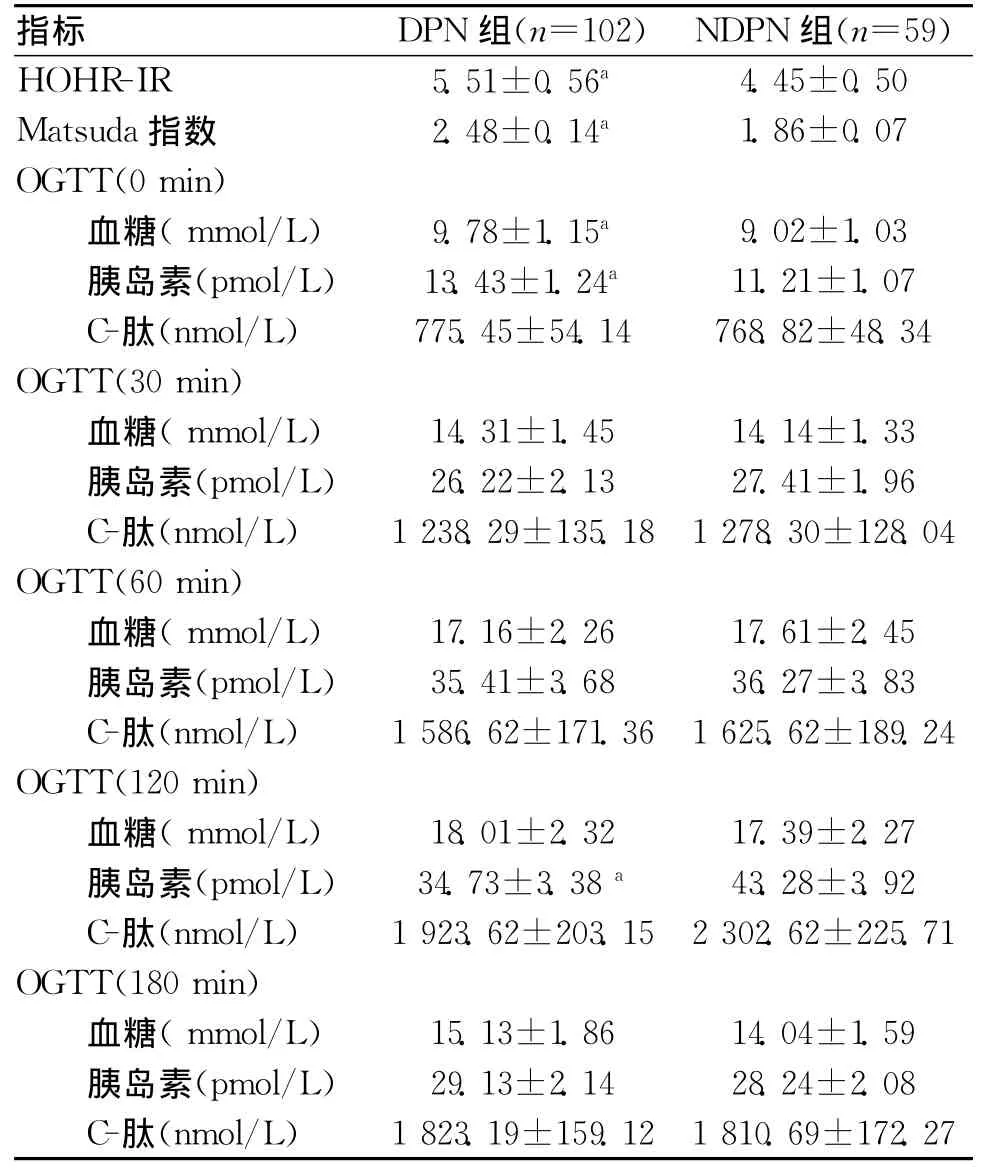
表2 2组OGTT结果比较 (¯x±s)
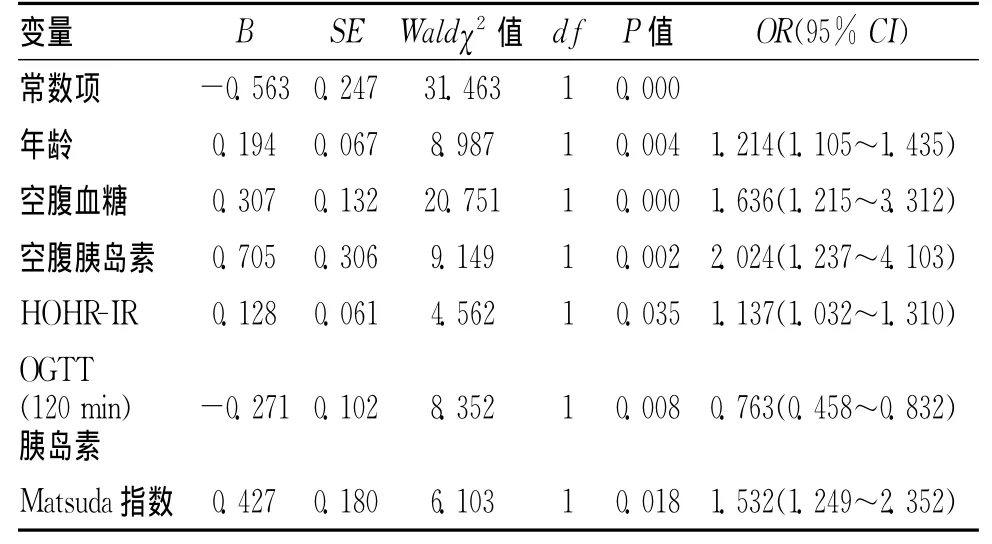
表3 糖尿病周围神经病变相关因素的Logistic回归分析
3 讨论
DPN是T2DM患者最常见的微血管病变并发症,目前国内外关于DPN发生率的报道有较大差异,上海华山医院曾于1980年进行的大样本流行病学调查显示,T2DM患者中DPN发生率接近90%左右,而在2010年上海市的流行病学调查显示发生率59.1%[3];周雁等[4]回顾性分析了1 069例年龄≥60岁的老年T2DM患者的临床资料,发现高达81.7%的老年患者合并有DPN;本研究中161例T2DM患者中DPN发生率为63.4%(102/161),各调查研究中DPN发生率存在较大差异的原因可能与病例来源不同(社区、门诊或住院部)以及病例年龄段、糖尿病病程、地域、诊断标准等因素造成。
本研究显示,DPN组FBG、FIRI水平[OGTT(0min)]、HOMA-IR高于NDPN组,且Logistic回归显示,FBG、FIRI及HOMA-IR均为T2DM患者发生DPN的独立预测因子,这与Lee等[5]报道基本一致。这些结果均提示T2DM患者的空腹胰岛素抵抗程度能够显著影响周围神经病变的发生。多年的研究已经证实,FBG与周围神经病变存在紧密联系,高水平FBG对周围神经造成的损害已经不言而喻[6]。而高胰岛素血症(HIS)引起的胰岛素抵抗(IR)能够造成周围血管舒张功能受损(由胰岛素介导的内皮细胞依赖的舒张功能),导致患者周围神经组织缺血缺氧进而形成神经损害;此外,HIS还能够诱发周围组织神经元细胞产生IR,可引起周围神经组织对高血糖的敏感性增强,进而导致DPN发生[7]。因此,降低FBG及FIRI,改善HOMA-IR对于预防T2DM患者发生周围神经病变至关重要,对于合并HIS引起的IR患者,建议临床尽早行DPN筛查工作。
本研究显示,DPN组OGTT(120min)胰岛素水平低于NDPN组,Matsuda指数却高于NDPN组,Logistic回归显示Matsuda指数与患者周围神经病变的发生呈正相关(P<0.05),OGTT(120min)胰岛素水平与其呈负相关(P<0.05),则提示患者餐后胰岛素抵抗则可能对周围神经病变的发生起到抑制作用。Matsuda指数可用来表示糖负荷后之后胰岛素的敏感性,数值大小与外周组织如骨骼肌及脂肪组织的胰岛素敏感性有关,该指数越低,则表示患者餐后胰岛素抵抗程度越高[8],这与反映空腹胰岛素抵抗程度且与肝脏胰岛素敏感性有关的HOMA-IR相反。出现这种情况的主要机制不甚明确,可能的原因在于胰岛素被证实能够调节神经纤维的分化及生长,在理论上是一种神经营养因子,能够起到对外周组织的神经元细胞起到营养支持作用[9]。Hoybergs等[10]报道显示,在痛性糖尿病合并DPN的患者中,胰岛素信号传导或胰岛素缺陷所导致的外周神经元营养障碍并非主要由高血糖引起。此外,Cusi等[11]在长期的胰岛素治疗中发现,虽然长期胰岛素治疗诱发的胰岛素抵抗可能造成S6K、p70及Akt等相关基因表达减少,但却不影响外周组织如脂肪组织及骨骼肌中的MAPK信号传导。这些均提示外周胰岛素可能主要发挥神经营养效应,因此,临床在降低肝脏胰岛素抵抗同时,可适时提升骨骼肌及脂肪组织的胰岛素水平,对于防治T2DM患者DPN的发生具有重要的临床价值。
综上所述,2型糖尿病患者空腹胰岛素抵抗与周围神经病变的发生密切相关,而患者餐后胰岛素抵抗则可能对周围神经病变的发生起到抑制作用。
[1] Yang WY,Lu JM,Weng JP,et al.Prevalence of diabetes among men and women in China[J].N Engl J Med,2010,362(12):1 090-1 101.
[2] Kira B,Feldman EL.Insulin resistance in the nervous system[J].Trends Endocrinol Metab,2012,23(3):133-141.
[3] Lu B,Yang ZH,Wang M,et al.High prevalence of diabetic neuropathy in population-based patients diagnosed with type 2diabetes in the Shanghai downtown[J].Diabetes Res Clin Pract,2010,88(3):289-294.
[4] 周雁,郭立新,周璐 .老年2型糖尿病患者周围神经病变的影响因素[J].山东大学学报(医学版),2012,22(6):1-4.
[5] Lee KO,Nam JS,Ahn CW,et al.Insulin resistance is independently associated with peripheral and autonomic neuropathy in korean type 2diabetic patients[J].Acta Diabetol,2012,49(2):97-106.
[6] 姜涛,宋秀霞,张敏 .波动性高血糖对2型糖尿病患者周围神经病变的影响[J].中国慢性病预防与控制,2010,11(1):54-56.
[7] Kim B,Mclean L'L,Philip SS,et al.Hyperinsulinemia induces insulin resistance in dorsal root ganglion neurons[J].Endocrinology,2011,152(10):3 638-3 647.
[8] Toth C,Brussee V,Martinez JA,et al.Rescue and regeneration of injured peripheral nerve axons by intrathecal insulin [J].Neuro-science,2009,139(2):429-449.
[9] Xu QG,Li XQ,Kotecha SA,et al.Insulin as an in vivo growth factor[J].Exp Neurol,2012,188(1):43-51.
[10] Hoybergs YM,Meert TF.The effect of low-dose insulin on mechanical sensitivity and allodynia in type 1diabetes neuropathy[J].Neurosci Lett,2010,417(2):149-154.
[11] Cusi K,Maezono K,Osman A,et al.Insulin resistance differentially affects the pi 3-kinase-and map kinase-mediated signaling in human muscle[J].J Clin Invest,2009,105(3):311-320.

