尼古丁对成牙本质细胞凋亡影响的实验研究
郭晓娟,袁 杰,王胜朝,余 擎,屈铁军
(1.平凉市人民医院口腔科,甘肃平凉744000;2.军事口腔医学国家重点实验室,陕西省口腔医学重点实验室,第四军医大学口腔医院:*口腔预防科,**牙体牙髓病科,陕西西安710032)
尼古丁是一种生物碱,无臭,味辛辣,为无色或灰黄色的油状液体。流行病学调查表明尼古丁是损害牙胚并导致牙齿发育异常的众多因素之一[1]。体外实验亦表明尼古丁能够显著抑制成牙本质细胞的增殖[2],而牙本质形成过程包括细胞分化、成牙本质细胞分泌细胞外基质和基质矿化等阶段,有多种外界因素和内在信号分子参与其中[3]。个体牙齿萌出后,受到外源刺激,可能出现局部成牙本质细胞的凋亡或者坏死,而牙髓组织中的未分化外胚间充质细胞和成纤维细胞会进一步分化为牙本质样细胞,然后通过不断地合成和分泌牙本质细胞外基质,生成修复性牙本质,从而促进基质矿化[4-5]。此过程一旦出现异常,就会导致牙本质形成缺陷或者矿化不良。因此,鉴于成牙本质细胞在牙齿发育和改建过程中的关键作用,研究尼古丁对其分化、发育乃至凋亡的作用机制具有重要意义。
本研究拟以永生化的成牙本质细胞MDPC-23为研究对象,分别进行不同浓度尼古丁刺激和SP600125作用,观察细胞形态变化,检测细胞凋亡相关蛋白Bcl-2、Bax、Caspase-3以及p-JNK等表达,以此探究尼古丁对小鼠成牙本质细胞凋亡的影响。
1 材料和方法
1.1 主要试剂和仪器
小鼠成牙本质样细胞系MDPC-23细胞(ATCC,美国);α-MEM 培养基、胎牛血清(Gibco,美国);Hoechst33258荧光染料、抗荧光淬灭封片液、HRP标记的山羊抗兔二抗、HRP标记的山羊抗鼠二抗(上海碧云天);细胞培养用盖玻片、载玻片(上海生工);BCA蛋白定量分析试剂盒(Thermo,美国);Bax兔多抗、Bcl-2鼠单抗、Caspase-3兔多抗(Upstate,美国);SP600125、鼠抗 β-actin、尼古丁(sigma,美国);抗p-JNK抗体(Cell Signaling Technology,美国);6孔板(Corning,美国);倒置相差显微镜、荧光显微镜(Olympus,日本)。
1.2 细胞培养
MDPC-23细胞用含100 mL/L胎牛血清、50 μg/mL 谷氨酰胺、100 IU/mL 青霉素、100 μg/mL链霉素和50 μg/mL抗坏血酸的α-MEM培养基,在37℃、50 mL/L CO2条件下进行培养。所有实验均取对数期细胞进行。所有含1、10、100 μg/mL等浓度尼古丁和SP600125的培养液均由含2 mL/L胎牛血清的α-MEM培养基配制。
1.3 Hoechst 33258染色检测细胞凋亡
将MDPC-23细胞以5×105/孔的密度接种于6孔板内的盖玻片上,24 h后,细胞换液,分为0、1、10、100 μg/mL 4个浓度尼古丁处理组,每组设3个重复。24 h后,弃去培养基,每孔加入1 mL Hoechst 33258染色液,10 min后吸去染液,无菌PBS洗3次×3 min。将各盖玻片分别倒扣于滴有抗荧光淬灭封片液的载玻片上,荧光显微镜下观察各组细胞形态,各选取5个视野进行拍照,计数并计算细胞凋亡率。
1.4 Western blot检测凋亡相关蛋白表达
将MDPC-23细胞以5×105/孔的密度接种于6孔板,24 h 后,细胞换液,分为 0、1、10、100 μg/mL 4个浓度尼古丁处理组。24 h后,收集细胞,加入RAPI细胞裂解液,提取全蛋白。经BCA定量后,上样、SDS-PAGE电泳、转膜、封闭、一抗、二抗孵育和ECL显影等步骤,检测各组细胞中凋亡相关蛋白Bcl-2、Bax、Caspase-3和β-actin等的表达水平。
1.5 Western blot检测p-JNK和Caspase-3表达
将MDPC-23细胞以5×105/孔的密度接种于6孔板,24 h后进行无血清培养。12 h后,细胞换液,分为0、1、10、100 μg/mL 4 个浓度尼古丁处理组。各浓度组分别设 45、60、90、180 min各时间点。另设尼古丁和JNK抑制剂SP600125共同作用组,无血清培养12 h后,依次加入10 μmol/L SP600125 孵育1 h,10 μg/mL 尼古丁处理 90 min。分别收集细胞,制备全蛋白裂解液,Western blot分别检测p-JNK、Caspase-3和β-actin等蛋白表达。
1.6 统计学分析
采用SPSS 13.0统计软件对各组测定数值的均值进行单因素方差分析,并进行各实验组与对照组之间的比较,结果以均数±标准差表示,检验水准α=0.05。
2 结果
2.1 尼古丁刺激促进细胞发生凋亡
荧光显微镜观察显示,对照组MDPC-23细胞为正常生长状态,细胞核呈圆形,染色质分布均匀,核边界清晰规则;0、1、10、100 μg/mL 尼古丁处理24 h后,部分细胞表现出典型的凋亡形态学特征,核边界模糊,细胞核致密浓缩,不均匀,有碎块(图1)。随着尼古丁浓度增加,细胞凋亡现象越来越明显,凋亡细胞数目和凋亡率均呈明显上升趋势(P<0.05)(图2)。

图1 各尼古丁浓度组细胞凋亡形态变化(荧光染色,×400)

图2 各组细胞凋亡率比较
2.2 尼古丁刺激对MDPC-23细胞中凋亡相关蛋白Bcl-2、Bax和Caspase-3表达水平的影响
Western blot结果显示,与对照组MDPC-23细胞相比,不同浓度尼古丁处理组细胞Bcl-2表达显著下调,Bax、Caspase-3表达显著上调(P<0.05)(图3)。而且随着尼古丁浓度增加,Bcl-2表达的下调和Bax、Caspase-3表达的上调均呈现一定的浓度依赖性。
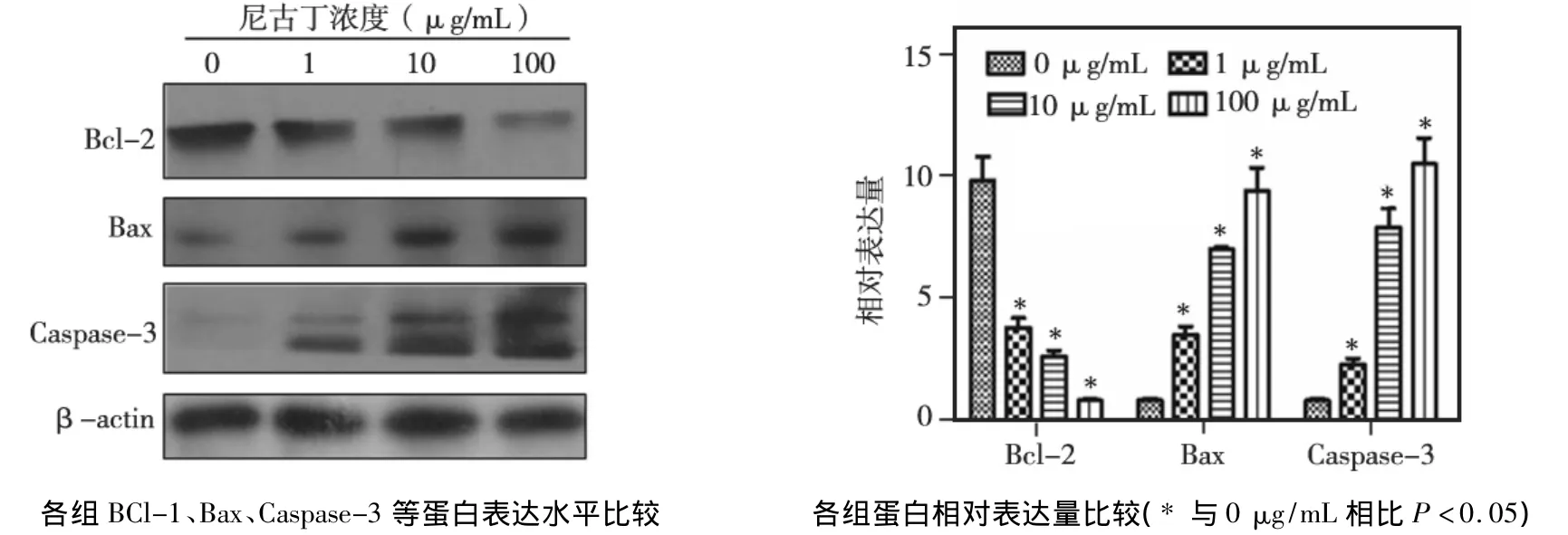
图3 Western blot检测细胞凋亡相关蛋白表达水平
2.3 尼古丁对MDPC-23细胞中p-JNK表达水平及其抑制剂SP600125对Caspase-3表达水平的影响
Western blot结果显示,与对照组相比,随着尼古丁浓度和作用时间的增加,p-JNK表达逐渐增强(图4)。除1 μg/mL尼古丁刺激45 min组外,其他各处理组与对照组的p-JNK表达比较均有统计学差异(P<0.05)。此外,与单独尼古丁作用组相比,10 μg/mL尼古丁和JNK抑制剂SP600125共同作用组的Caspase-3表达明显下调(P<0.05)(图4)。

图4 Western blot检测p-JNK和Caspase-3表达水平
3 讨论
细胞凋亡是细胞主动有序的生理性死亡过程,发生在生命个体的各个阶段,作用在于维持机体内环境的稳定性。研究表明,抗凋亡作用的Bcl-2基因和促凋亡作用的Bax基因主要通过二者表达量的比值Bcl-2/Bax来调控细胞凋亡进程;Caspase-3是Caspase家族中最为重要的成员之一,在细胞凋亡中发挥着重要作用,Caspase-3一旦被激活,细胞凋亡的发生将不可避免[6]。而若凋亡失控,则易引起多种疾病的发生。本实验发现,1~100 μg/mL不同浓度尼古丁作用下,Bcl-2表达显著下调,Bax、Caspase-3表达显著上调,促进了MDPC-23细胞的凋亡,与Hoechst33258染色所观察到的细胞形态发生明显凋亡变化的现象一致。
成牙本质细胞作为牙髓和牙本质复合体的连接纽带,其细胞突起深入至牙本质中,是牙髓内最早接触外来刺激的细胞。在外界刺激引起的龋病、牙髓病变过程中,成牙本质细胞亦被认为是最先受到损伤影响的细胞群[7],与牙髓细胞启动修复反应并形成修复性牙本质密切相关。此外,烟草严重危害健康,大量临床资料表明,吸烟与胃炎、心梗、哮喘、高血压、气管炎、中枢系统疾病以及癌症等许多疾病的发生发展密切相关[8],而尼古丁作为烟草毒性物质的主要成分,对牙周组织的损害已为国内外大多数学者所认可[1,9-11],但对其具体生理机制的研究尚有许多不确定之处。
正常人吸烟后血浆中的尼古丁含量约22.6~73 ng/mL[12],为此,本实验将尼古丁浓度设定为0、1、10、100 μg/mL,该浓度范围远大于上述血浆中的含量,但作用时间设为24 h,旨在探讨尼古丁对细胞毒性作用的剂量依赖关系。有资料显示,100 μg/mL尼古丁能够显著抑制成牙本质细胞的增殖[2],并且尼古丁损害牙齿发育的信号传导机制可能主要通过不同尼古丁型乙酰胆碱受体nAchR介导,经由该跨膜五聚体离子通道受体,启始胞内信号传递。目前已发现的下游尼古丁相关信号通路有Ca2+、MAPK途径(ERK、p38和JNK/SAPK)、AKT和线粒体途径等,这些通路或抗凋亡,或促凋亡,均与细胞凋亡相关。其中JNK,即c-JNK氨基末端激酶,又称应急活化蛋白激酶(SAPK),一般作为促凋亡信号通路的一部分;JNK通路激活会启动细胞凋亡,而特异性阻断JNK激活,可表现出抑制细胞凋亡的保护性反应。本实验亦发现,1~100 μg/mL不同浓度尼古丁作用下,该MDPC-23细胞的JNK磷酸化水平在一定时间段(45~180 min)内呈浓度依赖性增强,促进MDPC-23细胞的凋亡,而JNK抑制剂则可一定程度上阻断该细胞的凋亡发生。
综上所述,本研究通过不同浓度的尼古丁刺激和JNK抑制剂作用,检测了成牙本质细胞MDPC-23的形态变化、凋亡相关蛋白Bcl-2、Bax、Caspase-3以及p-JNK的表达,发现尼古丁刺激可显著促进MDPC-23细胞凋亡。该结果表明,若生物个体长时间被动或者主动吸烟,烟草中毒性物质的主要成分尼古丁可能诱使口腔内的成牙本质细胞发生凋亡,并影响牙胚的发育[1],特别是切牙的形成[9]、严重时会致畸[13],甚至出现龋齿病状[14],导致牙齿发育异常,与相关文献报道一致。
在牙髓生物学领域,尼古丁对牙周膜成纤维细胞和牙龈成纤维细胞影响的调控作用已得到公认[10-11],但是尼古丁对成牙本质细胞影响的相关研究还比较少。本实验初步探究了尼古丁对成牙本质细胞凋亡的影响,而对尼古丁调控成牙本质细胞的复杂作用及成牙本质细胞凋亡发生的分子调控机制仍需要进一步的深入研究。
[1]Saad AY,Gartner LP,Hiatt JL.Teratogenic effects of nicotine on first molar odontogenesis in the mouse[J].Acta Morphol Hung,1991,39(2):87-96.
[2]吴礼安,文玲英,杨富生,等.尼古丁抑制成牙本质细胞增殖及作用机制的研究[J].华西口腔医学杂志,2008,26(2):186-188.
[3]梅丽琴,石四箴.牙本质形成的研究进展[J].牙体牙髓牙周病学杂志,2004,27(7):534-536.
[4]Bleicher F.Odontoblast physiology [J].Exp Cell Res,2014,325(2):65-71.
[5]Mjor IA,Sveen OB,Heyeraas KJ.Pulp-dentin biology in restorative dentistry.Part 1:normal structure and physiology[J].Quintessence Int,2001,32(6):427-446.
[6]Kim SY,Kang KL,Lee JC,et al.Nicotinic acetylcholine receptor α7 and β4 subunits contribute nicotine-induced apoptosis in periodontal ligament stem cells[J].Mol Cells,2012,33(4):343-350.
[7]Magloire H,Couble ML,Thivichon-Prince B,et al.Odontoblast:a mechano-sensory cell[J].J Exp Zool B Mol Dev Evol,2009,312B(5):416-424.
[8]Sasaki J.Compounds in tobacco smoke and pathogenesis of the diseases[J].Nihon Rinsho,2013,71(3):383-389.
[9]Gartner LP,Saad AY,Hiatt JL.Effects of nicotine on murine incisor development[J].J Biol Buccale,1990,18(2):83-88.
[10]Kang SW,Park HJ,Ban JY,et al.Effects of nicotine on apoptosis in human gingival fibroblasts[J].Arch Oral Biol,2011,56(10):1091-1097.
[11]Wang XJ,Liu YF,Wang QY,et al.Functional expression of alpha 7 nicotinic acetylcholine receptors in human periodontal ligament fibroblasts and rat periodontal tissues[J].Cell Tissue Res,2010,340(2):347-355.
[12]Ebert RV,McNabb ME,Snow SL.Effect of nicotine chewing gum on plasma nicotine levels of cigarette smokers[J].Clin Pharmacol Therapeutics,1984,35(4):495-498.
[13]Sodagar A,Donyavi Z,Arab S,et al.Effect of nicotine on orthodontic tooth movement in rats[J].Am J Orthod Dentofacial Orthop,2011,139(3):e261-e265.
[14]Huang R,Li M,Gregory RL.Effect of nicotine on growth and metabolism of Streptococcus mutans[J].Eur J Oral Sci,2012,120(4):319-325.

