橄榄苦苷对IL-1β诱导的大鼠软骨细胞损伤的作用及机制研究*
戴 兵, 徐 俐, 金海东, 蔡宁宇, 陈 辉, 李 斌, 蔡建武, 潘 骏△
(1浙江中医药大学附属温州中医院,2温州医科大学附属第二医院骨科,浙江温州325027)
骨关节炎(osteoarthritis,OA)是一种以局灶性关节软骨退行性病变、骨丢失、关节边缘骨赘形成及关节畸形和软骨下骨质硬化为特征的慢性关节疾病,多见于中老年人,女性多于男性。当今尚未发现治疗骨关节炎的满意治疗方法,一般都是仅仅给予对症治疗,临床上应用最多的非甾体类抗炎药(nonsteroidal anti-inflammatory drugs,NSAIDs)又常引起胃肠消化道出血以及心血管等诸多方面的副作用。研究报道天然植物化学物质由于其安全、有效、经济、副作用小而具有远大的应用前景,为治疗炎症如OA等,提供了新的方向[1]。国内外流行病学研究发现,以食用橄榄油为主的人群,乳腺癌、胃癌、肠癌和及慢性炎症疾病的发病率很低[2]。橄榄油存在大量酚类化合物,如橄榄苦苷(oleuropein,OL),因为其具有降低血糖,减少动脉粥样硬化[3]以及抗炎作用[4]引起相当大的关注。一些研究还表明,橄榄油酚类化合物具有强大的抗氧化活性[5]和防止氧介导的细胞损伤反应的作用[6]。在这些前人研究的基础上,本研究通过研究橄榄苦苷对IL-1β诱导的大鼠关节软骨细胞的影响,探讨橄榄苦苷对关节软骨的保护机制。
材料和方法
1 动物和材料
健康雄性2周龄SD大鼠8只,购自温州医科大学实验动物中心,有关动物实验的相关内容通过了温州医科大学伦理委员会的审批。
橄榄苦苷购自Sigma;DMEM和胎牛血清购自Gibco;抗生素和抗真菌剂溶液购自Life Technologies;抗 COX2、p65、p-p65、IκBα 和 p-IκBα 抗体购自CST;抗iNOS和GAPDH抗体购自Bioworld Technology;NO试剂盒购自南京建成生物工程研究所;PGE-2 ELISA试剂盒购自R&D。所用引物由上海生工合成,引物序列见表1。
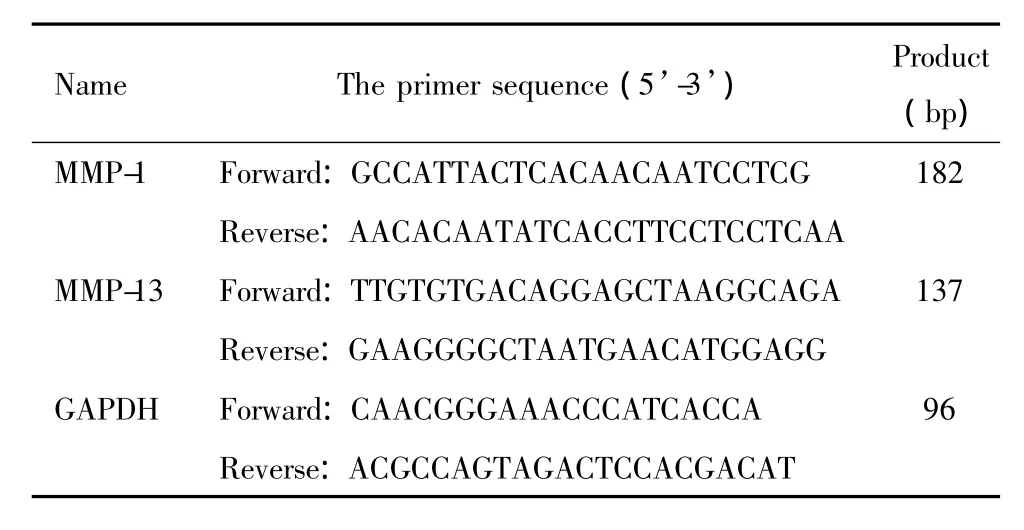
表1 引物序列Table 1.The sequences of the primers
2 方法
2.1 大鼠关节软骨细胞的分离培养 无菌操作下分离2周龄SD大鼠膝关节的软骨,剔除周围组织,将软骨块剪成约1 mm×1 mm×1 mm大小;选用酶2步消化法获得软骨细胞,加入含10% 胎牛血清、1%双抗的DMEM培养基吹打混匀后移入25 cm2培养瓶内,置37℃、5%CO2、饱和湿度培养箱内培养,以后每3~4 d更换培养基,待细胞铺满瓶底80%以上,0.25%胰酶/0.1%EDTA 消化细胞,1 000 r/min离心5 min,按1∶3传代培养。
2.2 蛋白多糖和Ⅱ型胶原的检测 取第3代细胞,制成细胞爬片,待细胞长至70% ~80%,4%多聚甲醛固定30 min,PBS冲洗。室温1%阿尔新兰溶液染色40 min,双蒸水冲洗,自然干燥,中性树胶封片,显微镜下观察细胞内蛋白多糖的表达情况。
另取细胞爬片于3%H2O2中室温孵育10 min,消除内源性过氧化物酶活性,PBS冲洗;正常山羊血清工作液封闭,室温孵育20 min,PBS冲洗;滴加I抗(1∶100稀释)4℃孵育过夜,PBS冲洗;滴加 II抗工作液,37℃湿盒中孵育30 min,PBS冲洗;滴加DAB显色1 min,PBS冲洗;苏木素复染,流水冲洗30 min;封片,镜下观察Ⅱ型胶原的显色情况。
2.3 橄榄苦苷对大鼠软骨细胞活性的影响 取生长良好的第3代软骨细胞,接种于96孔培养板,将培养板置于5%CO2培养箱;细胞培养3 d后,吸弃培养基,分别加入含药物的 DMEM培养基(不含胎牛血清)200 μL,药物的最终浓度分别为0 μmol/L、10 μmol/L、50 μmol/L 和 100 μmol/L。培养 24 h后,小心吸去上清,按照说明书每孔加入CCK-8溶液10 μL,37℃避光孵育1 h。酶标仪上测定样本450 nm的光吸收值(A)。计算每种药物浓度组光吸收值的平均值,分别与空白对照组比较。
2.4 实验分组 取第3代原代软骨细胞进行实验,实验设空白对照(control)组(只加培养基)、IL-1β组(IL-1β 10 μg/L)、IL-1β +OL 组(其中,IL-1β 浓度为10 μg/L,橄榄苦苷分别为 10、50、100 μmol/L)。
2.5 细胞上清液中一氧化氮(nitric oxide,NO)和前列腺素E2(prostaglandin E2,PGE2)含量的测定 各组细胞加入不同剂量的橄榄苦苷干预2 h后加入IL-1β。将培养板置于37℃、5%C02培养箱。培养24 h后提取细胞培养孔内的上清液,4℃、2 000 r/min离心5 min去除细胞碎片,轻轻吸取上清液,按照说明书在550 nm和0.5 cm光径下测紫外分光光度计下各管吸光度值。NO含量=(测定管A值-空白管A值)/(标准管A值-空白管A值)×标准品浓度×样品测试前稀释倍数。
设置样本组和标准品组,标准品孔各加50 μL不同梯度的标准品溶液;样品组加10 μL上清液和40 μL稀释液;样本组和标准品组均加入辣根过氧化物酶标记的检测抗体100 μL,封板膜封板,37℃恒温1 h;弃去上清液,加洗涤液洗涤,加入底物 A、B各 50 μL,37 ℃恒温避光15 min;加入终止液50 μL/well,450 nm处测定A值。根据标准品求出标准方程,然后计算各组PGE2含量。
2.6 橄榄苦苷对软骨细胞基质金属蛋白酶(matrix metalloproteinase,MMP)-1和 MMP-13表达的影响 收集各组细胞,总RNA抽提按TRIzol试剂说明书操作,分光光度计测量RNA的纯度及浓度,使用RevertAid First Strand cDNA Synthesis Kit逆转录为cDNA,采用SYBR Green染色法,以各组cDNA为模板,加入缓冲液、引物等进行PCR,各样本重复3次。反应条件如下:95℃ 2 min;95℃ 10 s,60℃ 20 s,72℃20 s,循环40 次。
2.7 橄榄苦苷对经IL-1β诱导的SD大鼠软骨细胞环氧化酶2(cyclooxygenase 2,COX2)、诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)及核因子 κB(nuclear factor κB,NF-κB)通路蛋白的影响冷的PBS洗涤细胞2遍,冰上裂解细胞、离心并收集上清后行蛋白定量,采用10%SDS-PAGE。蛋白分离后经恒流电转移到PVDF膜后,使用含5%脱脂牛奶的封闭液室温封闭1 h,与β2M抗体4℃孵育过夜后,次日加入II抗室温孵育1h,TBST洗膜3次,取出膜后加入ECL发光液,移入凝胶成像分析仪中,化学光敏模式曝光显影。
3 统计学处理
采用SPSS 18.0进行统计分析。数据以均数±标准差(mean±SD)表示,3组以上的组间差异采用单因素方差分析(one-way ANOVA),组间两两比较采用最小显著性差异法(LSD法),以P<0.05为差异有统计学意义。
结 果
1 软骨细胞的鉴定
显微镜下见软骨细胞贴壁生长,呈现三角形或不规则多角形。软骨细胞经过阿尔新蓝染色后,可见蛋白多糖蓝色颗粒。在Ⅱ型胶原免疫组织化学染色实验中,细胞质呈黄色,细胞核呈紫色,见图1。
2 各浓度药物对细胞活性的作用
在本研究所采用的药物浓度范围内,3种药物浓度对软骨细胞的活性均无明显抑制作用,与对照组相比差异不显著,见图2。

Figure 1.A:alcian blue staining(×100);B:type II collagen immunohistochemical staining(×40).图1 软骨细胞的鉴定
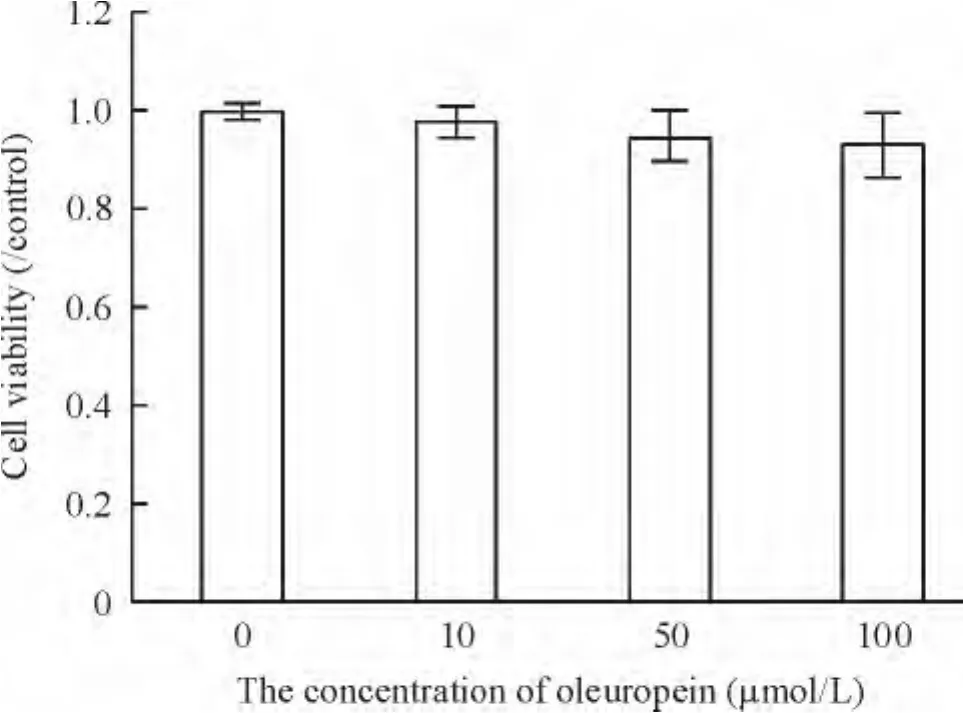
Figure 2.The effect of oleuropein on the cell viability in the chondrocytes was assessed by CCK-8 assay.Mean ±SD.n=3.图2 橄榄苦苷对软骨细胞活性的影响
3 橄榄苦苷对IL-1β诱导的软骨细胞NO和PGE2的影响
大鼠关节软骨细胞橄榄苦苷(0、10、50或100 μmol/L)预处理2 h 后,加入IL-1β(10 μg/L)刺激24 h,与无IL-1β刺激的对照组相比,NO和PGE2均有显著增加(P<0.01)。橄榄苦苷以浓度梯度依赖的方式抑制 IL-1β刺激引起的 PGE2的升高(P<0.05)。此外,橄榄苦苷还能以浓度依赖方式抑制IL-1β刺激引起的NO的升高(P<0.05),见图3。
4 橄榄苦苷对IL-1β诱导的软骨细胞基质金属蛋白酶的影响
IL-1β作用下,与对照组相比,MMP-1和MMP-13 mRNA的表达量增加(P<0.05)。橄榄苦苷预处理后,显著抑制MMP-1和MMP-13在mRNA水平的表达且浓度越高抑制效果越显著,不同浓度的橄榄苦苷组间具有明显差异(P<0.05),见图4。
5 橄榄苦苷对IL-1β诱导的软骨细胞COX-2和iNOS蛋白表达的影响
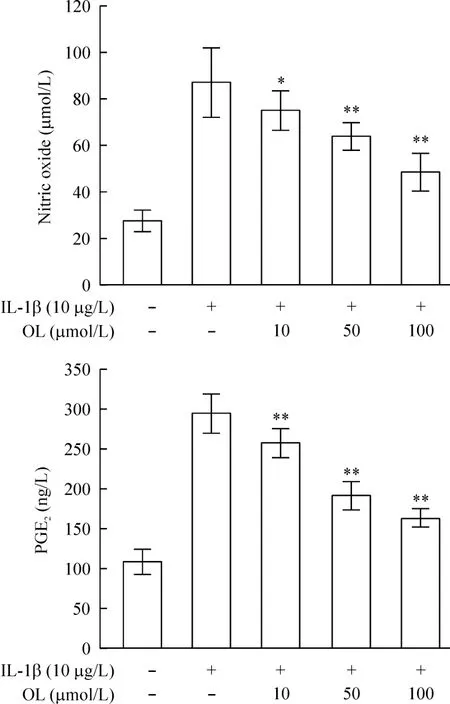
Figure 3.The effect of oleuropein(OL)on NO and PGE2productions in the chondrocytes with different treatments.Mean±SD.n=3.*P <0.05,**P <0.01 vs control group.图3 橄榄苦苷对NO和PGE2的影响
COX-2和iNOS蛋白的表达通过Western blotting测定,结果如图显示,IL-1β可以促进软骨细胞合成COX-2和iNOS,而橄榄苦苷可以抑制COX-2和iNOS蛋白表达的上调,见图5。
6 橄榄苦苷抑制NF-κB的激活
NF-κB的通路活化在炎症的发生发展过程中发挥主要作用,可以上调 COX-2和iNOS的表达。IL-1β刺激后,可以激活NF-κB信号通路,磷酸化并降解IκBα。同时,我们发现NF-κB p65亚基在细胞核中表达增加而在细胞质表达下降。相反,预处理橄榄苦苷(10、50、100 μmol/L)后可以抑制 IκBα 磷酸化和p65亚基从细胞质迁移到细胞核,见图6。
讨 论
白细胞介素(interleukin,IL)是由白细胞分泌的一类调节细胞生长与分化的因子,家族十分庞大,如今己被发现并命名的就高达33种。现在己知的和软骨损伤有关的白细胞介素因子有IL-1、IL-2、IL-6、IL-8、IL-12、IL-17 等,其中的 IL-1 的亚型 IL-1β是最基本的因素。已有证据表明,IL-1β能够影响关节软骨细胞的基质的合成,在整个OA病变中发挥的重要作用[7]。IL-1β是一种主要的关节组织结构退变的代谢调节因子[8],与软骨破裂,基质降解密切相关。它可以上调iNOS、COX-2、PGE2和 IL-6等炎症因子和软骨退变相关基因的表达[9]。
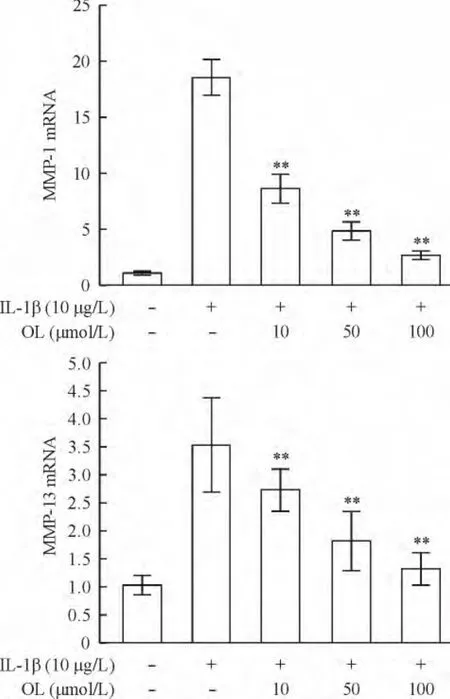
Figure 4.The mRNA expression of MMP-1 and MMP-13 in the chondrocytes with different treatments determined by real-time PCR analysis.Mean ± SD.n=3.**P <0.01 vs control group.图4 MMP-1和MMP-13的real-time PCR检测结果
IL-1β可以激活NO和PGE2的生成和释放,导致一系列细胞因子的变化,引起OA的发生发展,是促成骨关节病一个关键的原因[10]。NO是一种短期效应的信号分子,它可以诱导细胞凋亡,还能强烈地抑制软骨细胞合成蛋白聚糖,使软骨的胞外基质结构解离,无法维持正常的形态和功能。目前,已经确定的NOS有神经元型NOS(neuronal NOS,nNOS)、内皮型NOS(endothelial NOS,eNOS)和iNOS 3种。iNOS是NOS的诱导型,在关节软骨中起作用的主要是iNOS,它容易被激活产生大量的NO而造成关节软骨的损伤。研究表明在OA发生发展过程中,iNOS对NO的合成及其生物功能的发挥具有重要意义,体外实验中NO、iNOS在骨关节液、血清中均有明显表达,关节液、血清中NO、iNOS水平显著高于正常组[11],多项研究表明使用iNOS抑制剂能明显减轻OA软骨的损伤程度[12-13].在本研究中,我们证明了橄榄苦苷能有效抑制关节炎软骨细胞NO的产生及iNOS在蛋白水平的表达,这与Zhang等[14]的研究结果一致。
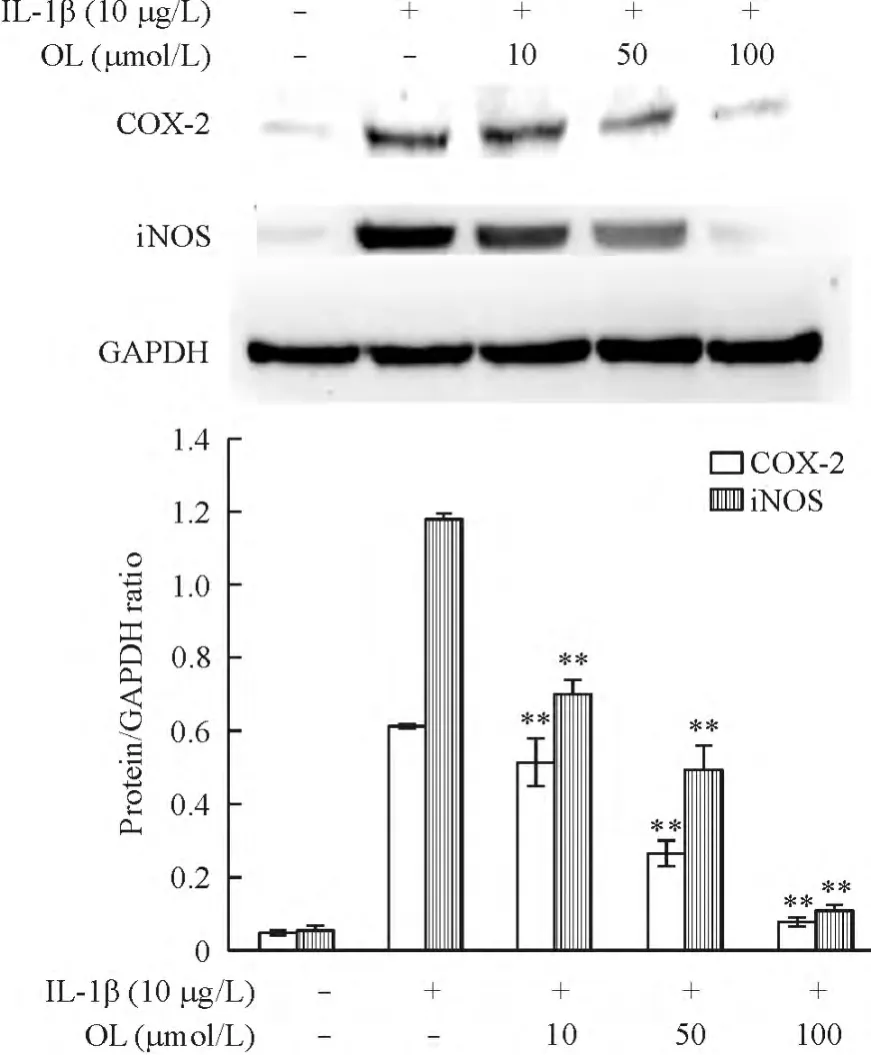
Figure 5.The protein expression of COX-2 and iNOS in the chondrocytes with different treatments determined by Western blotting.Mean±SD.n=3.**P <0.01 vs control group.图5 COX-2和iNOS的Western blotting结果
IL-1β促进滑膜细胞、软骨细胞合成并释放的PGE2和胶原酶产生强大的促炎症作用[15]。前列腺素在化学本质上是一种脂肪酸,是由COXs合成的前列素类化合物,COX-2是最可能引起关节炎中PGE2水平上升的相关酶类[16]。在生理功能上PGE2可以是一种炎症介质或是一种局部激素,引起滑膜炎症和骨的吸收。PGE2含量的改变将导致关节间的多种组织的基质合成发生改变。特别是促进骨吸收的作用最强,可激活破骨细胞,破坏骨与软骨,且可激惹血管新生,在关节炎病理及关节破坏中起重要作用。本研究发现大鼠关节软骨细胞体外培养过程中,加入IL-1β的细胞上清液中PGE2的浓度明显高于对照组,提示IL-1β能够明显提高PGE2的含量,加重对软骨细胞的损害。再次证实IL-1β在OA软骨细胞的破坏、OA的炎症反应产生PGE2的过程中起了重要作用。同时,橄榄苦苷能以浓度依赖方式减少IL-1β刺激引起的PGE2的升高以及COX-2在蛋白水平的表达。

Figure 6.The effect of oleuropein on the protein levels of the molecules in the NF-κB signaling pathway in the chondrocytes with different treatments.Mean±SD.n=3.**P <0.01 vs control group.图6 NF-κB通路相关蛋白Western blotting结果
IL-1β可引起胶原酶、明胶酶、基质溶解素等各种MMP的酶原合成、分泌及其活性增加,导致软骨基质降解来实现对关节软骨细胞分解代谢的影响[17-19],尤其是增加 MMP-1和 MMP-13等的合成,打破了基质金属蛋白酶-金属蛋白酶组织抑制剂(tissue inhibitors of metalloproteinases,TIMPs)的平衡,从而促进基质大分子降解[20-21]。本研究用10 μg/L IL-1β诱导,通过real-time PCR技术检测发现MMP-1和MMP-13的表达量明显增加。在此基础上,将橄榄苦苷作用于 IL-1β诱导的软骨细胞,发现 MMP-1、MMP-3和MMP-13的表达量明显下降,揭示了橄榄苦苷对OA软骨细胞的保护作用。
NF-κB 在炎症过程中发挥重要作用[22]。NF-κB通过调控多种基因的表达,参与免疫反应、炎症反应、细胞凋亡、肿瘤发生与转移等多种生物进程。大量研究表明,IL-1β诱导软骨细胞炎症介质的表达是通过NF-κB来介导的,在静息状态下,IκBα 与 NF-κB的p65、p50两个亚单位以失活状态存在于细胞质中。当上游信号(通常是由MyD88介导的TLR4/NF-κB 信号通路)激活IκB 激酶后,活化的 IκB 激酶会泛素化、磷酸化并降解 IκBα,使得NF-κB 2个亚单位从失活状态活化,并从细胞质转移到细胞核内(尤其是p65亚单位),与相应的炎症相关基因结合,启动炎症细胞因子转录,诱发炎症,包括iNOS和COX-2[23-25]。本研究结果发现橄榄苦苷可以抑制因IL-1β诱导而引起的IκBα的降解。据此,我们推测橄榄苦苷通过调节NF-κB信号通路而产生抗炎作用。由于橄榄苦苷对体外软骨细胞作用的结果不能完全代表体内,在动物模型中是否有同样的效果仍需要进一步的验证。
[1] Kim KS,Oh da H,Choi HM,et al.Pyrrolidine dithiocarbamate, a NF-κB inhibitor, upregulates MMP-1 and MMP-13 in IL-1beta-stimulated rheumatoid arthritis fibroblast-like synoviocytes[J].Eur J Pharmacol,2009,613(1-3):167-175.
[2] Menendez JA,Vazquez-Martin A,Colomer R,et al.Olive oil’s bitter principle reverses acquired autoresistance to trastuzumab(Herceptin)in HER2-overexpressing breast cancer cells.[J].BMC Cancer,2007,7:80.
[3] Miles EA,Zoubouli P,Calder PC.Differential anti-inflammatory effects of phenolic compounds from extra virgin olive oil identified in human whole blood cultures[J].Nutrition,2005,21(3):389-394.
[4] Covas MI.Bioactive effects of olive oil phenolic compounds in humans:reduction of heart disease factors and oxidative damage[J].Inflammopharmacology,2008,16(5):216-218.
[5] Vissers MN,Zock PL,Katan MB.Bioavailability and antioxidant effects of olive oil phenols in humans:a review[J].Eur J Clin Nutr,2004,58(6):955-965.
[6] Salvini S,Sera F,Caruso D,et al.Daily consumption of a high-phenol extravirgin olive oil reduces oxidative DNA damage in postmenopausal women[J].Br J Nutr,2006,95(4):742-751.
[7] Daheshia M,Yao JQ.The interleukin 1beta pathway in the pathogenesis of osteoarthritis[J].J Rheumatol,2008,35(12):2306-2312.
[8] Martel-Pelletier J.Pathophysiology of osteoarthritis[J].Osteoarthritis Cartilage,1998,6(2):374-375.
[9] Shalom-Barak T,Quaeh J,Lotz M.Interleukin-17-induced gene expression in articular chondrocytes is associated with activation of mitogen-activated protein kinases and NF-κB[J].J Biol Chem,1998,273(42):27467-27473.
[10] Hashimoto S,Takahashi K,Oehs RL,et al.Nitric oxide produetion and apoptosis in cells of the meniscus during experimental osteoarthritis[J].Arthritis Rheum,1999,42(5):2123-2131.
[11] 李 锋,聂喜增,马湘毅.`骨性关节炎患者血清和关节液中自由基水平及意义[J].河北医药,2007,29(l):36-37.
[12] 童 敏,高 戈,高洁生,等.白黎芦醇甲基化衍生物对兔骨关节炎模型关节液及血清NO和iNOS水平的影响[J].湖南中医药大学学报,2007,27(5):44-46.
[13] 刘世清,何炳书,彭 昊,等.四环素对骨关节炎模型关节液及血液中iNOS和NO水平的影响[J].武汉大学学报:医学版,2004,25(3):299-301.
[14] Zhang X,Cao J,Zhong L.Hydroxytyrosol inhibits pro-inflammatory cytokines,iNOS,and COX-2 expression in human monocytic cells[J].Naunyn Schmiedebergs Arch Pharmacol,2009,379(6):581-586.
[15] Pelletier JP,DiBattista JA,Roughley P,et al.Cytokines and inflammation in cartilage degradation[J].Rheum Dis Clin North Am,1993,19(3):545-568.
[16] Meulenbelt I,Bijkerk C,Miedema HS,et al.A genetic association study of the IGF-1 gene and radiological osteoarthritis in a population-based cohort study(the Rotterdam Study)[J].Ann Rheum Dis,1998,57(6):371-374.
[17] Hart DJ,Spector TD.The classification and assessment of osteoarthritis[J].Baillieres Clin Rheumatol,1995,9(2):407-432.
[18] Iannone F,Lapadula G.The pathophysiology of osteoarthritis[J].Aging Clin Exp Res,2003,15(5):364-372.
[19] Fell HB,Jubb RW.The effect of synovial tissue on the breakdown of articular cartilage in organ culture[J].Arthritis Rheum,1977,20(7):1359-1371.
[20] Yudoh K,Shishido K,Murayama H,et al.Water-soluble C60 fullerene prevents degeneration of articular cartilage in osteoarthritis via down-regulation of chondrocyte catabolic activity and inhibition of cartilage degeneration during disease development[J].Arthritis Rheum,2007,56(10):3307-3318.
[21] Carlo MD,Schwartz D,Erickson EA,et al.Endogenous production of reactive oxygen species is required for stimulation of human articular chondrocyte matrix metalloproteinase production by fibronectin fragments[J].Free Radical Biol Med,2007,42(9):1350-1358.
[22] Tak PP,Firestein GS.NF-κB:a key role in inflammatory diseases[J].J Clin Invest,2001,107(1):7-11.
[23] Gilston V,Jones HW,Soo CC,et al.NF-κB activation in human knee-joint synovial tissue during the early stage of joint inflammation[J].Biochem Soc Trans,1997,25(3):518S.
[24] Miagkov AV,Kovalenko DV,Brown CE,et al.NF-κB activation provides the potential link between inflammation and hyperplasia in the arthritic joint[J].Proc Natl Acad Sci U S A,1998,95(23):13859-13864.
[25] 邢飞跃,赵克森,姜 勇.NF-κB的信号通路与阻断策略[J].中国病理生理杂志,2003,19(6):849-855.

