睾丸支持细胞对精原干细胞作用因子研究进展
邓伟民孙大林综述 金保方审校
1. 南京中医药大学(江苏南京 210046);2. 东南大学附属中大医院中西医结合男科
睾丸支持细胞对精原干细胞作用因子研究进展
邓伟民1孙大林2综述 金保方2审校
1. 南京中医药大学(江苏南京 210046);2. 东南大学附属中大医院中西医结合男科
辅助生殖技术的迅速发展,使得男性不育症患者在治疗上的困境得到了很大的改善,但是仍然有许多不育症患者由于无精子症等问题无法完全解决。精原干细胞(Spermatogonial Stem cells, SSCs)位于睾丸生精小管基底膜上,是体内处于自然状态条件下唯一可将遗传信息传至子代的干细胞。既能通过自我更新维持数量的稳定,也能通过基因或者信号的调节达到自我分化,最终产生精细胞。SSCs自我更新和分化之间的动态平衡,保证了雄性生命过程中持续进行的精子发生,如果该平衡被破坏则有可能导致精子生成的障碍:过度增殖则导致生殖细胞瘤的产生,而过度分化则导致雄性的不育[1]。所以SSCs的广泛研究为临床上无精子症的患者带来希望,同时也为于少、弱、畸精子症(OAT)患者的临床治疗带来指导意义。
睾丸支持细胞(Sertoli Cells,SCs)是1865年被德国组织学家Entico Sertoli第一次发现的,并进行了详细描述,它是体细胞中唯一与生精细胞接触的,具有独特的形态结构:在光镜下细胞轮廓清晰,电镜下呈上窄下宽的不规则锥体形,顶端可达生精小管管腔,基底部紧贴基膜,呈椭圆形或锥形的细胞核,也有的核呈分叶状,核膜常皱缩,胞质含量高,含有较多的细胞器以及大量的脂滴,并还有组织有序、功能十分活跃的骨架。相邻SCs靠近基底膜处存在紧密连接,该紧密连接是参与形成睾丸血-睾屏障的一部分,借助它的封闭作用,能将生精小管分为近管腔的近腔室和近基底部的基底室。
现已证实,SCs主要作用是提供营养给各级生精细胞、参与并调控生精细胞自我更新和分化之间的稳定,使精子能够有序和持续的进行发生。因此,SCs可以称作是生精细胞的“保姆细胞”,在精子的生成过程中起着至关重要的作用,本文就SCs对SSCS的作用以及主要相关作用因子进行综述。
一、SCs与SSCs关系及对其作用
(一) SCs是包括SSCs在内的各级生精细胞发育的支架
睾丸内部生精小管主要由SCs和SSCs两种细胞构成, SSCs有很强的自我更新能力和较高的分化潜能,以及向子代传递遗传信息的特殊功能。SSCs的自我更新和分化在SCs分泌的各种因子调控下有序而精确的进行。SSCs以及处于分化前期的精原细胞位于基底室内,处于分化后期的精母细胞则位于近腔室内,精子成熟之后再从近腔室的顶端释放进入到管腔内部。所以说,SCs是包括SSCs在内的各级生精细胞发育的支架。而且,SCs所形成的独特而封闭的局部微环境也是生精细胞进行分化和更新活动的必需场所。
(二)SCs是SSCs特定发育环境的主要结构和调控者
在哺乳动物睾丸内的组织结构可以分为生精小管和管外间质组织。生精小管由管腔和生精上皮构成, SCs存在于生精上皮, 主要为精子生成提供特定微环境及免疫豁免环境。维持免疫豁免功能首先是SCs通过紧密连接,形成一层物理屏障,即血睾屏障(blood testis barrier,BTB)。BTB由相邻支持细胞之间的紧密连接复合体在青春期开始形成,使生精小管内形成特殊免疫豁免区域。为精子的产生提供不受机体免疫系统干扰的微环境。精子产生的过程中,在细胞黏附和运动中构成紧密连接的蛋白质分子参与细胞信号转导和转录调控。这些分子的研究,有利于阐明生精过程中SCs紧密连接的重构作用、促进生精细胞发育以及精母细胞通过血-睾屏障的机制。
SSCs移植研究证明[2],基底室是SSCs能进行自身维持的唯一场所, 因此能推断出基底室可能就是SSCs 的特定发育微环境,它由支持细胞及其连接、细胞外基质、管周肌样细胞、生精小管基膜等构成。研究表明, 将野生型小鼠的SCs向不育小鼠的睾丸内移植,使得不育小鼠重新可育,表明SCs在SSCs的维持、更新及分化等过程中具有不可替代的功能[3]。因此,SCs是SSCs 特定发育环境的主要结构和调控者。
睾丸微环境主要包括各种调控精原干细胞的增殖和分化因子,如由支持细胞分泌的GDNF、FGF2等, 间质细胞分泌的CSF1、睾酮等, 以及血液及周围体液含有的Neuregulin 1、Activin A、BMP4和SOHLH等因子。同时,也标明了精原干细胞及其相邻细胞的相对位置, 如支持细胞、管周肌样细胞等形成的基底室结构,见图1。
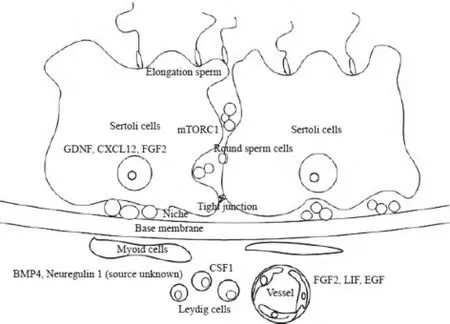
图1 简洁地表示了SCCs与SCs以及睾丸微环境间的关系
二、SCs产生的调节SSCs 发育的主要因子
(一)胶质细胞源性神经生长因子
胶质细胞源性神经生长因子(glial cell line derived neurotrophic factor,GDNF)是由SCs分泌的,属于转化生长因子-β (transforming growth factor-β,TGF-β)家族的中的一个亚族,是含有134个氨基酸残基的糖基化二硫键结合的同源二聚体蛋白。SSCs 表达的GDNF 受体复合物包括GDNF家族受体α1(GDNF family receptor alpha1,GFRα1)和酪氨酸激酶Ret受体。在SSCs、神经干细胞等多种细胞的发育、分化,GDNF均有调节作用并贯穿个体的整个生命过程[4]。已有报道证实GDNF 信号途径对SSCs 自我更新和分化之间的作用是决定性的[5]。敲除GDNF 的基因小鼠可以存活,但小鼠的SSCs 却会逐渐地消失。相反, GDNF 表达过多则会因未分化精原细胞数量增多而导致生殖细胞瘤。
在人幼年和成年的睾丸中,GDNF 于SCs、Leydig 细胞、精母、精子细胞以及一些微小动脉血管壁的平滑肌表达。GDNF 的表达不仅受到成纤维细胞生长因子2(fi broblast growth factor 2,FGF2)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)和人白细胞介素1β(interleukin-1β,IL-1β)等物质的调控外,还受到卵泡刺激素( follicle-stimulating hormone,FSH) 的调控。所以,GDNF 的表达受到整体和局部的双重调控[5]。GDNF 主要通过三方面调控SSCs[6]:(1)GDNF可参与精子发生过程,GDNF还参与调控SSCs 增殖和分化的旁分泌。小剂量的GDNF 会导致SSCs 过度分化和损耗; 而大剂量的GDNF则会促进SSCs 的增殖而抑制其分化。(2) GDNF参与睾丸的发育,SCs分泌GDNF,并以自分泌方式促进SCs的成熟和分裂,从而促进睾丸发育。(3)GDNF 促进血睾屏障的形成,用以构成SSCs的微环境。管周肌样细胞分泌GDNF,毛细血管内皮细胞表达GDNF 的受体GFRα1(GDNF family receptor alpha1,GFRα1) ,GDNF 作用于毛细血管内皮细胞的方式是旁分泌,既促进其增殖,又可以形成细胞间的紧密连接,是通过促进毛细血管内皮达到的[7]。
(二)干细胞因子
干细胞因子(stem cell factor, SCF)是SCs的分泌产物之一,是原癌基因c-Kit受体的配体[8]。c-Kit受体蛋白是酪氨酸激酶的受体之一。将自然生长型的生殖细胞移植到Steel/Steeldickie小鼠睾丸中仍然可以形成集落,但其并不能更进一步分化,这表明SCF与c-Kit结合对于维持精原细胞的分化是必不可少的,出生后的个体精原细胞的增殖、分化中也同样受到SCF/ c-KIT系统调控。在小鼠精原细胞群体中,c-KIT受体表达于正在分化中的精原细胞,而未分化型精原细胞和SSCs 中却不表达或很少表达[9]。同时更多资料表明,SCF /c-Kit 系统可以通过不同的途径调节SSCs的自我更新和增殖: 通过使拉巴霉素敏感的PI3K → AKT→ mTOR → p70S6K → CyclinD3 → cdk4,cdk6 →Rb 发生磷酸化,SCF /c-Kit 系统使c-Kit阳性SSCs 从G1 期向S 期过渡,若阻断PI3K与c-Kit 结合,可导致精子生成障碍,造成男性不育。研究发现MEK通路也可调控生精过程,SCF /c-Kit 系统激活MEK→Erk1 /2→CyclinE,CyclinA2→cdk2→拮抗Rb 磷酸化,控制生精过程的进程,使用U0126可以阻断MEK 通路,导致SCF 诱导的促有丝分裂过程的中断[10]。
(三)转录因子Ets 差异基因5
转录因子Ets 差异基因5(Ets variant gene 5,Etv5)是由Sertoli 细胞分泌的一种转录因子,是ETS家族的一个成员,而ETS家庭是一个大型转录基因家庭,他们在细胞生理学上的不同方面发挥作用:包括细胞迁移、增殖、分化、凋亡和癌变细胞相互作用[11]。ETV5在未成年和成年人体内组织内有着广泛的影响[12],包括睾丸和卵巢[13,14]。在老鼠和人类细胞中,ETV5定位的区域在精原干细胞和支持细胞[15]。小鼠模型研究表明,ETV5是男女生育必不可少的基因[16],破坏小鼠Etv5 基因,可导致SSCs 缺失,造成唯支持细胞综合征(SCOS)和无精子症。运用微阵列分析法,同野生型(WT)小鼠相比较,Etv5(Etv5-/-)敲除的小鼠,几种趋化因子表达量和原始生殖细胞(primordial germ cells,PGCs)的迁移明显减少[17]。Chen 等[12]运用微阵列分析Etv5 缺失小鼠的原始SCs,发现调节造血干细胞龛(niche)的一些保守因子发生改变,基质细胞源性因子12(stromal cellderived factor12,Cxcl12)、Cxcl15 等趋化因子大量减少,这些趋化因子可能是调控SSCs 自我更新的信号分子。Morrow等研究表明[18],Etv5 基因的缺失,可能通过影响SCs的功能,进而造成SSCs 缺失,其作用机制可能是通过降低突变鼠claudin5 蛋白水平,进而导致血睾屏障的损伤。
(四)骨形态发生蛋白4
骨形态发生蛋白4 (bone morphogenetic protein-4,Bmp4),是转化生长因子β(transforming growth factor β,TGF-β)家族中不可或缺的一员,多种细胞的增殖和分化在胚胎发育时期均受到其调控作用,又因其能在异位诱导骨和软骨的形成而得名[19]。Bmp4基因敲除的小鼠会导致中胚层发育缺陷而引起胚胎性死亡。通常由细胞内信号转导蛋白Smad介导Bmp4信号转导通路,Bmp4通过丝氨酸/苏氨酸激酶受体(TβR II)结合后,再与TβR-I受体相结合形成复合物。
Carlomaqno等[20]发现Bmp4可促进大鼠SSCs的分化,并能改变细胞粘附特性。据报道,雄性小鼠的Bmp4由SCs产生,有调控精原细胞的分化的作用,可能是通过c-Kit基因的表达实现的[21]。小鼠中除精子细胞不表达外,精原细胞、精母细胞和支持细胞均表达Bmp4;是因为受体在精细胞中表达,而在精母和精子细胞中不表达。李毅、郝晶等实验[22],使用添加Bmp4的培养基培养SSCs,通过提高Bmp4的浓度达到激活Bmp4/Smad信号通路,促进细胞分化。提出了Bmp4/Smad信号通路可能是通过上调靶基因sohlh2的活性来激活并促进小鼠SSCs的分化。
(五)染色质修饰独立基因Sin3A
哺乳动物体内SIN3蛋白复合物在基因表达的过程中执行多种功能,如:影响核小体重塑,并介导DNA损伤修复和复制时间等。而其中的Sin3A(Chromatin modifi er Swi-independent 3a,Sin3A)连同相关的组蛋白去乙酰化酶,影响细胞的特异性转录因子在发育和分化过程中的表达,Sin3A是维护大量内细胞所必不可少的,如小鼠囊胚细胞,胚胎成纤维细胞,成肌细胞等。在有丝分裂中Sin3A基因特异性敲除的SCs可以支持精子发生的早期阶段,但在分化期,这种细胞是无法引导单倍体的精子细胞的伸长过程。
Payne等[23],在SCs胚胎期基因敲除Sin3A, Sin3A特异性缺失的SCs导致出生后一些未分化精原细胞的形成,同时维持最初的分化状态。在早期,突变体睾丸的SSCs逐渐丧失分化能力,精细胞生长被限制,同时伴随着大量的生殖细胞衰退。损失Sin3A基因的小鼠会导致SCOS的表型,Miyamoto等的研究[24],通过编码区基因分析80例Sin3A缺失日本患者,缺乏Sin3A会导致SCOS造成人类无精子症。这些结果表明,Sin3A的缺失以一个特定的方式损害SCs的分子行为,影响了雄性动物睾丸微环境,进而导致SSCs的生成障碍。导致Sin3A的缺失引发DNA损伤的机制目前未知。目前的研究显示[25],一个哺乳动物完整的SIN3复合蛋白需要适当的臂间异染色质化,Sin3A缺失可能与Sds3蛋白导致染色体分离现象相关,这可能是导致染色体破损的机制。
(六)CXCL12/CX4R系统
CXCL12是由睾丸支持细胞分泌并表达的基因编码的一种趋化因子,与CXCR4受体相结合并参与精原干细胞自我更新和维持的调控。CXCR4的还原作用,是在未分化的小鼠精原细胞的培养中,通过CXCR4特异性抑制剂和 CXCL12抗体阻断剂,导致了SSCs的死亡,而CXCR4通路的抑制作用,是通过在成年小鼠睾丸中注射CXCR4特异性抑制剂,破坏了SSCs的自我维持,导致了生殖细胞的损失。GDNF和FGF2都可以调节CXCR4 的mRNA在thy1c SSCs培养上的表达。运用微阵列基因分析显示,CXCL12/ CXCR4通路的中断导致的FGF-2数量显著降低[26],这表明CXCL12,FGF-2和GNDF形成对SSCs自我更新影响的合作网络。此外,CXCR4还参与胚胎发育阶段原始生殖细胞归巢和出生后SSCs在睾丸微环境的种系回归[6]。SCs中Sin3A特异性缺失导致结构上一些未分化的精原细胞的形成。趋化因子CXCL12及其受体CXCR4在新生期睾丸特异性缺失sin3a的SCs中未被检测到[23],表明CXCL12/CXCR4的系统影响SSCs微环境的建立,进而影响SSCs。
(七)其他因子
除以上因子外SCs还分泌许多因子影响精原干细胞,如白细胞介素IL-1α、IL-6,集落刺激因子CSF-1,胰岛素样生长因子IGF-1,表皮生长因子EGF,生长因子FGF-2等等。如图1所示GDNF、FGF-2、EGF、CSF-1 以及IGF-1 是构成精原干细胞微环境的主要细胞因子,它们共同调节并控制精原干细胞的生存的能力。
三、小结与展望
在睾丸成体细胞中,SCs对SSCs的影响最大,SCs为包括SSCs在内的各级生精细胞提供了发育的外部支架之外,还为其中的生精细胞提供了生长发育的微环境。作为“保姆细胞”的SCs通过分泌各类因子及物质对SSCs的自我更新和分化进行精确的调节,同时为SSCs提供了特殊的免疫豁免环境。SCs还能通过调控其他成体细胞,从而间接影响SSCs的功能,在精子发生中发挥着无可替代的作用。
SSCs 的研究也是近年来的热点和重点,现如今人的SSCs 的体外培养体系已经建立[2],解决了人SSCs 体外繁殖的问题。最近研究表明[27],小鼠的组织体外培养可以支持精子的发生,但是通过体外的一些研究只能说明GDNF 在调控精子发生过程中起到很重要的作用,也就是说,在体外FGF-2,IL,IGF-I,EGF,CSF-1 等对于SSCs的作用需要进一步的研究。研究人员对SSCs微环境定位的主要困难是SSCs的数量稀少,并且缺少特异性分子标记,所以寻找SSCs特异性生物标志物和建立可靠的分选方法依然是SSCs 的重要研究方向之一。所以,建立一个安全有效的能将人类SSCs 诱导成精子的体外诱导体系并大量运用于临床实践,是实现SSCs 在人类辅助生殖上应用迫切需要解决的问题。
致谢:本文受国家自然科学基金(81273760;81473678);国家自然科学基金青年基金(81403402;81302969)基金项目资助
不育,男性; 精原干细胞; 塞尔托利细胞
1 Singh SR, Burnicka-Turek O, Chauhan C, et al. J Cell Mol Med 2011; 15(3): 468-483
2 He Z, Kokkinaki M, Jiang J, et al. Biol Reprod 2010;82(2): 363-372
3 金波. 长春: 吉林大学畜牧兽医学院, 2012; 6: 1
4 Buageaw A, Sukhwani M, Ben-Yehudah A, et al. Biol Reprod 2005; 73(5): 1011-1016
5 Oatley JM, Avarbock MR, Brinster RL. J Biol Chem 2007; 282(35): 25842- 25851
6 Kanatsu-Shinohara M, Inoue K, Takashima S, et al. Cell Stem Cell 2012; 11(4): 567-578
7 李冬梅, 秦晓东. 中华男科学杂志 2013; 19(11): 963-967
8 Caires K, Broady J, McLean D. J Endocrinol 2010;205(2): 133-145
9 Dadoune JP. Folia Histochem Cytobiol 2007; 45(3): 141-147
10 Berruti G. Front Biosci 2006; 11: 2144-2156
11 Sharrocks AD. Nat Rev Mol Cell Biol 2001; 2(11): 827-837
12 Liu Y, Jiang H, Crawford HC, et al. Dev Biol 2003;261(1): 10-24
13 Chen C, Ouyang W, Grigura V, et al. Nature 2005;436(7053): 1030-1034
14 O'Bryan MK, Grealy A, Stahl PJ, et al. Fertil Steril 2012;98(4): 827-35.e1-3
15 Tyagi G, Carnes K, Morrow C, et al. Biol Reprod 2009;81(2): 258-266
16 Eo J, Shin H, Kwon S, et al. Mol Hum Reprod 2011;17(9): 568-576
17 Simon L, Ekman GC, Garcia T, et al. Stem Cells 2010;28(10) : 1882-1892
18 Morrow CM, Tyagi G, Simon L, et al. Biol Reprod 2009;81(5): 871-879
19 Luyten FP, Cunningham NS, Ma S, et al. J Biol Chem 1989; 264(23): 13377-13380
20 Carlomaqno G, van Braqt MP, Korver CM, et al. Biol Reprod 2010; 83(5): 742-749
21 张继强, 秦达念. 中华男科学杂志 2004; 10(9): 688-691
22 李毅, 郝晶. 山东大学, 2012, 5
23 Payne CJ, Gallagher SJ, Foreman O, et al. Stem Cells 2010; 28(8): 1424-1434
24 Miyamoto T1, Koh E, Tsujimura A, et al. Andrologia 2014; 46(3): 273-276
25 Pellegrino J, Castrillon DH, David G. Dev Biol 2012;369(2): 349-355
26 Yang QE, Kim D, Kaucher A, et al. J Cell Sci 2013;126(Pt 4): 1009-1020
27 Sato T, Katagiri K, Gohbara A, et al. Nature 2011;471(7339): 504-507
(2015-09-18收稿)
10.3969/j.issn.1008-0848.2015.12.017
R 698.2

