MiR-373-3p促进肺腺癌细胞的侵袭转移
吴爱兵 李金媚 吴昆鹏 莫艳丽 罗怡平 叶海茵 沈湘 李姝君 梁亚海 刘美莲 杨志雄
肺癌位居全球男性和女性癌症病死率的首位,且呈逐年上升的趋势[1]。肺癌主要分为小细胞肺癌和非小细胞肺癌,其中非小细胞肺癌是主要的发病类型,约占85%[2]。在非小细胞肺癌中,以肺腺癌的发病率最高。肺癌早期往往无明显症状,56%的肺癌患者在确诊时即伴有远处转移,仅15%的患者在病灶局限时被发现[2],因此肺癌细胞侵袭与转移的研究成为临床亟待解决的问题。近年来越来越多的研究发现肺癌侵袭转移的发生与microRNA有密切关系。
MicroRNA是生物体内一类长度约为20个-23个核苷酸的非编码小RNA,是由具有发夹结构的约70个-90个碱基大小的单链RNA前体(pre-miRNA)经过Dicer酶加工后生成的成熟体microRNA-3p和microRNA-5p,通过靶向结合mRNA的3’端非编码区(3’untranslated regions, 3’UTR),影响目的基因的蛋白表达水平,从而影响细胞的增殖、分化、凋亡与侵袭转移等生物学行为[3]。MicroRNA已被证实在多种肿瘤的转移形成中发挥重要作用,包括乳腺癌、肝癌、前列腺癌和结肠癌等[4]。
MiR-373是miRNAs-371-372-373家族的成员之一,miR-371/miR-372/miR-373的前体都是相同的,均由染色质19q13.42转录而来[5]。MiR-373的前体(pre-miR-373)在细胞质中经过Dicer酶加工后生成成熟体miR-373-3p(即miR-373)和miR-373-5p(即miR-373*),然而miR-373*在自然界中极少存在。MiR-373在不同的肿瘤中的作用不尽相同,具有组织特异性,扮演着癌基因和抑癌基因的角色,影响着肿瘤细胞的侵袭转移、增殖与周期等生物学行为。研究表明miR-373在乳腺癌[6]、人纤维肉瘤[7]及胰腺癌[8]中对肿瘤细胞的侵袭转移能力有重要调控作用。然而miR-373在肺癌中的作用机制尚未十分明确,为了探讨其与肺癌的关系,本研究通过检测成熟体hsa-miR-373-3p(又称miR-373)在非小细胞癌中的表达情况,同时比较在肺腺癌细胞系中过表达及干扰miR-373-3p后对肺腺癌细胞侵袭转移能力的影响。
1 材料与方法
1.1 材料 人肺腺癌细胞株A549、H1299、H1975、SPC-A1、PC9和正常支气管上皮细胞HBE均由本实验室提供;非小细胞肺癌组织标本51例和癌旁组织标本39例收集于广东医学院附属医院;RNA提取剂Trizol、反转录及荧光定量PCR试剂盒购自TAKARA;PCR引物合成及细胞培养用的1640培养基购自Invitrogen;胎牛血清(FBS)购自BI;miR-373-3p mimics和miR-373-3p inhibitor购自GenePharma;Lipofectamine® 3000 Transfection Reagent和OPTI-MEN减血清培养基购自Life Technologies;24孔transwell小室(孔径8 μm)购自Corning Costar;侵袭实验所用基质胶( Matrigel)购自BD;基质金属蛋白酶-9(matrix metalloproteinase-9, MMP-9)和MMP14单克隆兔抗人抗体购自CST;RIPA裂解液、BCA蛋白定量及超敏发光试剂盒购自康为世纪公司。
1.2 方法
1.2.1 实时荧光定量PCR(qRT-PCR) 检测肺癌组织和肺癌细胞株中的miR-373-3p收集肺癌标本,冰上研磨成粉末状后加入Trizol提取总RNA,应用 PrimeScript®miRNA cDNA Synthesis Kit将microRNA反转录成cDNA,通过荧光定量PCR法检测肺癌组织miR-373-3p的相对表达水平。收集处于对数生长期的肺腺癌细胞,PBS洗两遍,加入Trizol提取总RNA,反转录后进行qRTPCR检测。Has-miR-373-3p和内参U6的上游引物序列分别为:5’-GAAGTGCTTCGATTTTGGGGTGT-3’和5’-CTCGCTTCGGCAGCACA-3’,其共同下游引物Uni-miR qPCR已包含在TAKARA试剂盒内。应用罗氏LightCycler®进行实时荧光定量PCR检测。每孔10 μL体系,设置3个平行样,U6作为内参。样本经过3次独立重复实验,所得数据使用2-ΔCt或者2-ΔΔCt(ΔCt=Ct目的基因-CtU6)进行相对定量分析。
1.2.2 细胞转染 将处于对数生长期的A549和H1299细胞接种于6孔板中,待细胞生长汇合度达60%-70%时,利用lipo3000转染试剂将hsa-miR-373-3p mimics及其阴性对照(negative control, NC)瞬时转染至H1299细胞中,将hsa-miR-373-3p inhibitor和NC瞬时转染至A549细胞中。转染时换为无血清无双抗的1640培养基,6 h后换成含10%FBS的培养基,转染48 h后,收集细胞,提取RNA,用qRT-PCR法检测转染前后细胞中miR-373-3p及MMP-9、MMP-14基因mRNA的改变。转染序列如下:hsa-miR-373-3p mimics:sense 5’-GAAGUGCUU CGAUUUUGGGGUGU- 3’,anti-sense 5’-ACCCCAAAA UCGAAGCACUUCUU-3’;mimics NC:sense 5’-UUCU CCGAACGUGUCACGUTT- 3’;anti-sense 5’-ACGUGA CACGUUCGGAGAATT-3’;hsa-miR-373-3p inhibitor:5’-ACACCCCAAAAUCGAAGCACUUC-3’,inhibitorNC:5’-CAGUACUUUUGUGUAGUACAA-3’。MMP-9上游引物:5’-GCAATGCTGATGGGAAACCC- 3’;MMP-9下游引物:5’-AGAAGCCGAAGAGCTTGTCC- 3’。MMP-14上游引物:5’-ATCTGCCTCTGCCTCACCTA- 3’;MMP-14下游引物:5’-AAGCCCCATCCAAGGCTAAC- 3’。
1.2.3 迁移实验 取对数生长期的H1299和A549细胞接种于6孔板,转染48 h后,以每孔200 μL的0.25%胰酶消化细胞,用无血清的1640培养基重悬并调整细胞密度为3×105/mL,取100 μL细胞悬液加入24孔transwell小室的上室,下室预先加入500 μL含10%FBS的1640培养基,放置37 ℃、5%CO2培养箱培养24 h后取出小室,用PBS洗两遍,甲醇固定10 min,结晶紫染色10 min。用棉签小心搽拭小室上层细胞,将小室纤维膜取下,用中性树脂将膜封于载玻片中,100倍显微镜下取6个随机视野进行计数。
1.2.4 侵袭实验 取对数生长期的A549和H1299细胞接种于6孔板,转染48 h后,以每孔200 μL的0.25%胰酶消化细胞,用无血清的1640培养基重悬并调整细胞密度为3×105/mL,取100 μL细胞悬液加入24孔transwell小室的上室。上室预先加入50 μL基质胶,室温下风干4 h;下室预先加入500 μL含10%FBS的1640培养基。于37 ℃、5%CO2培养箱培养24 h后取出小室,用PBS洗两遍,甲醇固定10 min,结晶紫染色10 min。用棉签小心搽拭小室上层细胞,将小室纤维膜取下,用中性树脂将膜封于载玻片中,100倍显微镜下取6个随机视野进行计数。
1.2.5 Western blot检测转染后细胞内MMP-9、MMP-14蛋白表达水平 收集转染72 h后的的A549和H1299细胞,加入RIPA裂解液和蛋白酶抑制剂提取总蛋白,BCA蛋白定量法检测蛋白浓度,进行SDS-PAGE电泳,将电泳分离的蛋白转至PVDF膜上,5%BSA室温封闭1 h,分别加入1:1,000兔抗人MMP-9及MMP-14抗体,4 ℃孵育过夜,TBST洗3次,每次10 min,加入辣根过氧化酶偶联的抗兔二抗(1:1,000稀释),置于室温摇床1 h,TBST洗膜3次,每次10 min,加入ECL发光液曝光显影,以β-actin为内参,用Quantity One软件分析结果[9]。
1.2.6 统计学方法 所有试验均重复3次,采用SPSS 17.0统计软件分析数据。数据均用Mean±SD表示,两组样本间比较用t检验,多组样本间比较用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 MiR-373-3p在肺癌组织中的表达水平 用qRT-PCR法检测miR-373-3p在51例NSCLC组织和39例癌旁组织中的表达,与癌旁组织相比,miR-373-3p在非小细胞肺癌组织中高表达(P=0.011,9)(图1),然而,miR-373-3p在腺癌与鳞癌中的表达无明显差异(P=0.904,9)。有淋巴结转移的肺癌组织中miR-373-3p的表达是无淋巴结转移的3.7倍(P=0.008,7)(图1,表1),这说明miR-373-3p可能与肿瘤细胞的转移能力相关。
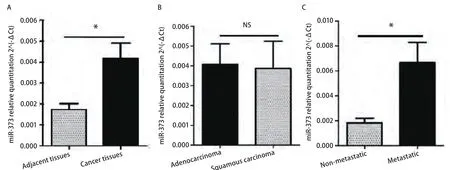
图1 qRT-PCR检测miR-373-3p在肺癌标本中的表达。A:MiR-373-3p在肺癌组织(n=51)中较癌旁组织(n=39)高表达(P=0.011,9);B:MiR-373-3p在肺腺癌和鳞癌间的表达差异无统计学意义(P=0.904,9);C:MiR-373-3p在有淋巴结转移的癌组织中较无淋巴结转移的癌组织高表达(P=0.008,7)。Fig1 qRT-PCR of miR-373-3p expression in lung cancer tissue. A: The expression of miR-373-3p was up-regulated in lung cancer; B: MiR-373-3p was not sinificantly different between adenocarcinoma and squamous carcinoma; C: Higher expression was shown in lung cancer with lymph node metastasis. *: P<0.05; NS: P>0.05.

表1 非小细胞肺癌患者的临床病理特征与miR-373-3p表达的关系Tab1 Clinicopathologic features of non-small cell lung cancer patients and the expression of miR-373-3p
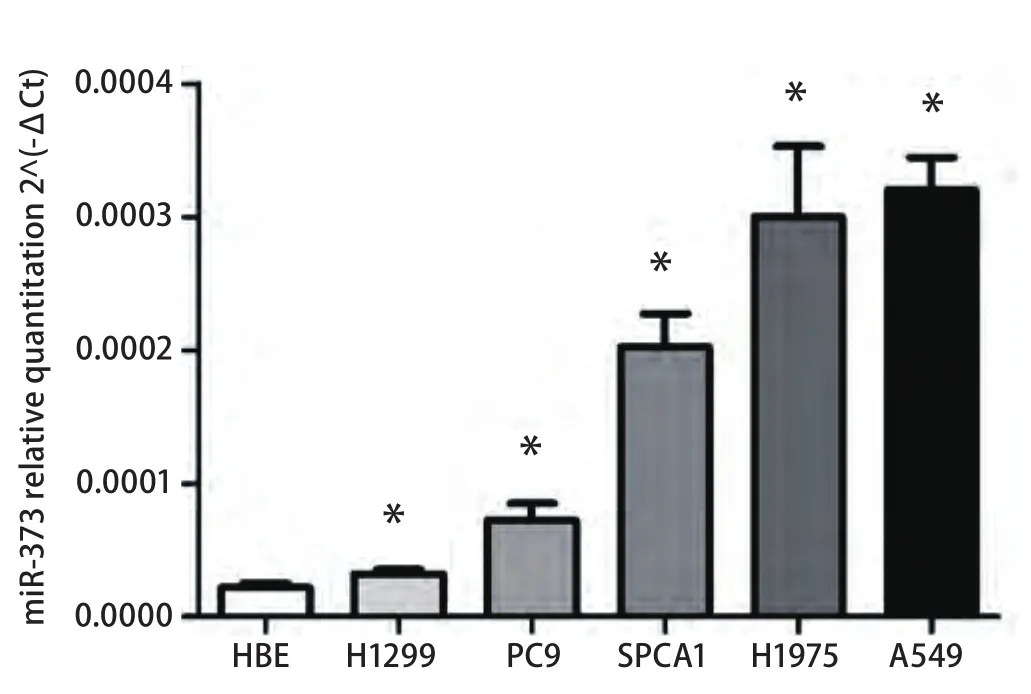
图2 qRT-PCR检测miR-373-3p在肺腺癌细胞株中的表达。MiR-373-3p在5种肺腺癌细胞株中的表达水平较正常支气管上皮细胞明显增高。相比HBE组,*P<0.05。Fig2 qRT-PCR of miR-373-3p expression in lung adenocarcinoma cancer cell lines. The expression level of miR-373-3p is sinificantly higher in lung adenocarcinoma cancer cell lines (n=5) than in normal bronchial epithelial cell (HBE). *: P<0.05, when compared with HBE.
2.2 MiR-373-3p在肺腺癌细胞株中的表达 我们进一步检测miR-373-3p在肺腺癌细胞株中的表达情况(图2),结果显示与正常支气管上皮细胞(HBE)相比,肺腺癌细胞株(H1299、A549、H1975、SPC-A1、PC9)中miR-373-3p的表达均明显上调(P=0.005,8)。根据肺腺癌细胞中miR-373-3p的表达情况,我们选择在miR-373-3p相对表达水平最低的H1299细胞中过表达miR-373-3p,在miR-373-3p相对表达水平最高的A549细胞中抑制miR-373-3p的表达。
2.3 转染前后细胞中miR-373-3p及MMP-9、MMP-14基因mRNA水平的改变 用瞬时转染法将miR-373-3p mimics转染至miR-373-3p表达量相对最低的H1299细胞中,与NC组相比,mimics组miR-373-3p(P=0.006)和MMP-9(P<0.001)、MMP-14(P<0.001)的表达明显增加;将miR-373-3p inhibitor转染至miR-373-3p表达量相对最高的A549细胞中,与NC组相比,inhibitor组miR-373-3p(P=0.019,2)和MMP-9(P<0.001)、MMP-14(P<0.001)的表达明显下调(图3)。
2.4 miR-373-3p促进肺腺癌细胞的侵袭与迁移 在Transwell小室迁移实验中,我们发现过表达miR-373-3p后H1299细胞的迁移能力增加1.72倍(P<0.01),然而抑制miR-373-3p的表达后A549细胞的迁移能力下降54%(P=0.012)(图4A);与迁移实验结果一致的是,在Transwell小室基质胶侵袭实验中,过表达miR-373-3p后H1299细胞的侵袭能力增加1.62倍(P<0.01),抑制miR-373-3p的表达后A549细胞的侵袭能力下降45%(P=0.03)(图4B)。
2.5 改变miR-373-3p的表达对MMP-9、MMP-14蛋白的影响 相比对照组细胞,转染miR-373-3p mimics的细胞中MMP-9、MMP-14蛋白表达上调;与对照组相比,转染miR-373-3p inhibitor的细胞中MMP-9、MMP-14蛋白表达下调(图5)。
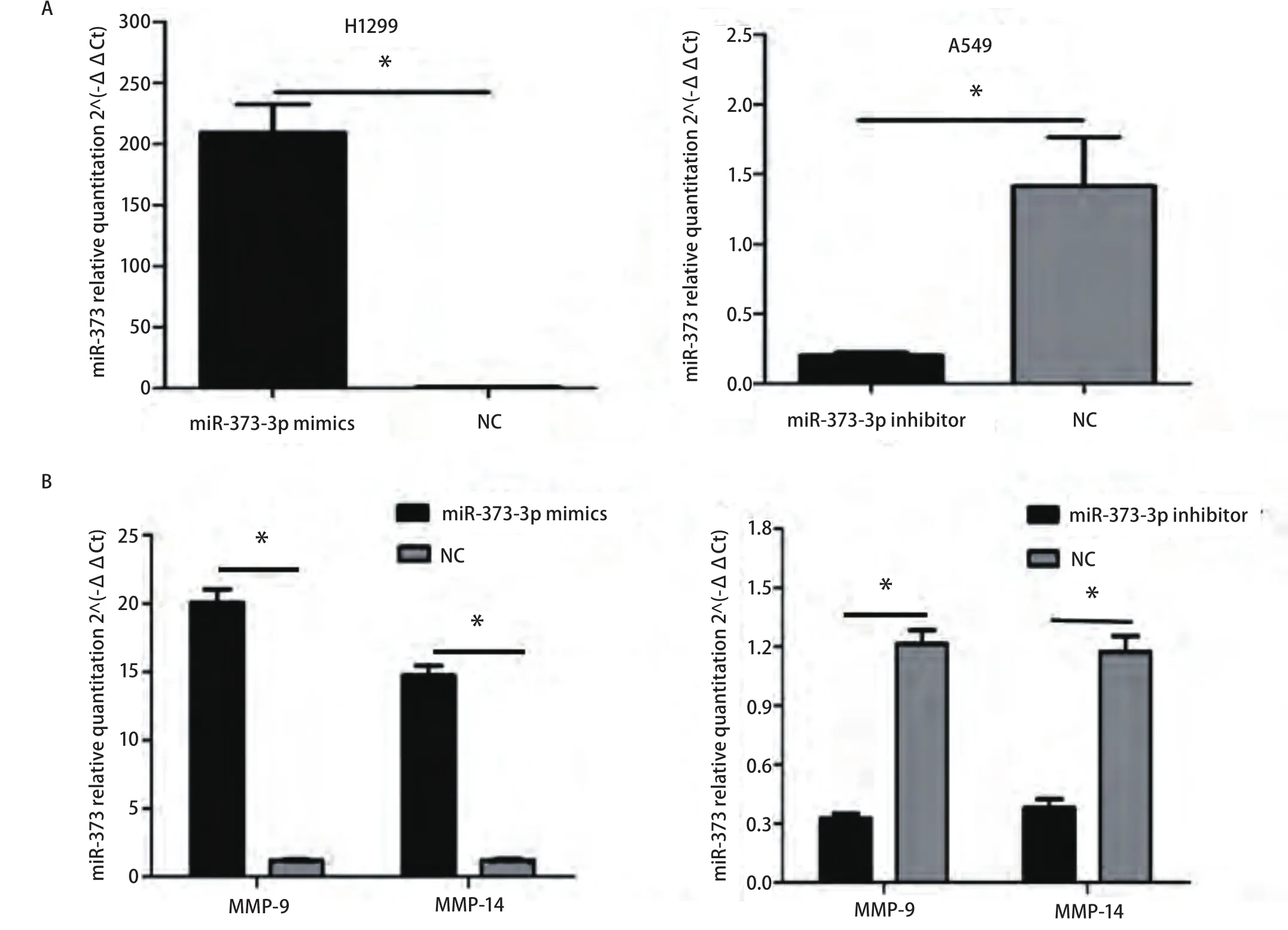
图3 转染后细胞中miR-373-3p、MMP-9和MMP-14基因的mRNA水平。A:瞬转miR-373-3p mimics后H1299细胞中miR-373-3p的表达明显增加,瞬转miR-373-3p inhibitor后A549细胞中miR-373-3p的表达明显减少。*:P<0.05;B:过表达miR-373-3p后H1299细胞中MMP-9、MMP-14基因的mRNA明显上调;抑制miR-373-3p表达后A549细胞的MMP-9、MMP-14基因的mRNA明显下调。*:P<0.05。Fig3 mRNA level of miR-373-3p, MMP-9 and MMP-14 in transfected lung cancer cell lines. A: H1299 cells transfected with miR-373-3p mimics showed an increase in miR-373-3p expression, while A549 cells transfected with miR-373-3p inhibitor resulted in significantly decreased miR-373-3p expression. *: P<0.05 when compared with corresponding negative control. B: mRNA expression of MMP-9 and MMP-14 was up-regulation in H1299 cells with miR-373-3p overexpression, while these genes were down-regulation in A549 with miR-373-3p knock-down. *: P<0.05.
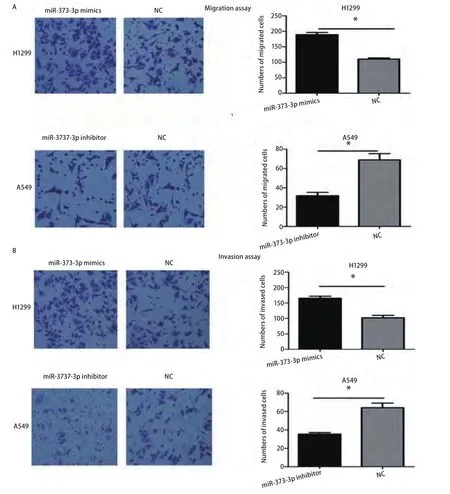
图4 miR-373对肺腺癌细胞迁移与侵袭能力的影响。A:迁移实验。转染miR-373 mimics后促进H1299细胞迁移,转染miR-373 inhibitor后抑制A549细胞迁移;B:侵袭实验。转染miR-373 mimics后H1299细胞的侵袭能力增强,转染miR-373 inhibitor后A549细胞的侵袭能力下降。*:P<0.05。Fig4 Effects of miR-373 on the migration and invasion of lung adenocarcinoma cancer cells in vitro. A: Migration assay. H1299 cells transfected with miR-373 mimics showed an increase in migration capability, while A549 cells transfected with miR-373 inhibitor resulted in significantly decreased migration capability. *: P<0.05 when compared with corresponding negative control. B: Invasion assay. Promotion of invasion ability was shown in H1299 transfected with miR-373 mimics, while A549 cells transfected with miR-373 inhibitor lead to the significantly decrease of invasion ability. *: P<0.05 when compared with corresponding negative control.

图5 转染后细胞中MMP-9、MMP-14蛋白的表达水平。转染miR-373-3p mimics后H1299细胞中MMP-9、MMP-14蛋白表达上调;转染miR-373-p inhibitor后A549细胞中MMP-9、MMP-14蛋白表达下调。Fig5 Expression of MMP-9 and MMP-14 protein in cells after tranfection. Up-regulation of MMP-9 and MMP-14 protein in H1299 cells transfected with miR-373-3p mimics, while down-regulation of MMP-9 and MMP-14 protein in A549 cells transfected with miR-373-3p inhibitor.
3 讨论
MiR-373在多种肿瘤中均出现异常表达,扮演着癌基因或者抑癌基因的角色,影响肿瘤细胞的增殖、侵袭和转移过程。有研究[6]报道miR-373在乳腺癌中表达上调,通过下调CD44的表达而促进肿瘤细胞的侵袭转移能力。在人纤维肉瘤HT1080细胞中,过表达的miR-373可直接通过靶向结合雷帕霉素靶蛋白(mechanistic target of rapamycin, mTOR)和去乙酰化酶1(sirtuin 1, SIRT1)mRNA的3'UTR而使mTOR和SIRT1的表达下调,进一步导致Ras/Raf/MEK/Erk信号通路和转录因子(nuclear factor kappa B, NF-κB)的激活,从而提高MMP-9的表达水平,增强肿瘤细胞的生长和迁移能力[7]。Zhang等[8]研究发现miR-373在胃癌中高表达,通过下调靶基因肿瘤坏死因子α诱导蛋白1(tumor necrosis factor, alpha-induced protein 1, TNFAIP1)的表达而促进胃癌细胞的增殖。然而,miR-373与肺癌的研究甚少,两者的关系尚未十分明确。
本研究发现miR-373-3p在非小细胞肺癌组织中较癌旁组织高表达,通过分析研究非小细胞肺癌组织标本的临床病理特征与miR-373-3p表达间的关系发现,有淋巴结转移的非小细胞肺癌组织中miR-373-3p的表达明显高于无淋巴结转移的,另外T3期-T4期的NSCLC组织中miR-373-3p的表达也高于T1期-T2期的,据此我们认为miR-373-3p可能对NSCLC的增殖转移有一定调控作用。而非小细胞肺癌中又以肺腺癌的发病率最高,因此本研究主要探讨miR-373-3p与肺腺癌侵袭转移的关系,进一步研究发现miR-373-3p在5种人肺腺癌细胞株中的表达水平也显著高于人正常支气管上皮细胞,其中以H1299细胞的相对表达水平最低,A549细胞的相对表达水平最高。为了探讨miR-373-3p对肺腺癌细胞的侵袭转移能力的影响,我们通过功能获得以及功能缺失研究发现过表达miR-373-3p可以促进H1299细胞的侵袭转移能力;相反,抑制miR-373-3p的表达可降低A549细胞的侵袭转移能力。以上数据表明miR-373-3p可以促进肺腺癌细胞的侵袭转移能力。与此同时,日本学者Seol等[9]在研究miR-373与肺癌的关系时发现过表达pre-miR-373可抑制肺癌细胞的侵袭能力,该研究结果和我们有所不同,存在差异的可能原因是他们的研究中用的是miR-373的前体,而pre-microRNA进入细胞后会在Dicer酶的加工下生成microRNA-5p和microRNA-3p而发挥生物学作用,事实上是否存在microRNA-5p和microRNA-3p的作用差异,这是一个有趣的问题,因为miR-373在不同的肿瘤中也扮演不同的角色,在有的肿瘤中促进转移,有的则是抑制肿瘤转移,例如miR-373促进乳腺癌[6]、人纤维肉瘤[7]及宫颈癌[10]细胞的转移能力,却抑制前列腺癌[11]和卵巢癌[12]细胞的转移,今后miR-373的亚型在肺癌中的作用仍需进一步研究。
肿瘤侵袭转移的形成涉及多种机制,研究发现基质金属蛋白酶家族(matrix metalloproteinases, MMPs)对于肿瘤转移有重要相关性,他们降解基底膜并在细胞外基质(extracellular matrix, ECM)中暴露出隐藏的多肽抗原,促进侵袭的发生。MMPs可在原发肿瘤处将可溶性肿瘤细胞释放至循环系统中,并在远处器官形成转移微环境以助于随后肿瘤细胞的克隆形成[13]。MMPs也可以直接修饰整合素和其他肿瘤细胞粘附分子,激活重要的细胞因子如转化生长因子β(transforming growth factor beta,TGF-β),诱导上皮-间质转化(epithelial-mesenchymal transition, EMT)的发生,EMT是由增强细胞运动而引起的广泛表型改变,是肿瘤转移的重要过程[13]。MMP-9是基质金属蛋白酶家族的成员之一,对肿瘤细胞的生长、增殖和侵袭迁移起着重要作用[14]。Peng等[15]发现MMP-9高表达与非小细胞肺癌患者的不良预后有密切关系。多项研究[16-18]表明MMP-9与增加患者淋巴结转移率、肿瘤远处转移率及缩短无复发生存率有关。MMP-14又称膜型基质金属蛋白酶-1(membrane-type matrix proteinase-1,MT1-MMP),是第一个被发现的膜型基质金属蛋白酶。MMP-14在正常组织与肿瘤组织的生物学行为中均发挥重要作用,例如侵袭[19]、增殖[20]与细胞外基质的重塑[21]等。研究[22]证实相比癌旁组织,MMP-14在非小细胞癌组织中明显高表达。Wang等[23]研究发现MMP-14高表达的非小细胞肺癌患者生存时间比MMP-14低表达者更短,是一个不良预后的指标。
为了进一步探讨miR-373-3p促进肺腺癌细胞侵袭转移能力的作用机制,我们对miR-373-3p与基质金属蛋蛋白酶间的关系进行了研究。结果发现过表达miR-373-3p的细胞中MMP-9及MMP-14蛋白的表达水平上调;抑制miR-373-3p的表达后细胞中MMP-9及MMP-14蛋白的表达水平下调。该结果表明,miR-373-3p可能通过上调MMP-9及MMP-14蛋白的表达水平而影响肿瘤细胞的侵袭转移能力。
本研究发现miR-373-3p在肺腺癌中表达上调并扮着癌基因的角色,可能通过上调MMP-9及MMP-14蛋白的表达水平而促进肺腺癌细胞的侵袭转移能力,阐明了肺腺癌细胞发生侵袭转移的机制之一,提示miR-373-3p可能作为抑制肺腺癌细胞侵袭转移能力的靶点,有望为临床上逆转肺腺癌的侵袭转移提供新的思路。

