限制性胎盘嵌合体对产前诊断的影响
周希亚,戚庆炜,郝娜,周京,刘俊涛,边旭明
(中国医学科学院 北京协和医学院 北京协和医院,北京 100730)
限制性胎盘嵌合体(CPM)是指胎盘内同时存在染色体正常和异常的细胞系,而胎儿染色体正常的情况。在早孕期绒毛活检(CVS)操作中,CPM 的发生率为1%~2%[1-2],其中30%~50%的CPM会在妊娠过程中丢失胎盘非整倍体细胞系[3]。而在异常细胞持续存在的病例中,CPM可能会增加不良妊娠结局的风险。虽然最早的CPM报道距今已有30余年[1],但我国文献中对CPM的系统研究及报告仍很鲜见[4-5]。本文回顾性分析了我院2013年早孕期绒毛活检中发现的2例CPM患者,参考近年来国内外的相关文献报道,探讨CPM的发生、妊娠结局、产前咨询与随访处理,及其对无创产前检测(NIPT)、植入前遗传学筛查(PGS)的影响。
资料与方法
一、研究对象
对2013年我院产科收治的存在高龄妊娠、胎儿颈部透明层增厚、染色体异常胎儿分娩史的211例妊娠妇女行经腹CVS检查,发现2例CPM患者,CPM发生率为0.9%。此2例患者的产前诊断情况见表1。

表1 CPM患者的产前诊断情况
CPM的产前诊断:采用绒毛长期培养法[4],进行G显带核型分析,如发现绒毛标本嵌合,再经后续羊膜腔穿刺或脐血穿刺确认,诊断为CPM。
二、研究方法
1.CVS操作:穿刺前认真核对适应证、妊娠周数、子宫大小、有无穿刺禁忌证等。B超测量胎儿头臀长以核对孕周,了解有无胎心,定位胎盘位置,选择穿刺部位。在超声引导下,选用双针套管,将引导套针经腹壁及子宫穿刺入胎盘。拔出针芯,将活检针经引导套针内送入胎盘绒毛组织。连接含有2~4ml生理盐水的20ml注射器,以5ml负压上下移动活检针吸取绒毛组织。拔针后立即观察胎盘部位有无出血及胎心情况。
2.绒毛培养及染色体制备:无菌条件下,用无菌生理盐水将绒毛组织洗净,去除红细胞及蜕膜组织、非绒毛组织。用无菌剪刀剪碎组织后,加入1ml酶解液(自配,含 0.02%EDTA、0.25% 胰酶和900U/ml的胶原酶),吹打均匀后置于37℃水浴中20~30min,取出后进行离心操作,弃上清后,加入Amniomax培养液(GIBCO,美国)4ml,混匀后置于培养瓶中,37℃CO2培养箱中培养2~3d,至有贴壁细胞并形成多个克隆后即采用原位法收获细胞。
每个培养瓶中加入20μl类秋水仙素溶液(GIBCO,美国),调整终浓度为25μg/ml,室温或37℃水浴中作用15min,倒掉液体加入1%枸櫞酸钠溶液(自配)4ml,室温或37℃水浴中低渗作用40min,加入1ml 3∶1固定液(甲醇∶冰醋酸=3∶1,自配)预固定2min,倒掉液体后,加入1.5ml 3∶1固定液涮壁后倒掉,重新加入固定液4ml作用20min,倒掉液体后再加入固定液4ml作用10min,此步骤重复一次后将培养瓶上盖掀掉、甩出液体即可烤片,进行染色体分带染色。
3.羊水细胞培养及染色体制备:在B超引导下经腹抽取羊水20ml,离心后弃上清,每管加入1ml Amniomax培养液后混匀,将细胞悬液分别加入4个带玻片平皿中的盖玻片上(每个0.5ml),置于CO2培养箱中培养24h后,向每个平皿中追加1.5ml培养液继续培养72h。此后每天显微镜下观察细胞形态,观察到较好的梭形细胞克隆时更换培养液,于24h后收获细胞。
向每个平皿中加入20ng/ml秋水仙素12μl,置于37℃培养箱中继续培养2h,弃去培养液,加入0.8%枸櫞酸钠溶液2ml进行低渗,37℃培养箱中继续培养20~30min后在相差显微镜下观察,若细胞透亮浑圆,则缓慢加入3∶1固定液逐步固定。室温下控干后置于55℃加热平台上烤片,再置于37℃温箱中过夜,最后用树脂胶将盖玻片贴在干净的载玻片上备用。在0.25%胰酶溶液中作用15s后Gi-emsa染色,滤纸吸干多余水分后显微镜下观察。
4.单核苷酸多态性微阵列分析:采用美国Affymetrix公司的Cytoscan 750K芯片平台进行单核苷酸多态性微阵列分析。取600μl新生儿外周血采用德国QIAGEN公司试剂盒及其标准DNA抽提方法提取DNA,并测定样本浓度。经酶切、连接、聚合酶链反应(PCR)、PCR产物鉴定、纯化、定量、片段化、标记、杂交后,对芯片进行洗涤、染色及扫描,得到数据经Affymetrix自带软件转换,并通过染色体分析软件ChAS(Chromosome Analysis Suite Software)进行分析。
结 果
一、2例患者的培养及核型分析结果
患者1绒毛培养及核型分析结果显示为15-三体与正常核型的嵌合,羊水细胞培养及核型分析则仅见1个核型15-三体。患者2绒毛培养及核型分析结果显示7-三体与正常核型的嵌合,脐血穿刺及核型分析结果未见异常。
临床分析认为患者1不能除外假性嵌合或低水平的真性嵌合,CPM可能性大;嵌合为单亲二倍体的诊断带来困难,经遗传咨询后,该例患者选择继续妊娠。患者2CPM诊断明确,经遗传咨询后,选择继续妊娠。
二、CPM的妊娠结局
患者1于孕38周4d剖宫产1女性活婴,Apgar评分10分,新生儿体重3 220g。经知情同意后,取新生儿外周血培养并行400~450条带核型分析,未见异常核型。单核苷酸多态性微阵列分析结果为arr(1-22)x2,XYx1。
患者2孕32周时发现胎儿宫内生长受限,定期B超监测胎儿生长发育情况,维持妊娠至37周2d剖宫产1男性活婴,Apgar评分10分,新生儿体重2 340g,为小于胎龄儿,转儿科处理。取胎盘多点样本,行320条带染色体分析,胎盘边缘100%为47,XY+7,胎盘中央近胎儿面100%为46,XY,胎盘近脐带根部母体面细胞25%为47,XY+7,75%为46,XY。
讨 论
一、CPM的发生
1983年,Kalousek和Dill发现,在不明原因宫内发育受限的婴儿的胎盘中存在CPM[1]。理论上,由于胎盘与胎儿来自同一受精卵,其染色体核型应当一致。但是在CPM的病例中,异常染色体核型(数目或结构异常)的细胞系仅存在于胎盘,而胎儿核型正常[2]。
目前,CPM的分类有以下两种情况,一是根据发生机理,CPM可以分为减数分裂型及有丝分裂型:减数分裂型是指受精卵染色体异常(通常为三体),在之后的分裂中,由于“错误”导致囊胚内细胞团中形成胚胎的细胞丢失了异常染色体,成为46,XN,而其余的异常细胞被“驱赶”至滋养细胞层,这个过程被称为“三体合子挽救”(trisomic zygote rescue)或“胎儿自救”(fetal rescue);有丝分裂型则是指受精卵为二倍体,异常分裂发生在胎盘细胞的前体中。另一种是按照所累及的绒毛细胞,CPM可以分为3型:Ⅰ型CPM,染色体异常只存在于细胞滋养细胞,因此仅在短期培养后能见到;Ⅱ型CPM,染色体异常局限于绒毛的间质核心,只有经过长期培养后方可见到;Ⅲ型CPM,染色体异常既存在于细胞滋养细胞,也存在于间质核心,短期培养和长期培养后均可见到[6]。因此对绒毛同时进行短期培养和长期培养,可以更准确地诊断CPM及其分型。本研究中,由于取材量的限制,我院采用的是长期培养法,故未能对CPM进行准确分型。有研究报道,妊娠9~12周时通过CVS进行产前诊断的病例中,CPM的发生率约为1%~2%[1-2],而普通人群中 CPM 的真实发生率目前尚不清楚。16-三体是CPM中最常见的非整倍体,其他常见的非整倍体包括2、7、9、15和22号染色体三体[6]。
二、CPM的妊娠结局
继Kalousek和Dill发现CPM与胎儿宫内生长受限相关后,许多学者希望能证实这一相关性,但研究结果并不一致。有研究发现CPM与不良妊娠结局有关,包括流产、胎儿宫内生长受限、早产等[7-12],而另一些研究则未能证实CPM导致不良妊娠结局[13]。有学者对不明原因的胎儿宫内生长受限进行了研究,发现 CPM 的比例显著增高[8-10],但大多数研究仍集中于早孕期CVS诊断的CPM病例,未发现分娩孕周、新生儿体重在CPM组与对照组间存在统计学差异。表2展示了部分文献病例对照研究的结果。
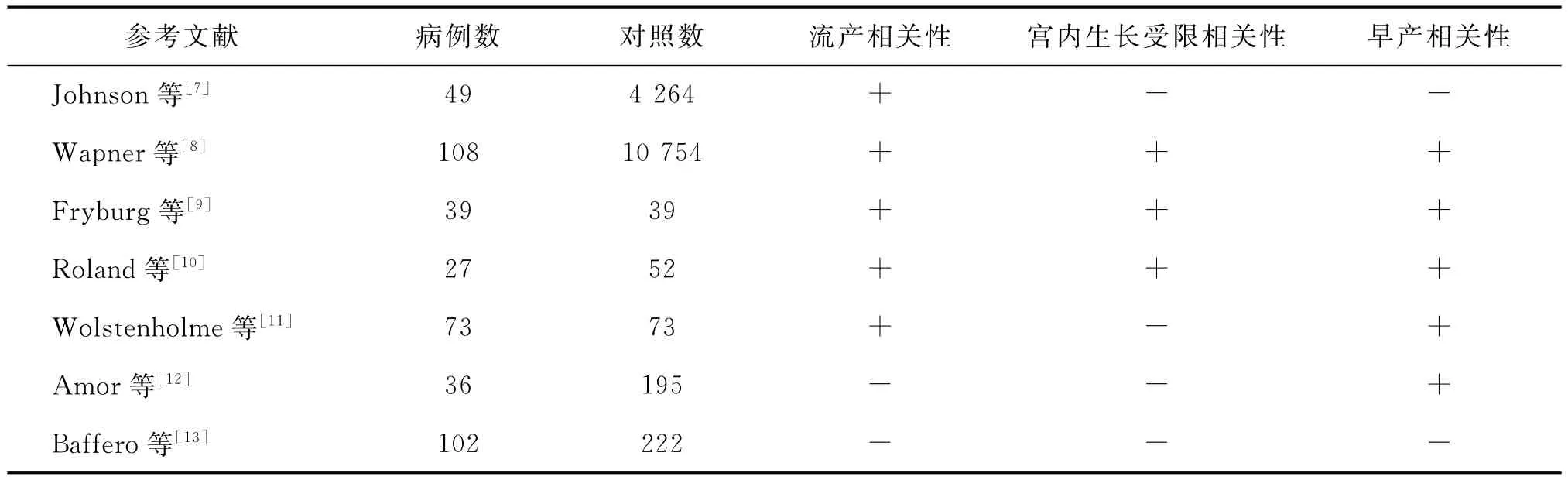
表2 CPM对妊娠结局影响的部分病例对照研究
研究结果的不一致,一方面可能是因为大多数研究样本量较小,研究结果存在一定的偏倚;另一方面可能因为CPM对胚胎及胎儿发育的影响与诸多因素有关,包括染色体受累的时间、染色体异常的类型、受累染色体本身的性质,以及足月胎盘的嵌合比例等。有研究报道,Ⅰ型CPM患者往往出现流产或胎儿宫内生长受限[7];有些染色体异常容易造成自然流产,表明这些染色体的CPM可能是减数分裂型,例如16-三体的 CPM[1];而另一些染色体的CPM可能是有丝分裂型,例如8-三体的CPM[1]。此外,并非所有早孕期CVS诊断的CPM患者都能维持到妊娠足月,足月胎盘是否仍存在嵌合以及嵌合程度可能与妊娠结局相关。有研究发现,9号、16号染色体三体/二倍体嵌合的CPM患者最易维持至足月[6]。Wilkins-Haug等[14]对70例胎儿宫内生长受限的病例进行病例对照研究发现,胎儿宫内发育受限的患者其胎盘存在高水平的四倍体嵌合。因此,要想准确解释CPM对妊娠结局的影响,必须对足月胎盘进行全面地分析。在缺乏胎盘染色体结果的情况下,很难评价CPM与妊娠结局之间的关系。对于不明原因的胎儿宫内生长受限,建议在分娩时留取多点胎盘组织进行染色体分析。本研究中我院2013年仅收集到的2例CPM患者中,病例2存在胎儿宫内生长受限,胎盘多点染色体分析证实了妊娠足月时胎盘依旧存在嵌合状态。
三、CPM的咨询与随访
CVS检查所取标本为早孕期胎盘绒毛,主要为细胞滋养细胞及绒毛间质,并非真正的胎儿组织。因此,当CVS检查发现嵌合时,首先应分析胎儿真性嵌合的可能性。例如,CVS检查发现21-三体嵌合,表示胎儿也可能存在21-三体,无论胎儿本身是否为嵌合体。8、9、12、13、15、18和20-三体的嵌合也存在类似风险。而CVS检查发现2、3、5、7、10、11、14、16、17-三体嵌合时,胎儿核型往往并无异常[15]。
对于减数分裂型CPM,三体受精卵“胎儿自救”过程中会丢失掉一条染色体,因此剩余的两条染色体有可能来自同一个亲本,即出现单亲二体(UPD)。因此,对于那些可能存在印记基因的染色体,例如当发现涉及5、6、7、9、11、14、15、16号染色体的 CPM 时,应当进行 UPD 检测[16-17]。
当CVS核型分析提示嵌合体结果时,遗传咨询首先应分析CPM的可能性。告知孕妇绝大多数的嵌合并不意味着胎儿异常,应当进行羊膜腔穿刺或脐血穿刺再次进行核型分析;但另一方面也应说明,即使后续诊断核型正常,胎儿仍可能存在低水平的嵌合,但不一定影响表型。Stetten等[18]随访了29例CPM患者的新生儿,其中2例存在低水平的嵌合。由于CPM与妊娠结局之间的关系比较复杂,妊娠期间难以预测,因此,对CPM患者胎儿的生长发育应予以重视,对宫内生长受限的胎儿应加强大脑中动脉及脐动脉血流的监测,并适时终止妊娠。产后应对胎盘及新生儿进行染色体分析。
四、CPM对新技术的挑战
随着测序技术的发展,近年来,母血胎儿游离DNA被用于胎儿非整倍体检测,即无创产前检测技术(NIPT)。但有研究发现,CPM是造成NIPT检测假阳性的重要因素[19-23]。因为所谓的胎儿游离DNA,并非来自胎儿,而是来自胎盘细胞。胎盘嵌合体的存在,将导致假阳性结果的发生,表3列出了CPM导致NIPT检测假阳性的部分研究(截至2013年)。因此,在获得NIPT结果后,建议再行羊膜腔穿刺或脐血穿刺进行产前诊断。

表3 CPM导致NIPT检测假阳性的部分研究
近年来,植入前遗传学筛查技术(PGS)也逐渐发展。van Echten-Arends等[24]研究报道,行 PGS检测的卵裂球中,59%是二倍体/非整倍体的嵌合体。Northrop等[25]研究报道,16%的囊胚为嵌合体。由于植入前高比例的嵌合,在PGS过程中,采用极体、第3天卵裂球中的单个细胞、或者囊胚滋养细胞层(将来形成胎盘)的多个细胞,都有可能导致PGS认为二倍体的胎儿为非整倍体,从而被错误地排除。
到目前为止,CVS核型分析的嵌合状态仍是产前诊断和咨询中的难点。CPM的发生率较低,需要通过羊膜腔穿刺或脐血穿刺、核型分析诊断。对于某些染色体而言,诊断CPM时要除外UPD的存在。CPM可能造成NIPT、PGS的假阳性结果,因此,NIPT检测阳性仍需核型诊断。由于CPM可能对产前诊断造成上述影响,临床医生应当重视CPM的存在,加强对CPM的遗传咨询。对于存在CPM的妊娠,孕期应加强对胎儿生长发育的监测,分娩时留取胎盘多点取材,分别检测染色体核型。
[1]Kalousek DK,Dill FJ.Chromosomal mosaicism confined to the placenta in human conceptions[J].Science,1983,221:665-667.
[2]Ledbetter DH,Zachary JM,Simpson JL,et al.Cytogenetic results from the U.S.Collaborative Study on CVS[J].Prenat Diagn,1992,12:317-345.
[3]Wilkins-Haug L,Quade B,Morton CC.Confined placental mosaicism as a risk factor among newborns with fetal growth restriction[J].Prenat Diagn,2006,26:428-432.
[4]戚庆炜,向阳,郝娜,等 .早孕期经腹绒毛活检及细胞遗传学分析在染色体疾病产前诊断中的应用[J].现代妇产科进展,2006,15:538-541.
[5]袁慧珍,刘艳秋,包娟 .限制性胎盘嵌合体1例分析[J].中国妇幼健康研究,2014,25:529-530.
[6]Kalousek DK,Vekemans M.Confined placental mosaicism[J].J Med Genet,1996,33:529-533.
[7]Johnson A,Wapner RJ,Davis GH,et al.Mosaicism in chorionic villous sampling:an association with poor perinatal outcome[J].Obstet Gynecol,1990,75:573-577.
[8]Wapner RJ,Simpson JL,Golbus MS,et al.Chorionic mosaicism:association with fetal loss but not with adverse perinatal outcome[J].Prenat Diagn,1992,12:347-355.
[9]Fryburg JS,Dimaio MS,Yang-Feng TL,et al.Follow-up of pregnancies complicated by placental mosaicism diagnosed by chorionic villous sampling[J].Prenat Diagn,1993,13:481-494.
[10]Roland B,Lynch L,Berkowitz G,et al.Confined placental mosaicism in CVS and pregnancy outcome[J].Prenat Diagn,1994,14:589-593.
[11]Wolstenholme J,Rooney DE,Davison EV.Confined placental mosaicism,IUGR,and adverse pregnancy outcome:a controlled retrospective U.K.collaborative survey[J].Prenat Diagn,1994,14:345-361.
[12]Amor DJ,Neo WT,Waters E,et al.Health and developmental outcome of children following prenatal diagnosis of confined placental mosaicism[J].Prenat Diagn,2006,26:443-448.
[13]Baffero GM,Somigliana E,Crovetto F,et al.Confined placental mosaicism at chorionic villous sampling:risk factors and pregnancy outcome[J].Prenat Diagn,2012,32:1102-1108.
[14]Wilkins-Haug L,Roberts DJ,Morton CC.Confined placental mosaicism and intrauterine growth retardation:a case-control analysis of placentas at delivery[J].Am J Obstet Gynecol,1995,172:44-50.
[15]Hahnemann JM,Vejerslev LO.European collaborative research on mosaicism in CVS(EUCROMIC)—fetal and extrafetal cell lineages in 192gestations with CVS mosaicism involving single autosomal trisomy[J].Am J Med Genet,1997,70:179-187.
[16]Kotzot D,Utermann G.Uniparental disomy(UPD)other than 15:phenotypes and bibliography updated[J].Am J Med Genet A,2005,136:287-305.
[17]Kotzot D.Prenatal testing for uniparental disomy:indications and clinical relevance[J].Ultrasound Obstet Gynecol,2008,31:100-105.
[18]Stetten G,Escallon CS,South ST,et al.Reevaluating confined placental mosaicism[J].Am J Med Genet A,2004,131:232-239.
[19]Mennuti MT,Cherry AM,Morrissette JJ,et al.Is it time to sound an alarm about false-positive cell-free DNA testing for fetal aneuploidy?[J].Am J Obstet Gynecol,2013,209:415-419.
[20]Hall AL,Drendel HM,Verbrugge JL,et al.Positive cell-free fetal DNA testing for trisomy 13reveals confined placental mosaicism[J].Genet Med,2013,15:729-732.
[21]Pan M,Li FT,Li Y,et al.Discordant results between fetal karyotyping and non-invasive prenatal testing by maternal plasma sequencing in a case of uniparental disomy 21due to trisomic rescue[J].Prenat Diagn,2013,33:598-601.
[22]Choi H,Lau TK,Jiang FM,et al.Fetal aneuploidy screening by maternal plasma DNA sequencing:‘false positive’due to confined placental mosaicism[J].Prenat Diagn,2013,33:198-200.
[23]Lau TK,Jiang FM,Stevenson RJ,et al.Secondary findings from non-invasive prenatal testing for common fetal aneuploidies by whole genome sequencing as a clinical service[J].Prenat Diagn,2013,33:602-608.
[24]van Echten-Arends J,Mastenbroek S,Sikkema-Raddatz B,et al.Chromosomal mosaicism in human preimplantation embryos:a systematic review[J].Hum Reprod Update,2011,17:620-627.
[25]Northrop LE,Treff NR,Levy B,et al.SNP microarray-based 24chromosome aneuploidy screening demonstrates that cleavage-stage FISH poorly predicts aneuploidy in embryos that develop to morphologically normal blastocysts[J].Mol Hum Reprod,2010,16:590-600.
——婴儿纸尿裤是绒毛浆最大的应用市场

