应用高压均质技术制备玉米淀粉-硬脂酸复合物
孟 爽,马 莺,刘天一
(1.哈尔滨工业大学 食品科学与工程学院,150090哈尔滨;2.哈尔滨商业大学轻工学院,150028哈尔滨)
淀粉是由直链淀粉和支链淀粉两种多糖组成的天然高分子聚合物,两种类型的淀粉分子均可与脂肪酸、乳化剂等脂质形成淀粉-脂质复合物,但是以直链淀粉为主.脂质的引入能够改变淀粉的功能和性质,如能够改善淀粉的抗老化性,降低其溶解性及淀粉糊黏度,改变淀粉的消化性等[1-2].因此,淀粉-脂质复合物可作为食品加工中的增稠剂、稳定剂,果冻、布丁等的凝胶形成剂,脂肪替代品,化妆品组分以及药片的赋形剂、糖衣制剂、缓释剂等[1,3-4].
目前淀粉-脂质复合物的制备方法有:加热法、挤压蒸煮法、蒸汽喷射蒸煮法 、冷冻法、二甲亚砜制备法等[1,5-7].加热法是淀粉-脂质复合物制备最常用的方法,在高于淀粉糊化温度条件下,将淀粉与脂肪酸、乳化剂等脂质加去离子水制得热溶液,缓慢冷却,脂质在疏水作用下进入淀粉螺旋疏水腔内部形成复合物.该方法工艺简单方便,但由于脂质在溶液中的溶解度低、分散性差,可形成复合物的直链淀粉质量分数少,复合物形成量较少.因此,淀粉颗粒中直链淀粉的释放量及脂质的溶解度或其在淀粉悬浊液中的分散性是影响淀粉-脂质复合物形成的关键因素.高压均质作为一种常用于淀粉物理改性的动态高压技术可有效解决以上问题.高压作用下淀粉悬浊液高速流过狭窄缝隙时受到剧烈的剪切力、撞击力和强烈的高频振荡,会改变淀粉的黏性,甚至使其结构发生变化.淀粉糊均质处理时会使吸水膨胀的淀粉颗粒破碎,释放出直链淀粉[8],而且均质作用会使脂质在淀粉悬浊液中充分分散[9],因此,高压均质处理利于淀粉-脂质复合物的形成.本文将高压均质技术与加热处理相结合,以硬脂酸作为脂质客体,制备玉米淀粉-硬脂酸复合物,探讨高压均质技术促进玉米淀粉-硬脂酸复合物形成的原因,研究均质条件和硬脂酸添加量对复合物的形成和性质的影响.
1 实验
1.1 实验材料与试剂
玉米淀粉(直链淀粉质量分数25.60%),食品级,长春黄龙食品工业有限公司;硬脂酸、碘化钾、碘均为分析纯.
1.2 仪器与设备
NS1001L-panda超高压纳米均质机,意大利Niro Soavi公司;FW80-1万能粉碎机,天津能斯特公司;TLXJ-IIC低速台式大容量多管离心机,上海安亭科学仪器厂;差示扫描量热仪DSC6,美国PE公司;D/Max2500X射线衍射仪,日本理学公司;UV754紫外可见分光光度计,上海光谱仪器有限公司.
1.3 实验方法
1.3.1 脱脂玉米淀粉的制备
利用索氏抽提法以无水乙醚为有机溶剂,将玉米淀粉回流8 h以去除淀粉中脂肪.待乙醚挥发后,置于40℃干燥24 h,得到干燥的脱脂淀粉.
1.3.2 玉米淀粉-硬脂酸复合物的制备
将硬脂酸溶于乙醇,加入一定量脱脂玉米淀粉,搅拌混合后蒸干乙醇,加入蒸馏水配制淀粉质量分数为10%的淀粉硬脂酸(硬脂酸质量分数为淀粉基的0.5%~5%)混合物悬浊液.于95℃水浴中糊化30 min,糊化后样品冷却至50℃后进行高压均质处理,均质压力为20~120 MPa,均质1~5次.均质后样品缓慢冷却至室温,用50%的乙醇洗涤两次,除去未反应的硬脂酸,干燥、粉碎后过100目筛.未添加硬脂酸的样品进行相同的处理作为对照样.
1.3.3 淀粉-硬脂酸复合物的复合率
应用De Pilli等[5]的方法进行淀粉-脂质复合物复合率的测定.称取2 g碘化钾、1.3 g碘,溶于50 mL蒸馏水中,溶解2 h,定容至100 mL.称取5 g均质后样品,加25 mL蒸馏水于离心管中,用漩涡混合器混合2 min,3 000g离心15 min,取500μL上清液,加入15 mL蒸馏水、2 mL碘溶液,在690 nm测吸光度,确定与碘的结合能力.根据下式计算淀粉-硬脂酸复合物的复合率:

式中:C为淀粉 -硬脂酸复合物的复合率;Areference为未添加硬脂酸的对照样的吸光度;Asample为淀粉-硬脂酸复合物的吸光度.
1.3.4 淀粉糊黏度
将均质后的样品冷却至25℃(不搅拌),应用Brookfield黏度仪(63或64号转子),转子转速30 r/min,测定样品黏度.
1.3.5 X-射线衍射分析
固体粉末样品 X-射线衍射分析,采用Cu靶,石墨单色器、30 kV、30 mA,以扫描速度8°/min、步长 0.02°,在衍射角 2θ为 4°~30°范围扫描测得.
1.3.6 淀粉-硬脂酸复合物热特性
称取淀粉-硬脂酸复合物样品4.0 mg(干基)于铝制坩埚中,并以1∶2的比例加入去离子水,密封后平衡24 h.以空坩埚为参比,加热范围为20~140℃,加热速率为10℃/min.相变参数分别用起始温度(to)、峰值温度(tp)、最终温度(tc)和焓变(ΔH)表示.
1.3.7 数据分析
采用SPSS软件进行数据统计分析,所有数据重复3次,用Origin 8.5软件绘图.
2 结果与分析
2.1 玉米淀粉-硬脂酸复合物复合率分析
2.1.1 均质压力对复合率的影响
图1为不同均质压力处理的淀粉糊的吸光度及淀粉-硬脂酸复合物(均质3次,硬脂酸添加量为1%)的复合率.根据淀粉与碘形成的复合物在690 nm处紫外吸光度值的变化说明高压均质处理对淀粉分子结构的影响.均质后淀粉糊吸光度随均质压力的增大而逐渐增大,淀粉与碘分子的结合能力逐渐增大.均质压力达80 MPa时,与碘分子结合力最大,吸光度为1.45.当均质压力为80~120 MPa时,吸光度变化不大.淀粉在高压均质过程中产生的高速剪切、高频震荡、空穴现象和对流撞击等机械力作用下,一方面使吸水膨胀的淀粉颗粒破碎,释放直链淀粉;另一方面,淀粉在均质过程中部分链发生断裂,随着支链淀粉被打断,直链淀粉质量分数增加,导致淀粉与碘的结合能力增强,吸光度增大[10-11].压力高于 80 MPa时,吸光度变化较小,表明压力继续增大时产生的剪切、震荡和撞击力并不能进一步促进直链淀粉的释放.
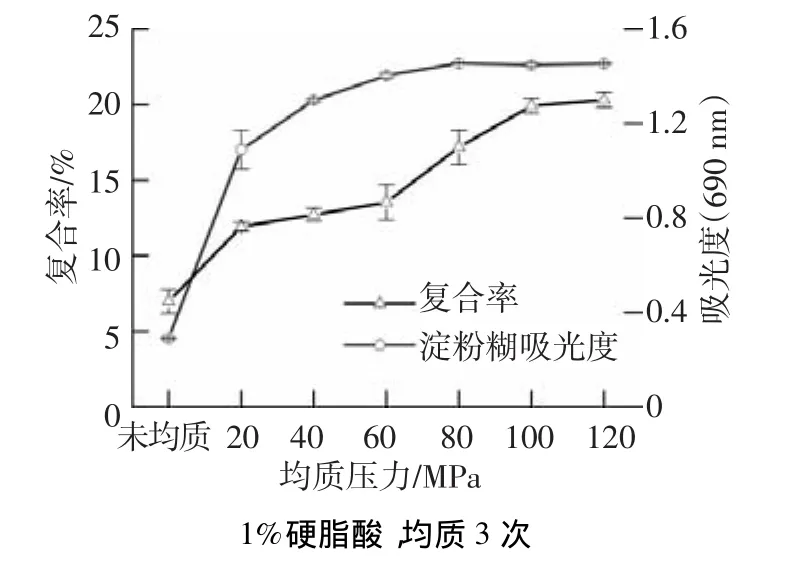
图1 均质压力对玉米淀粉-硬脂酸复合物复合率的影响
硬脂酸在疏水力推动下进入淀粉螺旋的疏水腔形成复合物,由于硬脂酸占据了部分淀粉的螺旋内腔,阻碍其与碘分子的结合,导致吸光度降低.因此,复合率可以用来说明淀粉与硬脂酸络合形成复合物的程度[3,5,12].淀粉-硬脂酸复合物的复合率曲线说明,均质压力小于100 MPa时,随着均质压力的升高,淀粉-硬脂酸复合物的复合率迅速增大.在100 MPa时复合率达19.92%,而均质压力由100 MPa升高到120 MPa时,复合率增幅较小.这一变化趋势与高压均质对淀粉与碘结合能力的影响一致.高压均质能够促进淀粉与硬脂酸形成复合物的原因为:一方面,硬脂酸在水中的溶解度较低,导致其在糊化淀粉体系中分散性较差,而高压均质过程产生的高剪切力、高频震荡、空穴现象和对流撞击保证硬脂酸微粒均匀地分布于糊化淀粉中,提高了淀粉与硬脂酸接触的概率;另一方面,与硬脂酸生成复合物的主要是直链淀粉[1,13],高压均质作用使得破碎的淀粉颗粒中释放更多的直链淀粉,进而促进复合物的形成.
2.1.2 均质次数对复合率的影响
图2显示了均质压力100 MPa、硬脂酸质量分数为1%时,均质次数对淀粉糊吸光度及淀粉-硬脂酸复合物复合率的影响.淀粉-碘复合物的吸光度在均质1~2次时迅速增大,即淀粉与碘分子的结合能力增大.但当均质次数超过3次后,吸光度增幅较小.表明均质次数高于3次时,继续增加均质次数并不能使直链淀粉的释放量无限增大.均质次数对淀粉-硬脂酸复合物复合率的影响与对淀粉糊吸光度的影响结果相似.均质3次后,吸水膨胀的淀粉颗粒已经充分破碎、降解,硬脂酸也在淀粉糊中充分分散,故复合率变化不大.
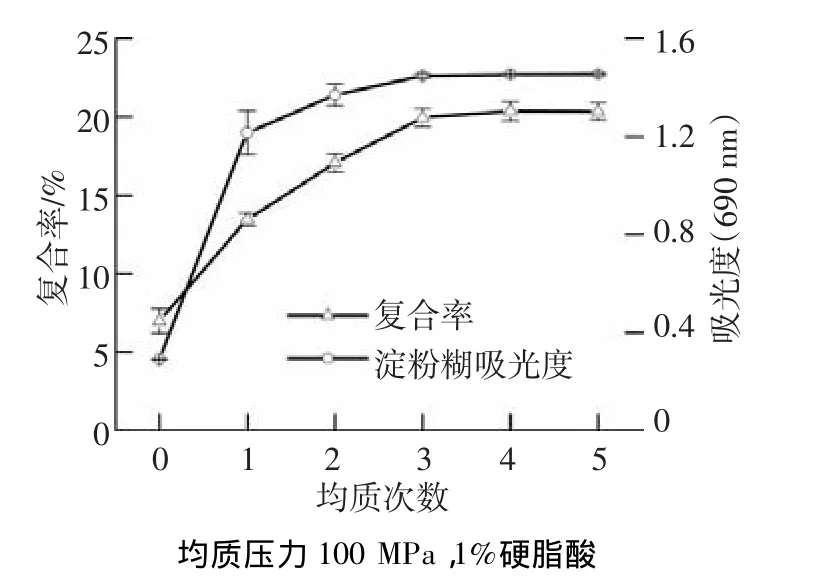
图2 均质次数对玉米淀粉-硬脂酸复合物复合率的影响
2.1.3 硬脂酸添加量对复合率的影响
图3为均质压力100 MPa、均质处理3次时,不同硬脂酸添加量的淀粉-硬脂酸复合物的复合率.当硬脂酸的添加量由0.5%增大到3%时,复合率由7.25%迅速增大到54.01%.当添加量高于3%时,复合率的变化趋于平缓.硬脂酸添加量越高,直链淀粉与其结合的概率越大,复合率升高.但由于硬脂酸在水中的溶解度较低,硬脂酸增加到一定量时会产生聚集[14],影响复合物的形成.因此,硬脂酸质量分数为3%~5%时,复合率变化不大.
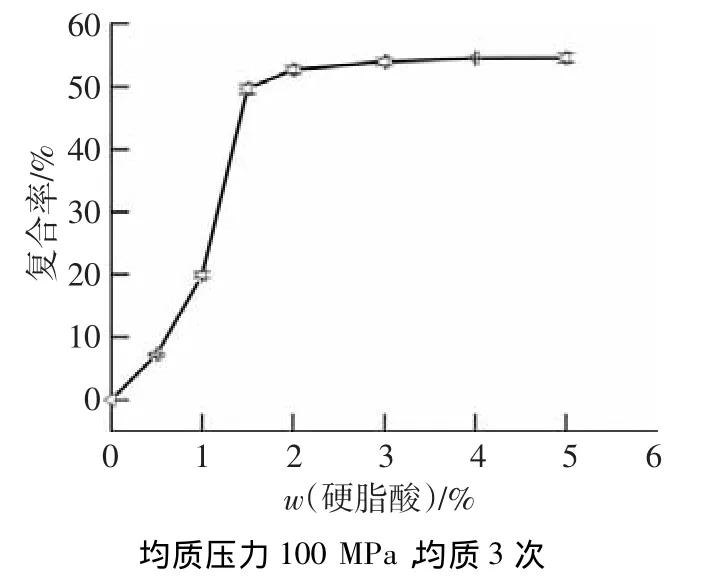
图3 硬质酸添加量对玉米淀粉-硬脂酸复合物复合率的影响
Bhatnagar等[15]将玉米淀粉中添加4%硬脂酸,利用挤压蒸煮法,在挤压温度110℃、螺杆转速110 r/min、19%水分质量分数条件下,制备得到的玉米淀粉-硬脂酸复合物的复合率为41.0%.Kawai等[12-14]应用加热法分别利用马铃薯淀粉和小麦淀粉与硬脂酸制备淀粉-硬脂酸复合物,其最大复合率分别为 30.9%和 28.0%.本实验中均质压力100 MPa、均质3次、硬脂酸添加量3%,得到的玉米淀粉-硬脂酸复合物的复合率为54.01%,高于Kawai等[12,14-15]的研究结果.高压均质处理利于直链淀粉的释放,提高了淀粉与硬脂酸接触概率,促进复合物的形成,是复合率提高的主要原因.
2.2 淀粉糊黏度分析
2.2.1 均质压力对黏度的影响
图4为不同均质压力处理的玉米淀粉糊和玉米淀粉-硬脂酸复合物(硬脂酸添加量为1%)的黏度.高压均质过程中,吸水膨胀的淀粉颗粒在高剪切、高频震荡、空穴现象和对流撞击等机械力的作用下使淀粉颗粒破碎,甚至导致淀粉分子链的断裂,降低了淀粉的相对分子质量,因此,淀粉糊黏度随均质压力的升高而降低.与淀粉糊黏度的变化相比,均质压力对淀粉-硬脂酸复合物黏度的影响更为显著.随着均质压力的升高,玉米淀粉-硬脂酸复合物生成量不断增加,黏度迅速降至1 Pa·s.淀粉-脂质复合物的形成改变了淀粉的分子结构,由于硬脂酸进入淀粉螺旋疏水腔内,使得淀粉尤其是直链淀粉由原来随机的无规则卷曲结构转变为舒展的单螺旋结构,直链淀粉的流体力学体积降低,导致黏度下降[16].
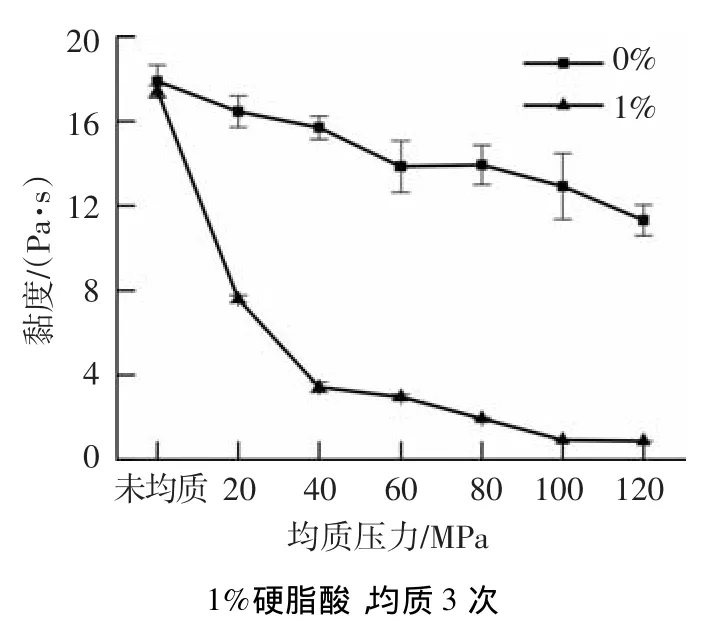
图4 均质压力对淀粉糊和淀粉-硬脂酸复合物黏度的影响
2.2.2 均质次数对黏度的影响
均质次数对淀粉糊和淀粉-硬脂酸复合物黏度的影响如图5所示.随着均质次数的增加,淀粉糊黏度降低.当均质1次时,黏度迅速由未均质的 17.9 Pa·s降为 13.6 Pa·s.但当均质次数继续增加时,黏度降低速度减慢.随均质次数增加,淀粉-硬脂酸复合物黏度的变化规律与淀粉糊相似.由于均质1次时就会形成大量复合物,导致黏度大幅度下降,由未均质样品的17.4 Pa·s降为 1 Pa·s.继续增加均质次数对复合物形成的影响较小,故黏度变化减缓.
2.2.3 硬脂酸添加量对黏度的影响
图6显示了不同硬脂酸添加量对玉米淀粉-硬脂酸复合物黏度的影响.随着硬脂酸添加量的逐渐增大,黏度先显著降低.当硬脂酸添加量增大到1.5%后,黏度又略有升高.这是由于随着硬脂酸添加量的增大,形成更多的玉米淀粉-硬脂酸复合物,引起黏度迅速下降.然而随着玉米淀粉-硬脂酸复合物量的增加,更多硬脂酸的疏水端进入淀粉螺旋内部,位于螺旋外部的羟基会与相邻分子形成氢键,引起黏度小幅升高[16-17].均质压力、均质次数及硬脂酸质量分数均会影响玉米淀粉-硬脂酸复合物黏度,这一结果与前面复合率变化规律一致,进一步说明高压均质处理有助于玉米淀粉-硬脂酸复合物的形成.
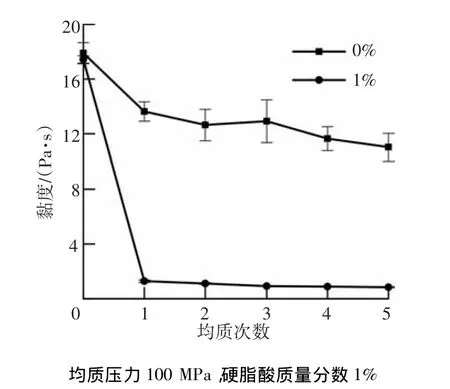
图5 均质次数对淀粉糊及淀粉-硬脂酸复合物黏度的影响
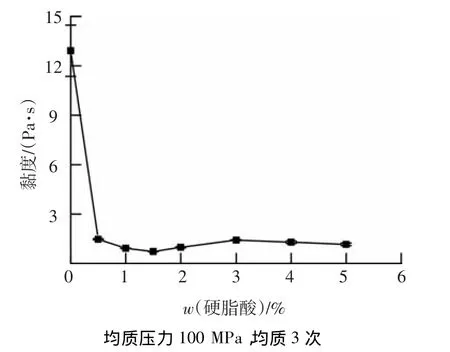
图6 硬脂酸添加量对淀粉-硬脂酸复合物黏度的影响
2.3 淀粉-硬脂酸复合物的X-射线衍射分析
图7为不同均质条件及硬脂酸添加量制备的玉米淀粉-硬脂酸复合物的X-射线衍射图谱.将其与原普通玉米淀粉的图谱进行比较,发现玉米淀粉-硬脂酸复合物几乎失去了普通玉米淀粉A型晶型的所有特征峰 (14.9°,17.2°,18.1°和22.9°),而在7.4°,12.9°和 19.8°出现衍射峰,这正是淀粉-脂质复合物形成的V型晶型的特征峰,说明硬脂酸进入淀粉的单螺旋内部形成络合物[18].随着压力的增高、均质次数的增多、硬脂酸添加量的增大,V型特征峰的强度逐渐增大(12.9°和 19.8°两个特征峰的强度变化尤为明显).表明玉米淀粉-硬脂酸复合物生成量增多,且复合物X-射线衍射特征峰强度的变化规律与复合率结果一致,再一次证明高压均质处理会促进淀粉与硬脂酸形成复合物.
2.4 淀粉-硬脂酸复合物热特性分析
表1~3分别为不同均质压力、均质次数和硬脂酸添加量制备的淀粉-硬脂酸复合物的热特性参数.结果表明,不同条件制备的复合物均在93~115℃区间内产生吸热峰,峰值在103~106℃范围内,而均质压力、均质次数和硬脂酸添加量均对其没有显著影响.Putseys 等[1,19]的研究结果均表明淀粉脂质复合物的吸热特征峰为90~115℃范围内,与本实验的结果一致.
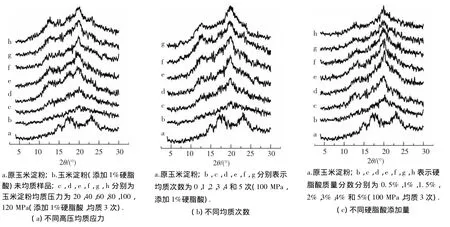
图7 不同均质条件及硬脂酸添加量制备的玉料淀粉-硬脂酸复合物X-射线衍射图

表1 不同均质压力制备的玉米淀粉-硬脂酸复合物(硬脂酸添加量1%,均质3次)热特性

表2 不同均质次数制备的玉米淀粉-硬脂酸复合物(均质压力100 MPa,硬脂酸添加量1%)热特性

表3 不同硬脂酸添加量制备的玉米淀粉-硬脂酸复合物(均质压力100 MPa,均质3次)热特性
随着均质压力升高和均质次数的增加,复合物热焓值由 1.89 J/g分别增至 3.26和 3.25 J/g.同样,硬脂酸的添加量对复合物热焓值也有显著影响,焓值随着硬脂酸添加量的增大而升高,当添加 5%的硬脂酸时,热焓值达 5.93 J/g.Eliasson[20]的研究表明,热焓值的大小可以用来衡量复合物的生成量.因此,焓值越高说明生成越多的淀粉-脂质复合物,这进一步说明均质压力、均质次数和硬脂酸添加量均会影响玉米淀粉-硬脂酸复合物的生成.
3 结论
1)玉米淀粉与硬脂酸在高压均质的作用下可以生成玉米淀粉-硬脂酸复合物,高压均质导致淀粉颗粒的破碎、降解,获得更多直链淀粉,同时提高硬脂酸与直链淀粉的接触机会.因此,高压均质处理促进了淀粉-硬脂酸复合物的生成.硬脂酸添加量为3%、100 MPa均质3次时,复合率可达54.01%.玉米淀粉-硬脂酸复合物的复合率越高,黏度越低.
2)X-射线衍射图在 7.4°,12.9°和 19.8°出现淀粉-脂质复合物V型晶型的特征峰,表明玉米淀粉与硬脂酸在高压均质的作用下生成了具有V型结构的玉米淀粉-硬脂酸复合物.均质压力增大、均质次数和硬脂酸量增多,生成的复合物增多,V型特征峰强度增大.
3)对玉米淀粉-硬脂酸复合物的热特性研究发现在93~115℃范围内出现的吸热峰,为淀粉脂质复合物的特征吸热峰.增大均质压力、均质次数和硬脂酸添加量,复合物热焓值升高.
[1] PUTSEYS J A,LAMBERTS L,DELCOUR J A.Amylose-inclusion complexes:formation,identity and physico-chemical properties[J].Journal of Cereal Science,2010,51(3):238-247.
[2] ELIASSON A C,KROG N.Physical properties of amylose-monoglyceride complexes[J].Journalof Cereal Science,1985,3(3):239-248.
[3] GURAYA H S,KADAN R S,CHAMPAGNE E T.Effect ofrice starch-lipid complexeson in vitro digestibility,complexing index,and viscosity [J].Cereal Chemistry,1997,74(5):561-565.
[4]SINGH M,BYARS J A.Starch-lipid composites in plain set yogurt[J].International Journal of Food Science and Technology,2009,44(1):106-110.
[5]PILLIDE T,JOUPPILA K,IKONEN J,et al.Study on formation of starch-lipid complexes during extrusioncooking ofalmond flour[J].JournalofFood Engineering,2008,87(4):495-504.
[6] FANTA G F,KENAR J A,BYARS J A,et al.Properties of aqueous dispersions of amylose-sodium palmitate complexes prepared by steam jet cooking[J].Carbohydrate Polymers,2010,81(3):645-651.
[7]ZABAR S,LESMES U,KATZ I,et al.Studying different dimensions of amylose-long chain fatty acid complexes:molecular,nano and micro level characteristics[J].Food Hydrocolloids,2009,23(7):1918-1925.
[8]CHE L M,WANG L J,LI D,et al.Starch pastes thinning during high-pressure homogenization [J].Carbohydrate Polymers,2009,75(1):32-38.
[9] LESMESU, BARCHECHATHJ, SHIMONIE.Continuous dual feed homogenization for the production of starch inclusion complexes for controlled release of nutrients[J].Innovative Food Science & Emerging Technologies,2008,9(4):507-515.
[10]WANG B,LI D,WANG L J,et al.Effect of high-pressure homogenization on microstructure and rheological properties of alkali-treated high-amylose maize starch[J].Journal of Food Engineering,2012,113(1):61-68.
[11]NILSSON L,LEEMAN M,WAHLUND K G,et al.Mechanical degradation and changes in conformation of hydrophobically modified starch [J].Biomacromolecules,2006,7(9):2671-2679.
[12]KAWAI K,TAKATO S,SASAKI T,et al.Complex formation,thermal properties,and in-vitro digestibility of gelatinized potato starch-fatty acid mixtures[J].Food Hydrocolloids,2012,27(1):228-234.
[13]MORRISON W R,LAW R V,SNAPE C E.Evidence for inclusion complexes of lipids with v-amylose in maize,rice and oat starches[J].Journal of Cereal Science,1993,18(2):107-109.
[14]TANG M C,COPELAND L.Analysis of complexes between lipids and wheat starch [J].Carbohydrate Polymers,2007,67(1):80-85.
[15]BHATNAGAR S,HANNA M A.Amylose lipid complexformation during single-screw extrusion of various corn Starches[J].Cereal Chemistry,1994,71(6):582-587.
[16]RAPHAELIDES S N.Rheological studies of starch fattyacid gels[J].Food Hydrocolloids,1993,7(6):479-495.
[17]RAPHAELIDES S N,GEORGIADIS N.Effect of fatty acids on the rheological behaviour of maize starch dispersions during heating [J]. Carbohydrate Polymers,2006,65(1):81-92.
[18]SHOGREN R L,FANTA G F,FELKER F C.X-ray diffraction study of crystal transformations in spherulitic amylose/lipid complexes from jet-cooked starch [J].Carbohydrate Polymers,2006,64(3):444-451.
[19]KARKALAS J,MA S,MORRISON W R,et al.Some factors determining the thermal-properties of amylose inclusion complexes with fatty-acids[J].Carbohydrate Research,1995,268(2):233-247.
[20]ELIASSON A C.Starch-lipid interactions studied by differential scanning calorimetry[J].Thermochimica Acta,1985,95(2):369-374.

