干旱胁迫对桔梗生长特性、生理特性及总皂苷成分积累的影响*
张 坚,张 博,周文贵,尹 飞,马 琳,李兴林
·中药研究·
干旱胁迫对桔梗生长特性、生理特性及总皂苷成分积累的影响*
张坚1,2,3,张博1,周文贵1,尹 飞1,马 琳1,李兴林2,3
(1.天津中医药大学中药学院,天津300193;2.天津科技大学生物工程学院,天津300457;3.天津科技大学工业微生物教育部重点实验室,天津300457)
[目的]探讨干旱胁迫对桔梗种子萌发及幼苗生长的影响,并初步分析干旱胁迫下桔梗生长发育的生理机制和对总皂苷成分的诱导影响。[方法]分别采用5%、10%、15%、20%、25%聚乙二醇6000(PEG6000)处理桔梗种子及幼苗,测量种子萌发及幼苗生长过程中的生长性状指标和生理指标,以及次生产物桔梗总皂苷成分含量。[结果]随着PEG胁迫浓度的增加,桔梗种子萌发和幼苗生长受到抑制。种子发芽率、相对发芽率显著降低;幼苗各生理指标中脯氨酸,丙二醛和总皂苷含量呈上升趋势,超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)活性均不同程度地表现为先上升后下降的趋势。[结论]桔梗能够耐受一定程度的干旱胁迫,适度的干旱胁迫有助于桔梗幼苗总皂苷的积累。
桔梗;干旱胁迫;生理特性;生长特性;桔梗总皂苷
DOI:10.11656/j.issn.1672-1519.2015.11.12
桔梗[Platycodon grandiflorum(Jacq.)A.DC.]为桔梗科桔梗属植物,属多年生双子叶草本植物,是一种药、食、赏兼用的植物[1]。入药部位为根,味苦,性平,归肺、胃经,具有宣肺、利咽、祛痰、排脓的功效。
桔梗为中国北方传统的道地药材,对其进行干旱胁迫的研究有助于掌握该药用植物在中国北方尤其是较干旱地区大面积种植的可行性,初步分析干旱胁迫对桔梗幼苗生长的生理机制和对总皂苷积累的影响,为通过干旱胁迫诱导桔梗皂苷类成分,提高桔梗药材品质进行研究。
本实验选用聚乙二醇(PEG)模拟干旱胁迫处理。聚乙二醇作为一种高分子渗透剂,可以人为的限制水分进入种子及根系的速率从而控制种子和根系的吸水速率。目前,实验室条件下多采用PEG6000高渗溶液来模拟干旱胁迫,这种方法因具有简单易行、条件容易控制、重复性好、实验周期短等优点,已被广泛应用到多种经济作物抗旱性研究[2]。
1 材料与方法
1.1材料
1.1.1植物材料桔梗种子为当年干燥成熟种子[购于安国药材市场,经张坚副教授鉴定为药用植物桔梗(Platycodon grandiflorum)的种子];桔梗幼苗为生长2个月的具有4枚真叶的桔梗实生苗。
1.1.2主要试剂及药品浓硫酸(分析纯),氢氧化钠(分析纯),甲醇(分析纯),乙醇(分析纯),蒸馏水(自制)。
1.1.3主要仪器XCA-80001电热鼓风干燥箱,XMTB数显调节恒温水浴锅,DU-530型紫外可见分光光度计分析仪,电子天平。
1.2方法
1.2.1种子萌发实验取成熟饱满、大小一致的桔梗种子,0.5%高锰酸钾(KMnO4)消毒20 min,蒸馏水冲洗5~6次,用蒸馏水浸泡24 h,备用。选择洁净烘干的培养皿(直径9 cm),将种子均匀摆放于垫有2层纱布1层滤纸的培养皿中,每个培养皿100粒,依次加入等量不同浓度梯度的PEG6 000溶液(质量浓度分别为5%,10%,15%,20%,25%),蒸馏水(CK)为对照组,以纱布和滤纸完全润湿为宜,每个浓度下设3个重复,称质量并记录。在恒温培养箱中进行培养(恒温25℃,相对湿度60%,光照1 500 lx,每天光照时间12 h)。在种子萌发实验中,每3 d用不同浓度的处理液处理种子,处理液以润湿滤纸为宜,倾斜倒出多余液体,避免多余液体淹没种子影响发芽。从萌发的第1天开始(萌发标准为胚根伸长0.2 cm作为发芽标志),对每个编号处理逐日统计种子发芽数,计算发芽率、相对发芽率和每日发芽率,测量胚根和胚轴长度。整个实验周期为8 d。
1.2.2幼苗的生长实验用5个相同规格的穴盆(长54 cm,宽27 cm,高6cm)装入等量的基质(珍珠岩∶蛭石∶营养土=1∶1∶4),将桔梗种子播种在育种盆中,每格子种5株。出苗后间苗,每盆留生长一致、分布均匀的幼苗。待幼苗株高6~8 cm时进行干旱胁迫处理。分别用浓度为5%、10%、15%、20%、25%的PEG6000溶液进行胁迫处理,每组处理10株幼苗,3次重复。PEG6000在处理时采用根部浇灌法,每次处理用量约200 mL左右,以浇透为止(以少量PEG6000渗出育种盆底部为标准),处理时间为傍晚,每日处理1次。PEG6000处理后每天进行观察,记录幼苗在生长期间的形态反应和胁迫表现。处理9 d后测定生理指标和桔梗总皂苷含量,取样时选取整个植株。
1.2.3指标测定
1.2.3.1种子萌发及幼苗生长性状相关指标测定种子萌发实验以胚根伸长0.2 cm作为发芽标志,每天定时记录种子萌发数,具体计算公式如下:
总萌发率Gr=n/N×100%,式中n为萌发种子数,N为供试种子数;
相对发芽率RGr=干旱胁迫下的发芽率/水分充足下的发芽率×100%
每日发芽率DGr=m/N×100%,式中m为当日萌发种子数,N为供试种子数。
种子萌发实验中胚根和胚轴长度以胁迫后(8 d)测量。
幼苗胁迫实验以胁迫完成后(9 d),观察幼苗生长状态,并测量植株高度、根长和真叶数目。
1.2.3.2生理指标测定过氧化物酶(POD)的活性测定参照李合生[3]的方法,以每分钟OD470 nm增加0.01为1个酶活力单位[U(/g·min)]。超氧化物歧化酶(SOD)采用氮蓝四唑(NBT)显色法测定。过氧化氢酶(CAT)采用紫外吸收法,以每分钟内A240下降0.1为一个酶活力单位[U(/g·min)]。脂质过氧化产物丙二醛(MDA)含量采用硫代巴比妥酸法测定。脯氨酸(Pro)含量采用酸式茚三酮显色法测定[4]得回归方程=0.032 3X-0.005 2(r2=0.998 3)。
1.2.3.3桔梗总皂苷含量测定桔梗总皂苷含量测定采用香草醛-硫酸显色比色法[5]。取桔梗粗粉约1 g,精密称重,置小型索氏提取器中,以乙醚回流提取2 h,弃去醚液;残渣低温挥尽乙醚,再加16倍量甲醇,超声提取(250 W,40 kHz)2次,每次30 min,滤过,合并两次滤液,水浴浓缩,甲醇定容至25 mL容量瓶,取1 mL置10 mL具塞磨口试管中,70℃水浴蒸发至干燥,精密加入10%香草醛试液0.5 mL和60%硫酸5 mL,摇匀,60℃水浴加热15 min,冰水浴中冷却3 min,随行试剂作空白,冷后470 nm处测定得回归方程=241.58X-0.056 3(r2=0.994 1)。
1.2.4数据处理采用SPSS 18.0统计软件对数据进行方差分析,以Duncan’s新复级差法比较不同处理间的差异性,用Excel软件进行制图,Word文档进行制表。
2 结果与分析
2.1干旱胁迫对桔梗种子发芽率的影响发芽率反映了种子在适宜条件下的萌发能力,是种子活力水平的体现[6-7]。由表1可见,随着PEG浓度的不断升高,发芽率依次变低,当PEG浓度为20%时,发芽率与对照组相比显著降低到9.12%,说明20%PEG对桔梗种子萌发率的影响显著,在此浓度下,桔梗种子的萌发受到了严重抑制。发芽实验未见低浓度PEG对种子萌发有促进的作用,这与多数耐干旱植物的研究不相符[8]。这一现象推测与选种和种子前期处理有关。PEG浓度在5%~15%范围内桔梗种子发芽率均超过50%,说明PEG浓度在15%的干旱胁迫是桔梗种子萌发耐受的临界值。
每日发芽率统计结果(图1)表明,经不同浓度PEG处理后,桔梗种子的每日发芽率总体上随着天数的增加均有逐渐下降的趋势。5%、10%PEG溶液处理的发芽高峰期出现在第1天,与对照组一致;15%PEG溶液处理的发芽高峰期出现在第3天,较对照组推迟2 d。说明一定浓度范围内的干旱胁迫会推迟桔梗种子的萌发。
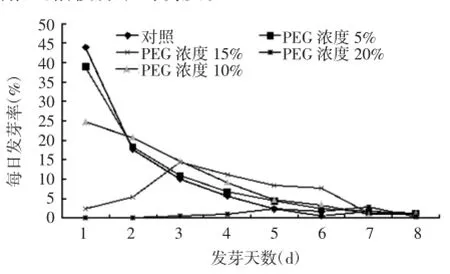
图1 不同浓度PEG对桔梗种子每日发芽率的影响Fig.1Effects of concentrations of PEG on daily germination rate of ballonflower seeds
表1 不同浓度PEG对桔梗种子发芽率的影响(±s)Tab.1 Effects of concentrations of PEG on germination rate of ballonflower seeds(±s)%
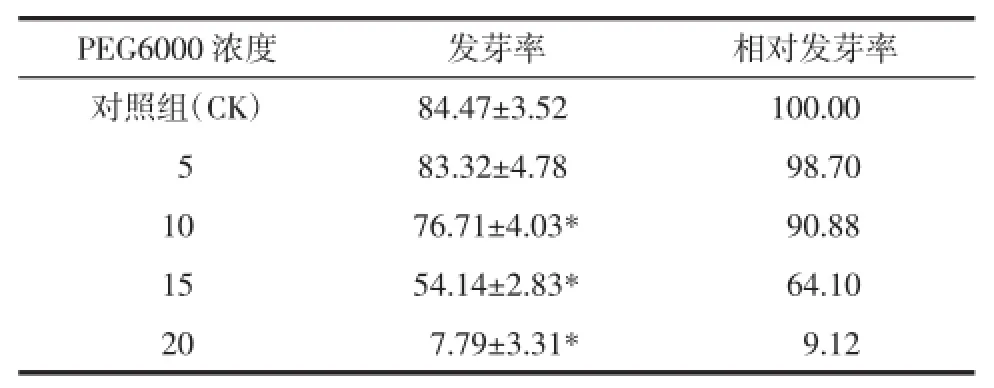
表1 不同浓度PEG对桔梗种子发芽率的影响(±s)Tab.1 Effects of concentrations of PEG on germination rate of ballonflower seeds(±s)%
注:与对照组(CK)比较,*P<0.05。
PEG6000浓度发芽率相对发芽率对照组(CK)84.47±3.52a100.00 0583.32±4.78a098.70 1076.71±4.03*090.88 1554.14±2.83*064.10 2007.79±3.31*009.12
2.2干旱胁迫对桔梗种子胚根和胚轴生长的影响种子萌发后,胚根和胚轴的延伸反映出植物定居成苗的特性。由表2可知,桔梗种子在PEG胁迫处理下胚根和胚轴的长度与对照组差异显著,且随着干旱胁迫的增强,对胚根、胚轴生长的抑制作用也不断增强。此外,实验中还发现干旱胁迫对胚轴的抑制作用要明显大于胚根,说明干旱胁迫下胚轴的发育比胚根更敏感。
表2 不同浓度PEG对桔梗种子胚轴和胚根生长的影响(±s)Tab.2 Effects of concentrations of PEG on daily germination rate of ballonflower seeds(±s)
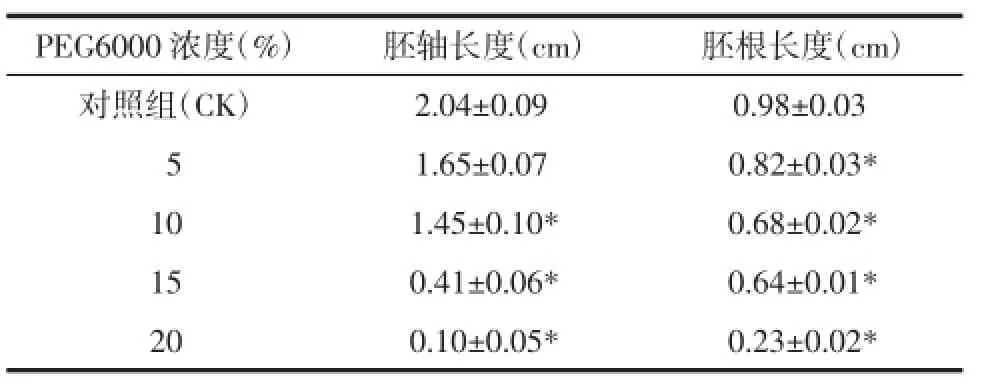
表2 不同浓度PEG对桔梗种子胚轴和胚根生长的影响(±s)Tab.2 Effects of concentrations of PEG on daily germination rate of ballonflower seeds(±s)
注:与对照组(CK)比较,*P<0.05。
PEG6000浓度(%)胚轴长度(cm)胚根长度(cm)对照组(CK)2.04±0.09a0.98±0.03a051.65±0.07a0.82±0.03* 101.45±0.10*0.68±0.02* 150.41±0.06*0.64±0.01* 200.10±0.05*0.23±0.02*
2.3干旱胁迫对桔梗幼苗生长的影响见表3。由表3可知,不同浓度干旱胁迫幼苗生长状态存在差异。实验处理后对植株进行观察,发现在短期内(2 d之内)不会出现可见性伤害症状。处理后第3天出现可见性伤害,表现在叶片末梢的黄化上,随干旱胁迫程度的加强黄化程度加深[9]。在接下来的几天内,外围叶片已有部分枯萎、皱缩,整个植株已开始萎蔫,叶片黄化畸形,干旱胁迫下出现死苗的现象。低浓度干旱胁迫下新生小叶仍能正常生长,但是长势减弱。
2.4干旱胁迫对桔梗幼苗生理指标的影响
2.4.1脯氨酸(Pro)含量Pro是植物体内重要的渗透调节物质,其含量的增减在一定程度上反映植物受到干旱胁迫的情况[10]。由表4所示,随PEG浓度的增加,Pro的含量呈现增加的趋势,PEG处理的5组 Pro含量均高于对照组,25%PEG组的Pro含量累积明显高于对照组及其他处理组,是对照组的3.62倍。
表3 不同浓度PEG对桔梗幼苗生长的影响(±s)Tab.3 Effects of concentrations of PEG on the growth of ballonflower seedlings(±s)
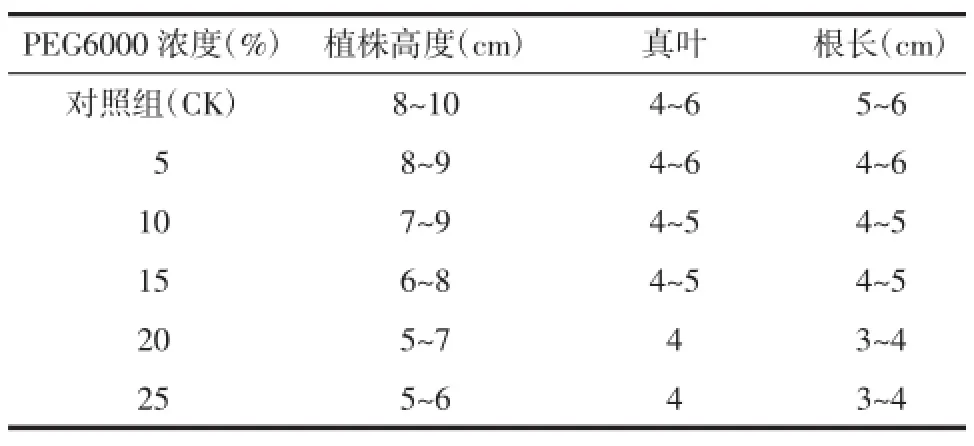
表3 不同浓度PEG对桔梗幼苗生长的影响(±s)Tab.3 Effects of concentrations of PEG on the growth of ballonflower seedlings(±s)
PEG6000浓度(%)植株高度(cm)对照组(CK)8~10 058~9 107~9 156~8根长(cm)5~6 4~6 4~5 4~5 205~743~4 255~643~4真叶4~6 4~6 4~5 4~5
表4 不同浓度PEG对桔梗幼苗中Pro含量的影响(±s)Tab.4 Effects of concentrations of PEG on proline contents of ballonflower seedlings(±s)
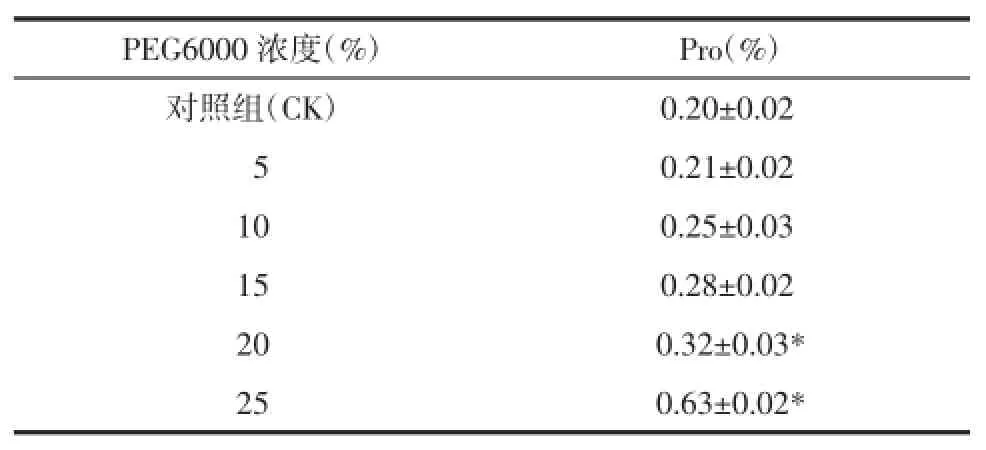
表4 不同浓度PEG对桔梗幼苗中Pro含量的影响(±s)Tab.4 Effects of concentrations of PEG on proline contents of ballonflower seedlings(±s)
注:与对照组(CK)比较,*P<0.05。
PEG6000浓度(%)Pro(%)对照组(CK)0.20±0.02c050.21±0.02c100.25±0.03c150.28±0.02b200.32±0.03* 250.63±0.02*
2.4.2MDA含量植物在逆境胁迫下会出现膜脂过氧化反应。MDA含量高低可以表示脂质过氧化程度和膜系统受伤害程度。在一定胁迫浓度内,细胞的各种保护机制使得MDA含量维持在一定的水平,但胁迫浓度超过特定阀值后,细胞内代谢失调,自由基积累,膜脂过氧化作用加大,MDA含量升高[11-12]。由表5可知,随着PEG浓度的增加,MDA含量呈现增加的趋势,25%PEG处理组MDA含量高于其他组,说明其胁迫程度最深,伤害程度最大。
表5 不同浓度PEG对桔梗幼苗中MDA含量的影响(±s)Tab.5 Effects of concentrations of PEG on MDA contents of ballonflower seedlings(±s)
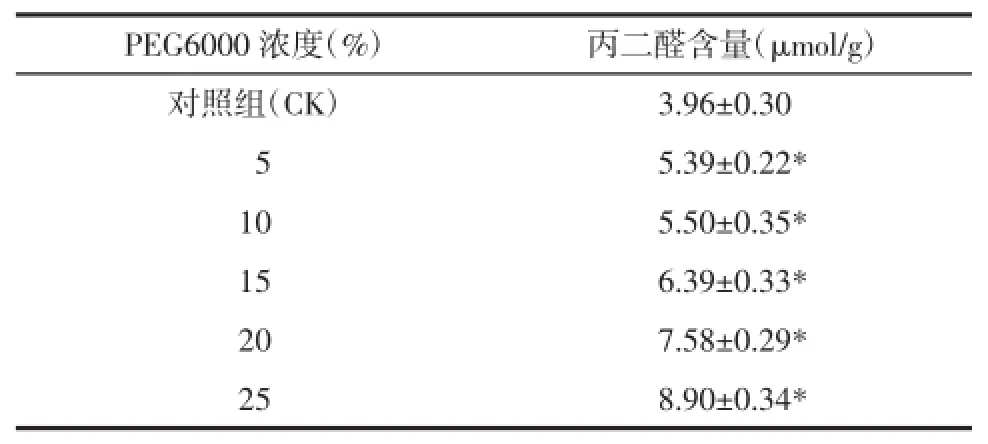
表5 不同浓度PEG对桔梗幼苗中MDA含量的影响(±s)Tab.5 Effects of concentrations of PEG on MDA contents of ballonflower seedlings(±s)
注:与对照组(CK)比较,*P<0.05。
PEG6000浓度(%)丙二醛含量(μmol/g)对照组(CK)3.96±0.30* 055.39±0.22* 105.50±0.35* 156.39±0.33* 207.58±0.29* 258.90±0.34*
2.4.3POD活性干旱胁迫对桔梗植株中POD活性的影响表现为先升后降的趋势,见表6。PEG浓度为20%时达到最高值,继续增加PEG浓度,POD活力开始下降。POD是植物体内清除自由基的重要保护酶,能将过氧化氢(H2O2)转变为氧化氢(H2O)和氧气(O2)。本实验中,植物体通过提高POD活力来清除植物体由于干旱胁迫产生的活性氧,减轻活性氧的伤害,帮助植物体维持在一定的水平[13-15];但随着胁迫程度的增加,超过对活性氧的清除的范围值,保护酶活性就会下降,推测其受到活性氧的损害。
表6 不同浓度PEG对桔梗幼苗中POD活性的影响(±s)Tab.6 Effects of concentrations of PEG on POD activity of ballonflower seedlings(±s)
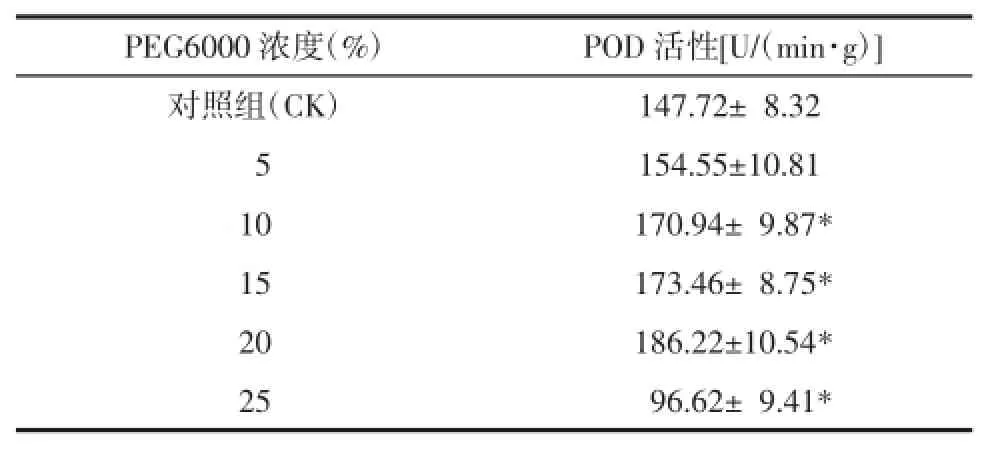
表6 不同浓度PEG对桔梗幼苗中POD活性的影响(±s)Tab.6 Effects of concentrations of PEG on POD activity of ballonflower seedlings(±s)
注:与对照组(CK)比较,*P<0.05。
PEG6000浓度(%)POD活性[U/(min·g)]对照组(CK)147.72±08.32e05154.55±10.81c10170.94±09.87* 15173.46±08.75* 20186.22±10.54* 25096.62±09.41*
2.4.4SOD活性SOD是生物体内重要的抗氧化酶,它可对抗与阻断因氧自由基对细胞造成的损害,将O2-清除氧化成H2O2和O2[15-18]。由表7可知,本实验中SOD活性变化趋势与POD活性变化趋势大体相同。随着PEG浓度的增加,SOD活性的变化为先升再降的趋势,PEG浓度为15%时达到最高值。这说明在PEG浓度较低情况下,SOD活力可以维持在一个较高的水平,避免活性氧的大量积累,减轻活性氧引起的膜伤害[18-19];但过强的干旱胁迫会导致SOD活性受到抑制。
表7 不同浓度PEG对桔梗幼苗中SOD活性的影响(±s)Tab.7 Effects of concentrations of PEG on SOD activity of ballonflower seedlings(±s)
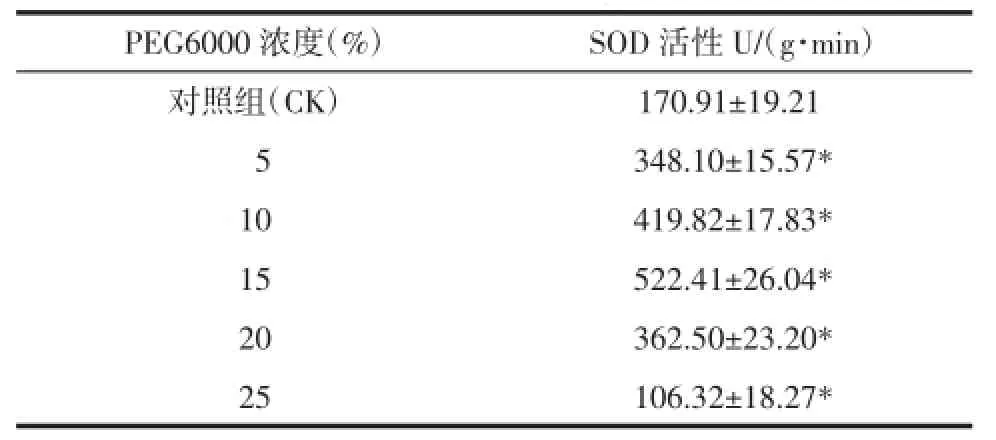
表7 不同浓度PEG对桔梗幼苗中SOD活性的影响(±s)Tab.7 Effects of concentrations of PEG on SOD activity of ballonflower seedlings(±s)
注:与对照组(CK)比较,*P<0.05。
PEG6000浓度(%)SOD活性U/(g·min)对照组(CK)170.91±19.21d05348.10±15.57* 10419.82±17.83* 15522.41±26.04* 20362.50±23.20* 25106.32±18.27*
2.4.5CAT活性CAT也是植物体内细胞清除H2O2的关键酶之一,能将H2O2转变为H2O和O2[15-18]。由表8可知,随着PEG浓度的增加,CAT活性的变化呈现先升再降的趋势,PEG浓度为20%时达到最高值。
表8 不同浓度PEG对桔梗幼苗中CAT活性的影响(±s)Tab.8 Effects of concentrations of PEG on CAT activity of ballonflower seedlings(±s)
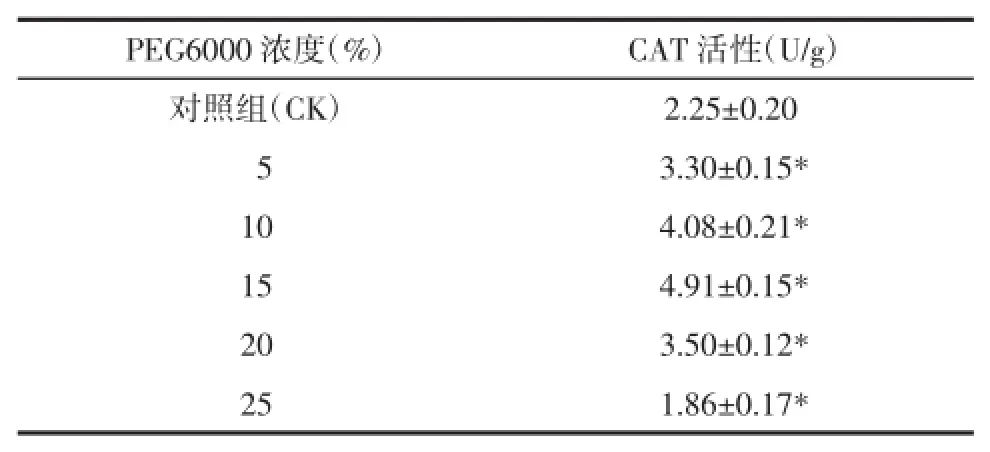
表8 不同浓度PEG对桔梗幼苗中CAT活性的影响(±s)Tab.8 Effects of concentrations of PEG on CAT activity of ballonflower seedlings(±s)
注:与对照组(CK)比较,*P<0.05。
PEG6000浓度(%)CAT活性(U/g)对照组(CK)2.25±0.20d053.30±0.15* 104.08±0.21* 154.91±0.15* 203.50±0.12* 251.86±0.17*
2.5桔梗总皂苷含量由表9可知,经PEG胁迫处理的实验组中桔梗总皂苷含量均高于对照组;实验组中桔梗总皂苷含量在一定胁迫范围内(PEG浓度5%~20%)随干旱胁迫程度升高而升高,20%PEG浓度处理下桔梗总皂苷含量最高,为对照组(CK)的1.67倍,这一实验结果表明适当的增加干旱胁迫可以有效地诱导桔梗皂苷的生物合成,短时间内即可显著的增加桔梗总皂苷含量[20]。这为今后通过干旱胁迫手段提高桔梗药材质量提供参考,如可以使桔梗在采收前八九天适当停水干旱处理以提高植物皂苷产量。此外,实验中还发现当PEG浓度达到25%时,桔梗总皂苷含量突然下降,推测是由于其受到严重胁迫使植物参与皂苷类成分生物合成的相关酶活性受到抑制所致。
表9 不同浓度PEG对桔梗幼苗中总皂苷含量的影响(±s)Tab.9 Effects of concentrations of PEG on total ginsenoside contents of ballonflower seedlings(s)
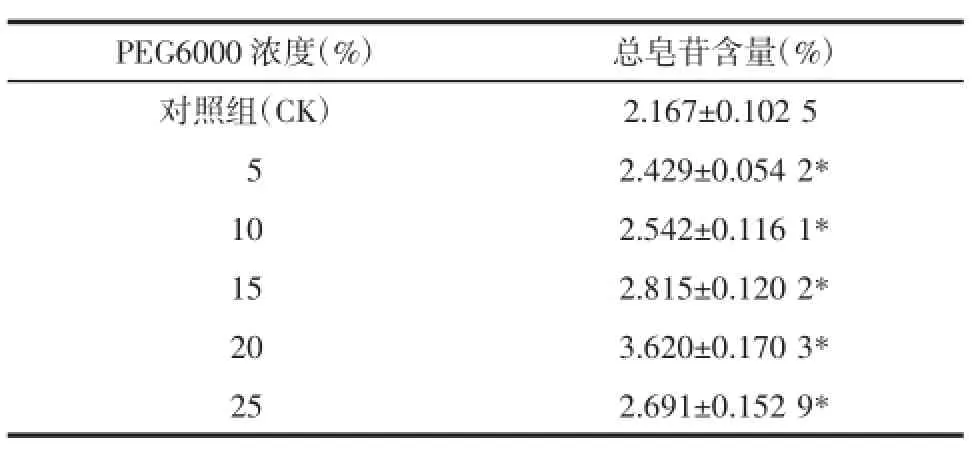
表9 不同浓度PEG对桔梗幼苗中总皂苷含量的影响(±s)Tab.9 Effects of concentrations of PEG on total ginsenoside contents of ballonflower seedlings(s)
注:与对照组(CK)比较,*P<0.05。
PEG6000浓度(%)总皂苷含量(%)对照组(CK)2.167±0.102 5d052.429±0.054 2* 102.542±0.116 1* 152.815±0.120 2* 203.620±0.170 3* 252.691±0.152 9*
3 结论
干旱胁迫下桔梗种子萌发和幼苗生长受到不同程度的抑制,在PEG6000浓度小于15%时具有一定的抗旱能力。
生理指标表明桔梗在一定程度干旱胁迫下(PEG浓度5%~15%)具有一定的自身调节能力,但超过PEG浓度15%桔梗植物自身耐受力明显下降,保护酶活力降低。
一定程度的干旱胁迫有助于诱导桔梗总皂苷的生物合成,可以考虑在药材采收前适当进行短时间的干旱处理(如适度减少灌溉),以提高药材质量,改变栽培植物产量高但质量差的现状。
[1]高学敏.中药学[M].北京:中国中医药出版社,2007:361-362.
[2]于军,焦培培.聚乙二醇(PEG6000)模拟干旱胁迫抑制矮沙冬青种子的萌发[J].基因组学与应用生物学,2010,29(2):355-360.
[3]李合生.植物生理生化实验原理和技术[M].北京:高等教育出社,2000:164-167.
[4]苏正淑,张宪政,郭凤仙.《作物生理研究法》课程的创设与教学实践[J].高等农业教育,2000,17(4):37-40.
[5]陈方,宋海峰.皂苷分析方法研究进展[J].天津中医药,2005,22,(3):257-259.
[6]Wang SM,Wan CG,Wang YR.The characteristics of K+Na+and free praline distribution in several drought resistant plants of the Alxa desert,China[J].Journal of Arid Environments,2004(56):525-539.
[7]Wu YP,Hu XW,Wang YR.Growth,water relations,and stomatal developmentofCaraganakorshinskiiKom.andZygophyllum xanthoxylum(Bunge)Maxim.seedling in response to water deficits[J]. NewZealandJournalofAgriculturalResearch,2009,5(22):185-193.
[8]郑轶琦,臧国长.PEG胁迫对冷季型草坪草种子萌发和幼苗生长的影响[J].种子,2011,30(12):34-37.
[9]杨晓慧,蒋卫杰,魏瑕,等.植物对盐胁迫的反应及其抗盐机理研究进展[J].山东农业大学学报(自然科学版),2006,37(2):302-305.
[10]林栖凤,李冠一.植物耐盐性研究进展[J].生物工程进展,2000,20(2):20-25.
[11]张春平,何平,喻泽莉,等.外源Ca 2+,ALA,SA和Spd对盐胁迫下紫苏种子萌发及幼苗生理特性的影响[J].中国中药杂志,2010,35(24):3260-3265.
[12]刘海龙,杜娟,吴立柱,等.拟南芥种子萌发及幼苗生长对干旱和NaC1胁迫的响应[J].河北农业大学学报,2008,31(2):11-15.
[13]姜山,朱启忠,张真豪.壳聚糖对小麦种子萌发及干旱胁迫下幼苗保护酶活性的影响[J].干旱地区农业研究,2011,29(1):206-209.
[14]冯利波,蒋卫杰,充秀萍,等.植物耐盐性机理及基因控制技术研究进展[J].农业工程学报,2005,12(21):5-9.
[15]潘安中,谢树莲,秦雪梅.不同年份柴胡种子SOD,POD活性与发芽率的测定[J].天津中医药,2008,25(3):243-245.
[16]罗明华,罗英,王璞.水杨酸处理对干旱胁迫下丹参幼苗抗氧化能力的影响[J].干旱地区农业研究,2010,28(4):102-105.
[17]刘建新,胡浩斌,王鑫.外源NO对盐胁迫下黑麦草幼苗根生长抑制和氧化损伤的缓解效应[J].植物研究,2008,28(1):7-13.
[18]陈明,沈文飚,阮海华,等.一氧化氮对盐胁迫下小麦幼苗根生长和氧化损伤的影响[J].植物生理与分子生物学报,2004,30(5): 569-576.
[19]Zhu JK.Salt and drought stress signal transduction in plants[J].Annu Rev Plant Biol,2002(53):247-273.
[20]黄璐琦,郭兰萍.环境胁迫下次生代谢产物的积累及道地药材的形成[J].中国中药杂志,2007,32(4):277-280.
(本文编辑:高杉,滕晓东)
Effects of drought stress on growth and physiological characteristics,and total saponins accumulation of Ballonflower
ZHANG Jian1,2,3,ZHANG Bo1,ZHOU Wen-gui1,YIN Fei1,MA Lin1,LI Xing-lin2,3
(1.College of Chinese Herbal Medicine,Tianjin University of Traditional Chinese Medicine,Tianjin 300193,China;2.College of Biotechnology,Tianjin University of Science&Technology,Tianjin 300457,China;3.Key Laboratory of Industrial Fermentation Microbiology,Ministry of Education,Tianjin 300457,China)
[Objective]To explore the effects of drought stress on seed germination and seedling growth of ballonflower,and to analyze the physiological mechanism of drought stress on growth and development of ballonflower and the accumulation characteristics of saponins.[Methods]The seeds of ballonflower and the seedling were treated with 5%,10%,15%,20%and 25%PEG 6000,then the growth traits index and physiologic index in the process of seed germination and seedling growth and the secondary product,i.e.ballonflower total saponins were measured.[Results]With the increase of PEG stress concentration,seed germination was inhibited,the germination rate and relative germination rate were decreased;among the various physiological indexes,proline,MDA,and total saponins showed increasing trends.The activities of SOD,CAT and POD all presented a rising and then decreasing tendency.[Conclusion]Ballonflower can tolerate some degree of drought stress.Moderate drought stress is good for the accumulation of total saponins of ballonflower seedlings.
ballonflower;drought stress;physiological characteristics;growth trait;ballonflower total saponins
R282
A
1672-1519(2015)11-0684-05
国家自然科学基金(U1332123);高等学校博士学科点专项科研基金(20121210120013);天津中医药大学第五届大学生科技创新基金(CXJJ2015YC27)。
张坚(1974-),男,博士,副教授,研究方向为中药资源和中药生物技术。
李兴林,E-mail:lxlszf@tust.edu.cn。
(2015-06-25)
——辨别味之苦甜

