HS-SPME-GC/MS法分析连花清瘟胶囊制剂原料中的挥发性成分*
贾伟娜,王春华,王宏涛,田书彦,韩 雪,朱 彦
HS-SPME-GC/MS法分析连花清瘟胶囊制剂原料中的挥发性成分*
贾伟娜1,3,王春华1,3,王宏涛2,田书彦2,韩雪1,3,朱彦1,3
(1.天津中医药大学中医药研究院,天津市现代中药重点实验室-省部共建国家重点实验室培育基地,天津300193;2.石家庄以岭药业股份有限公司,石家庄050035;3.天津国际生物医药联合研究院中药新药研发中心,天津300457)
[目的]分析连花清瘟胶囊制剂原料中的挥发性成分。[方法]采用顶空固相微萃取法(HS-SPME)萃取连花清瘟胶囊制剂原料中的挥发性成分,通过气相色谱-质谱法(G C/MS)对其中所含挥发性成分进行分析,经NIST05质谱数据库自动检索对未知化学成分进行准确定性,并采用峰面积归一化法计算各个化学成分的相对含量。[结果]从连花清瘟胶囊制剂原料的挥发性成分中共鉴定出53种化合物,占总挥发性成分的98.30%,其中l-menthol含量最高,其相对含量为94.84%,其他含量较高的挥发性成分为patchoulialcohol(1.101%)、α-bulnesene(0.398%)、α-gurjunene(0.256%)、α-guainene(0.210%)、α-patchoulene(0.171%)和β-patchoulene(0.111%)。[结论]HS-SPME-GC/MS法可以简单、快速、准确的分析连花清瘟胶囊制剂原料中的挥发性化学成分。
连花清瘟胶囊;顶空固相微萃取;气质联用分析;挥发性成分
连花清瘟胶囊是由石家庄以岭药业有限公司研制并开发,由经典名方“麻杏石甘汤”和“银翘散”两种方剂化裁而来[1]。连花清瘟胶囊由连翘、金银花、炙麻黄、炒苦杏仁、生石膏等13味中药加工制成的胶囊制剂,具有清瘟解毒、宣肺泄热之功效,常用于治疗流行性感冒属热毒袭肺证,症见发热或高热、恶寒、肌肉酸痛等[2]。现代药理研究表明,连花清瘟胶囊具有抗病毒、抗菌和抗炎等活性[3-6],用于治疗流行性感冒疗效显著[7-8]。目前,关于连花清瘟胶囊的化学物质基础研究较少,有关其挥发性化学成分的研究还未见报道。本研究首次采用顶空固相萃取-气相色谱-质谱法(HS-SPME-GC/MS法)鉴定了连花清瘟胶囊制剂原料中的53种挥发性成分,为连花清瘟胶囊的临床应用与升级开发提供了科学研究数据[9-11]。
1 材料与方法
1.1原料连花清瘟胶囊制剂原料由石家庄以岭药业有限公司提供(批号121003)。
1.2仪器Varian 4000 GC-Ion Trap-MS气相色谱-离子阱-质谱仪(Varian,WalnutCreek,CA,美国),固相微萃取装置(Supelco Inc.,Bellefonte,美国),包括手柄、聚二甲氧基硅烷/二乙烯基苯(65μm PDMSDVB)吸附纤维,15mL顶空瓶(德国CNW公司)。
1.3方法
1.3.1顶空固相微萃取精密称取1.0 g连花清瘟胶囊制剂原料,置于15m L顶空瓶中,将老化好的固相微萃取装置插入密封顶空瓶中,推出萃取头(萃取头距样品表层约1 cm),于80℃顶空萃取30min,然后将固相微萃取装置立即插入GC/MS进样口,在250℃下解吸5min进行分析[12-13]。
1.3.2气质分析条件气相色谱条件:色谱柱型号为VF-5m s(30m×0.25mm×0.25μm),进样口温度为250℃,分流模式,载气为氦气(He),流速为1mL/min。柱箱升温程序如下:初始温度为40℃,保持3min,然后以4℃/min的速率升至150℃,保持1min,最后以8℃/min的速率升至250℃,保持6min。
质谱条件:电子轰击离子源(EI),电力电压70eV,离子阱和传输线温度分别为220℃和280℃,扫描方式为全扫描,质量扫描范围m/z50-500。
1.3.3定性与定量分析每个峰的质谱图采用NIST05质谱数据库自动检索进行定性分析,单个化合物的相对含量用其峰面积相对于总峰面积的百分比来表示,相似度大于75%时即可认为是可识别化合物。
2 结果
连花清瘟胶囊制剂原料中挥发性成分经萃取及GC/MS分析得到的总离子流图,见图1。将各个色谱峰的质谱数据与NIST05质谱数据库对比并自动检索定性分析,共鉴定出53种化合物,占挥发性总成分的98.30%,并用峰面积归一化法确定了各挥发性成分的相对百分含量,结果见表1。
分析结果表明,l-me nthol(94.84%)是连花清瘟胶囊制剂原料中的主要挥发性成分,其他高浓度挥发性成分为patchoulialcohol(1.101%)、α-bulnesene(0.398%)、α-gurjunene(0.256%)、α-guaiene(0.210%)、α-patchoulene(0.171%)和β-patchoulene(0.111%)。据文献报道,这些挥发性化合物具有良好的抗病毒[14]、抗炎[14]、抗菌[15]等活性,可能与治疗病毒性感冒药效具有相关性[16-18]。
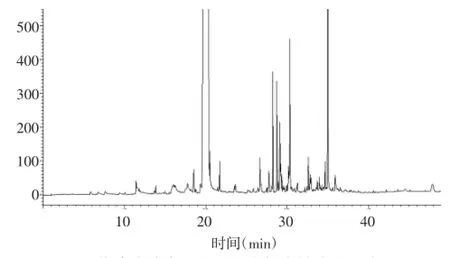
图1 连花清瘟胶囊制剂原料中挥发性成分总离子流图Fig.1 The total ion chromatogram of volatile com ponents in raw materialsof Lianhua Qingwen preparations

表1 连花清瘟胶囊制剂原料中挥发性成分分析结果Tab.1 The analyzed resultsof volatile com ponents from raw materialsof Lianhua Qingwen preparations
3 讨论
本研究通过采用HS-SPME-GC/MS分析连花清瘟胶囊制剂原料中挥发性成分。该方法操作简单,耗时短,样品用量少,重现性好,萃取的化合物种类多,能较好地反映连花清瘟胶囊制剂原料中挥发性成分组成基本情况,并且可以在没有标准样品的情况下,经NIST05质谱数据库自动检索,对这些未知化合物进行准确定性,同时采用峰面积归一化法进行定量分析,为连花清瘟胶囊制剂原料中挥发性成分检测提供了一种新的有效手段,并为连花清瘟胶囊的进一步研究与升级开发提供一定的科学研究数据。
[1]刘春援,李晓强,蔡绍乾.连花清瘟胶囊的药理与临床研究进展[J].中药药理与临床,2010,26(6):84-85.
[2]周沙,周莹君,马桂云,等.连花清瘟胶囊稳定性的考察[J].河北化工,2012,35(3):16-17.
[3]吴以岭.解读连花清瘟胶囊[J].中国医药指南,2005,3(11):120-121.
[4]黄明朝.连花清瘟胶囊研究进展[C].络病学基础与临床研究(9),2014:417-418.
[5]胡忆芬.连花清瘟胶囊的药理及临床疗效分析[J].现代诊断与治疗,2013,24(9):2012.
[6]李佳,宋新波,余保林,等.高效液相色谱法测定光果甘草中光甘草定的含量[J].天津中医药,2008,25(2):157-158.
[7]王新功,崔学军,刘新生,等.连花清瘟胶囊治疗流行性感冒的临床疗效观察[J].中国药房,2008,19(27):2416-2418.
[8]Duan ZP,Jia ZH,Zhang J,etal.NaturalherbalmedicineLianhuaqingwen capsule anti-influenza A(H1N1)trial:a randomized,double blind,positive controlled clinical trial[J].Chin Med J,2011,124(8): 2925-2933.
[9]刘时乔,张新鑫,单淇,等.胡黄连中酚类化合物的分离及UPLC-ESI-MS分析[J].天津中医药,2012,29(6):583-587.
[10]王健,李锦,孙瑜,等.GC-MS鉴别清热抗感颗粒中青蒿、荆芥穗和薄荷[J].天津中医药大学学报,2007,26(4):210-212.
[11]赵培莉,吴静明,张毅,等.气相色谱法同时测定中药糖浆剂中3种防腐剂含量[J].天津中医药大学学报,2013,32(1):40-42.
[12]降升平,张小红,张玲玲,等.SPME-GC-MS法分析室内空气中挥发性有机物[J].太原理工大学学报,2013,44(3):272-277.
[13]张军安,陈波.顶空固相微萃取-气质联用分析酸枣仁挥发性成分[J].中药材,2012,35(2):235-240.
[14]Kiyohara H,Ichino C,Kawamura Y,etal.Patchoulialcohol:in vitro directanti-influenza virussesquiterpene in Pogostemon cablin Benth[J].JNatMed,2012,66(1):55-61.
[15]刘琥琥,罗集鹏,赖沛炼.广东高要与吴川产广藿香提取物对肠道致病菌抗菌作用的比较研究[J].中药材,1999,22(8):408-511.
[16]张镖.中药复方研究现状与思路探析[J].天津中医药大学学报,2007,26(2):104-106.
[17]王以炳,张天民,杨玉梅,等.连花清瘟胶囊治疗病毒性感冒的有效性与安全性观察[J].临床肺科杂志,2008,13(9):1118-1119.
[18]罗荣,张贵君.中药药效组分的理论与实践 (二)[J].天津中医药,2014,31(2):121-124.
(本文编辑:高杉,于春泉)
Determ ining volatiles from raw materialsof Lianhua Qingwen preparationsby HS-SPME-GC/MS
JIAWei-na1,3,WANGChun-hua1,3,WANGHong-tao2,TIANShu-yan2,HANXue1,3,ZHUYan1,3
(1.Tianjin Modern ChineseMedicine Key Laboratory-Provinceand Ministry co-established State Key Laboratory Cultivation Base,Instituteof TraditionalChineseMedicine,Tianjin University of TraditionalChineseMedicine,Tianjin 300193,China;2.Shijiazhuang Yiling Pharmaceutical Co.,Ltd,Shijiazhuang 050035,China;3.Research and DevelopmentCenter of TraditionalChineseMedicine,Tianjin International JointAcademy of Biotechnology&Medicine,Tianjin 300457,China)
[Objective]To analyze the volatiles from raw materialsof Lianhua Qingwen preparations.[M ethods]Headspace solid-phase micro-extraction(HS-SPME)technique was employed to extract the volatile compounds from raw materials of Lianhua Qingwen preparations.The volatile componentswere isolated and identified successfully by gas chromatography/mass spectrometry(GC/MS)and matched with NIST05 mass spectra library to retrieve the unknown chemical components automatically,the relative contents in percentage of each chemical composition were calculated by peak area normalizationmethod.[Results]Fifty-three volatile compounds were temporarily identified,corresponding to 98.30%of totaloils.Themajor volatile componentwas l-menthol(94.84%),and the other high levelsof ingredientswere patchoulialcohol(1.101%),α-bulnesene (0.398%),α-gurjunene (0.256%),α-guaiene(0.210%),αpatchoulene(0.171%)andβ-patchoulene(0.111%).[Conclusion]The volatile components from raw materials of Lianhua Qingwen preparations can be simp ly,rapidly and accurately analyzed by HS-SPME-GC/MSmethod.
LianhuaQingwen preparation;SPME;GC/MS;volatile constituent
R284
A
1672-1519(2015)02-0110-03
10.11656/j.issn.1672-1519.2015.02.12
天津市自然科学基金资助项目(13JCZDJC28600、12JCYBJC32400)。
贾伟娜(1989-),女,硕士研究生,主要从事中药化学物质基础研究。
王春华,E-mail:pharmwch@126.com。
(2014-09-29)

