藻类水热液化产物生物油分离纯化及组分分析
方丽娜,陈宇,刘娅,吴可荆,吴玉龙,杨明德
(1石河子大学食品学院,新疆 石河子 832003;2清华大学核能与新能源技术研究院,北京 100084)
引 言
近年来,随着化石能源的日趋枯竭和使用化石资源所造成的环境污染问题,开发新的可再生能源已经成为不可回避的主题。在众多可再生能源中,生物质能因具有清洁无污染、储量丰富等显著优势而广受关注[1]。其中,微藻由于具有光合作用强、生长周期短、不占用耕地面积、环境适应能力强等优势,成为研究的热点[2-3]。在微藻众多转化方法中,以亚/超临界水作为反应介质的水热液化法可以有效转化微藻中的主要生化组分[4],无须对原料进行干燥,降低了过程的能耗,该方法已成为微藻能源化利用中最具有潜力的方法之一[5]。
微藻水热液化所得生物油的组成复杂,当前对生物油组分的分析主要以GC-MS为主,存在很大的局限;为了拓展其应用领域以及进一步揭示液化机理,有必要对其组成信息进行更详尽的了解。鉴于此,分离纯化成为深入剖析生物油组分的一种行之有效的方法[6]。迄今为止,用于生物油分离纯化所采用的技术主要包括蒸馏[7]、溶剂萃取[6,8]、超临界萃取[9-10]和柱层析[11-14]等技术。蒸馏法只能使不同程度的馏分富集,无法进一步得到单一的化学品[7];溶剂分离虽简单、快速,但是萃取剂与被萃取组分的分离较难,这一缺点限制了溶剂萃取在生物油分离上的应用[6];超临界CO2萃取目前在生物油的分离方面应用较少,存在成本高、投资大的缺点[9]。柱层析是一种重要的分离纯化技术。柱层析法的分离原理是根据物质在硅胶上的吸附力不同而得到分离,一般情况下极性较大的物质易被硅胶吸附,极性较弱的物质不易被硅胶吸附,整个层析过程即是吸附、解吸、再吸附、再解吸过程[15]。由于其具有分离量大、载样品多、操作方便、设备简单、能在单位时间内获得较多量分离组分等优点,已经广泛应用在有机合成与天然产物的分离纯化等方面,例如虾青素、茶多酚等生物活性组分的分离纯化[16-17]。工业上柱层析已经广泛应用于中草药有效成分的分离提纯、高纯物质制备、石油制品的精制以及有机物质的脱水精制[10]。
目前,柱层析法分离纯化生物油也已经得到了认可。张素萍等[18]应用柱层析法将木屑快速裂解油分离成3种组分:正庚烷淋洗得到脂肪烃,苯淋洗得到芳香烃,甲醇淋洗得到极性组分。李世光等[19]利用柱层析法对杏核和玉米芯快速热解油进行分离,也得出3个馏分:环己烷洗脱的芳香化合物,苯洗脱的单环酚类化合物,甲醇洗脱的极性化合物。Onay等[10]利用柱层析法将坚果壳热解生物油以正己烷、甲苯和二氯甲烷/甲醇(1:1,体积)为淋洗剂,硅胶为固定相,从生物油中分离出脂肪族、芳香族和极性物质等。Wang等[14]则采用柱层析法对木焦油原液组分柱层析分离效果进行了考察,以层析硅胶为柱填料,比较了不同洗脱系统(环己烷-苯-甲醇溶剂体系和环己烷-二氯甲烷-甲醇溶剂体系)对组分的分离效果,研究结果表明柱层析对于分离木焦油具有非常好的效果。所含组分提供更全面的信息。上述研究成果主要是针对木质纤维素类生物质热解所得生物油。而有关藻类生物油的分离纯化尚未见报道。众所周知,藻类生物质的生化组分与木质纤维素类生物质存在很大的差异,其液化产物也不尽相同。因此,很有必要对藻类液化产物进行分离纯化,为藻类生物油组分分布提供更全面的信息。此外,为了取得较好的分离效果,选用萃取-柱层析结合的方法来分析生物油。Oasmaa等[20]对生物油萃取分析,先用正己烷萃取,分为正己烷溶解组分和不溶组分,将正己烷不溶组分用蒸馏水分馏,溶于水的部分用二乙醚萃取,不溶于水的部分用二氯甲烷萃取,可以得到较多的生物油组分信息。徐绍平等[21]将杏核热解油经过萃取-柱层析分离得到沥青烯、酸性组分、环己烷洗脱馏分、苯洗脱馏分、甲醇洗脱馏分和酚类化合物。通过FT-IR和GC-MS等手段对这几种馏分分析发现,萃取-柱层析相结合能很好地将生物油分离。
鉴于此,本文拟通过柱层析的方法对杜氏盐藻水热液化生物油进行分离纯化。先对液化生物油采用正己烷、二氯甲烷和乙醚进行溶剂分割,然后将二氯甲烷相进行柱层析分析,所得产物采用二次质谱和FT-IR进行分析,正己烷相和乙醚相通过GC-MS和FT-IR分析。有望拓展藻类生物油的应用领域,也为藻类进一步资源化利用提供理论基础。
1 实验部分
1.1 材料与仪器
本实验所用的原料为西安微藻生物技术有限公司提供的杜氏盐藻(组分及成分分析如表1所示),晒干后将其研磨粉碎,过0.18~0.25 mm Tyler标准筛后制成样品。使用前将藻渣放入烘箱中于 105℃下干燥12 h,然后置于干燥箱备用;采用的化学试剂由北京化工厂提供,石油醚(60~90℃)、乙酸乙酯、丙酮、甲醇、乙醇规格均为分析纯,柱层析用硅胶以及薄层层析用硅胶均由青岛海洋化工厂提供。

表1 杜氏盐藻分析结果 Table 1 Analysis results of D.tertiolecta
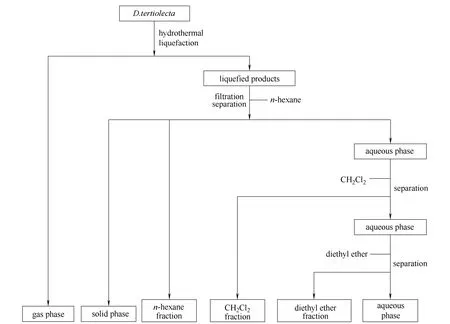
图1 杜氏盐藻水热液化实验流程 Fig.1 Procedure for separation of reaction products
1.2 生物油的制备
生物油按文献[22]所报道的方法制备,具体步骤如下:按料液比(质量比)1:10准确称取一定量的杜氏盐藻粉和蒸馏水,将两者放于烧杯中用玻璃棒搅拌均匀,加入反应釜内(美国Parr反应釜),密封。设置反应温度360℃,搅拌速度为300 r·min-1,当温度达到反应所需温度后,保持30 min,反应结束后,停止加热,反应釜自然冷却至室温。反应产物的分离纯化流程依据文献[20]的流程进行,具体步骤如下:反应釜冷却后,气体直接排空,反应釜壁和管路先用正己烷洗涤3次,静置分离后,减压蒸馏溶剂得到正己烷相;反应釜壁和管路再用二氯甲烷清洗,并与正己烷不溶相混合,静置分离出有机相后,减压蒸馏得到二氯甲烷相;剩余液经抽滤后滤液再经乙醚反萃取3次,合并后蒸出溶剂得到乙醚相;滤渣置于105℃的烘箱中干燥24 h,得到固体残渣(如图1所示)。
1.3 柱层析精制生物油
本实验采用湿法填柱(层析柱直径3.5 cm,长1 m,如图2所示),固定相为柱层析硅胶,将1.2中制备得到的二氯甲烷相装入层析柱中,采用手动加压,依序添加洗脱剂进行洗脱,洗脱速度为2~3滴·s-1,用锥形瓶收集洗脱液,每15 ml更换一次锥形瓶;收集的样品进行薄层层析检测[石油醚:乙醇=5:1(体积比,下同)作为展开剂],取比移值(Rf)相同的组分合并、蒸发浓缩,得到分离产物,保存待分析。

图2 柱层析装置 Fig.2 Equipment of column chromatography
1.4 产物分析
产物的红外光谱分析在Nicolet 670 FT-IR红外光谱仪上进行,采用液膜法进行测定,扫描范围400~4000 cm-1,分辨率4 cm-1,扫描次数32,保存谱图。GC-MS分析是在DSQ气相色谱-质谱仪(美国Thermo Electron Corporation公司)上进行的。色谱柱为AB-5MS(30 m×0.25 mm×0.25 µm);载气为高纯氦;流速为1 ml·min-1;进样量为4 µl;分流比为50:1;电离方式为EI;电子能量为70 eV;源温为250℃;扫描速率为1000 amu·s-1;扫描范围为35~650 amu;气化温度为300℃;GC-MS接口温度为250℃;GC升温程序为初始温度70℃,以10℃·min-1升至300℃,恒温10 min。MS条件:电离方式为EI;电子能量为70 eV。
1.5 生物油回收率的计算
式中,M1为加入柱层析前粗生物油的质量;M2为通过柱层析回收生物油的质量。
2 结果与讨论
2.1 二氯甲烷相柱层析分离纯化
二氯甲烷本身极性非常大,能够溶解众多有机化合物,在萃取微藻液化生物油的过程中,可以将大部分的有机物萃取出来,其中包括一些高沸点的大分子。但是,目前对于生物油的产品组成分析均是基于GC-MS结果,而GC-MS分析只能检测到能够通过GC柱的物质,因此,二氯甲烷相中的高沸点物质难以从GC-MS分析得到其组分的信息。这对于全面掌握生物油中的组分信息具有很大的局限性,也大大限制了生物油的进一步精制和其实际应用,因此,十分有必要对其分离纯化来深入剖析生物油中的组分信息。为了提高分离纯化的效率和减少柱层析的工序,本文先对藻类水热液化生物油采用正己烷、二氯甲烷和乙醚进行溶剂分割,正己烷相和乙醚相的组分信息可由GC-MS分析直接得到;二氯甲烷相则先经柱层析后,再对分离所得组分进行分析。
洗脱剂的洗脱作用是吸附的逆过程,所选择的洗脱剂必须可以溶解各个组分,但不会与各个组分形成竞争吸附固定相[23],为了使试样中不同吸附能力的各个组分能够很好分离,必须根据试样的溶解度、固定相的活性以及洗脱剂的传质速率的快慢选择适当的洗脱剂作流动相进行洗脱。一般展开剂决定了洗脱剂的种类,通常以待分离样品Rf值为0.2~0.5最合适。由于分离组分的复杂性,经常选择的洗脱剂是混合溶剂[24]。首先通过薄层层析进行预实验,分别选用石油醚/乙酸乙酯、石油醚/丙酮、石油醚/乙醇、石油醚/甲醇4组混合溶剂按照不同体积比作为展开剂,实验结果表明:混合溶剂(石油醚:乙醇=5:1)作为展开剂时分离效果最好。
柱层析过程中,根据洗脱过程采用梯度洗脱的方式,洗脱剂所选用的溶剂分别为石油醚、石油醚:乙酸乙酯=10:1、石油醚:乙酸乙酯=5:1、石油醚:乙酸乙酯=2:1、石油醚:乙酸乙酯=1:1、石油醚:丙酮=2:1、石油醚:丙酮=1:1、石油醚:甲醇=5:1、石油醚:甲醇=2:1、石油醚:甲醇=1:1以及甲醇,整个实验过程中根据极性的顺序依次加入。整个柱层析过程共洗脱分离出16个馏分,根据洗脱剂中溶剂的种类不同,分别对其进行命名如下:石油醚洗脱馏分(A1-1);石油醚:乙酸乙酯洗脱的馏分(A2-1,A2-2,A2-3,A2-4,A2-5,A2-6和A2-7);石油醚:丙酮洗脱的馏分(A3-1,A3-2和A3-3);石油醚:甲醇洗脱馏分(A4-1,A4-2,A4-3和A4-4);甲醇洗脱馏分(A5-1)。
经过柱层析精制后二氯甲烷相生物油的回收率为91.38%。硅胶柱层析法的分离原理是根据物质在硅胶上结合力的不同而得到分离,一般情况下极性大的物质易于与硅胶上的羟基发生结合,从而吸附在硅胶上,极性较弱的物质则不易被硅胶吸附,整个层析过程即是自由沉降和吸附、解吸、再吸附、再解吸等几个过程的组合[15]。在整个柱层析对生物油产物进行分离精制的过程中,极性小的物质与硅胶的结合力较小,因此优先被洗脱出来,而酸和酯类物质等极性大的物质由于与层析柱中的硅胶结合力较大,最终随着洗脱剂极性的增大而被逐步洗脱下来。藻类液化生物油中存在一些沥青质和不溶杂质等,同时在分离精制后对收集到产物的后处理过程中也会出现一些损耗,所以本文经柱层析分离后得到生物油的回收率为91.38%。
2.2 正己烷相和乙醚相的红外谱图分析及GC-MS分析
通过GC-MS分析对正己烷相和乙醚相的有机化合物组成进行鉴定,其判定依据是NIST 98光谱谱图库比对。表2和表3分别列出了正己烷相和乙醚相的GC-MS结果,其中,组分统计结果列于图3中。
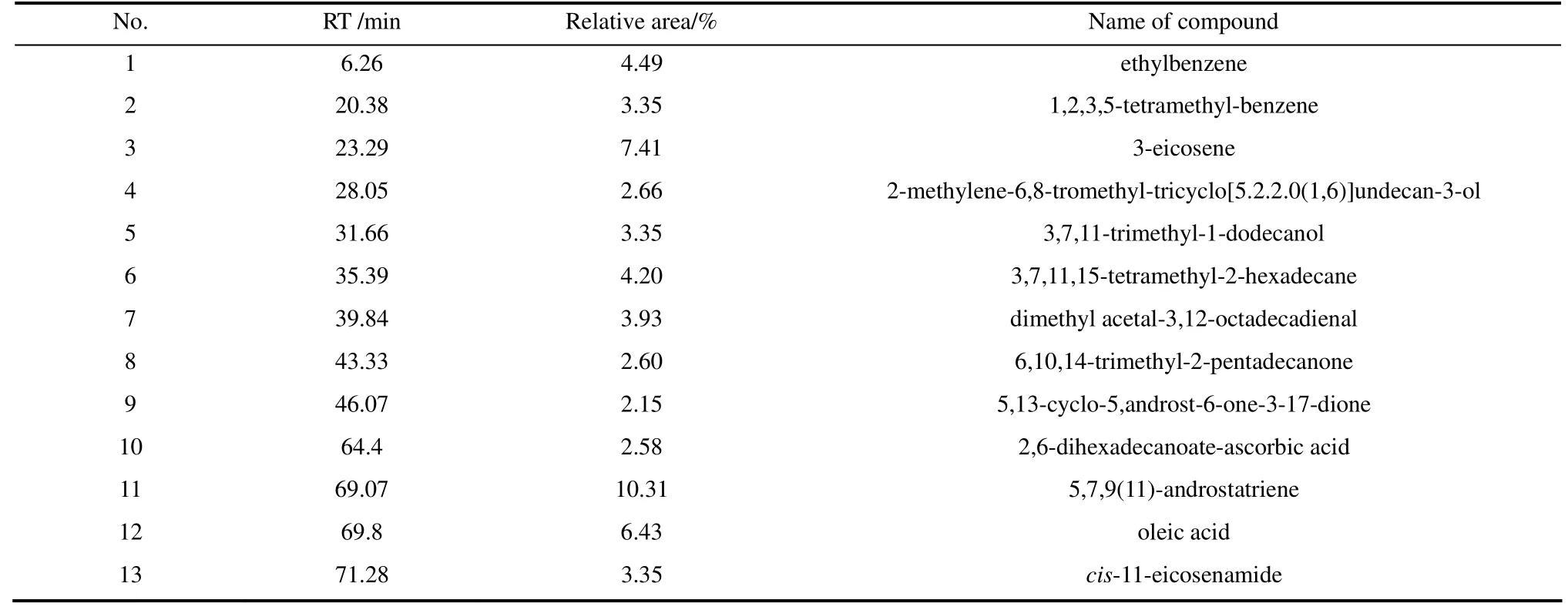
表2 正己烷相的GC-MS分析结果 Table 2 GC-MS analysis results for n-hexane soluble fraction

表3 乙醚相的GC-MS分析结果 Table 3 GC-MS analysis results for diethyl ether soluble fraction

图3 正己烷相与乙醚相组分统计 Fig.3 Chart of component of n-hexane soluble and diethyl ether soluble

图4 正己烷相和乙醚相的红外谱图 Fig.4 FT-IR spectroscopy analysis of n-hexane soluble and diethyl ether soluble
由表2和表3以及图3中的物质和相对含量可以看出,正己烷相中的产物主要以烃类、苯环以及少量长链羧酸等极性较小的物质为主,这主要是因为正己烷本身的极性很小,根据相似相溶原理,正己烷相中的物质主要以低极性的物质为主。而乙醚相中的产物则以醛酮和含氮类物质为主,这是因为乙醚与含杂原子的化合物具有较高的溶解度,所以含杂原子的物质特别是含氮类化合物大多出现在乙醚相中。
图4为正己烷相和乙醚相的红外光谱图,从图中可以看出,在2850~3050 cm-1范围内的吸收峰为C H键的伸缩振动吸收峰,正己烷相中显示出较强的吸收峰,说明正己烷相中的烃类的含量较多,而1650 cm-1附近的强吸收峰为C N键的伸缩振动吸收峰,主要由含氮化合物贡献,乙醚相中该处吸收峰非常强,说明乙醚相中的含氮化合物含量较高。1700 cm-1附近的强吸收峰为C O键的伸缩振动吸收峰,正己烷相中此处吸收峰非常强,这可能与其中含有大量羧酸相关。正己烷相中所含有的酸类物质明显高于乙醚相中,但是乙醚相中最丰富的物质是酰胺类物质(图3所示)。由此可以看出,正己烷相和乙醚相的红外光谱图与GC-MS结果基本吻合。正己烷相和乙醚相所得物质组成大部分都存在于文献报道[3,22],这些物质能够直接被GC-MS检测到,而在柱层析之前通过溶剂分割,可以减少柱层析的过程和工序,提升整个分离纯化的效率。
2.3 柱层析产物的红外分析
二氯甲烷相和柱层析分离所得组分的红外分析结果如图5所示。由图5(a)可以看出,二氯甲烷的红外光谱结果与文献报道基本相似[3,22],其中,红外光谱图在3200 cm-1附近有很强的O H伸缩振动峰,根据有机物红外光谱范围与官能团之间的关系可以推测油中存在含羟基的化合物或氨基化合物。烷烃官能团C H在2850 cm-1和2960 cm-1附近有强烈振动峰,在1700 cm-1处有C O伸缩振动峰,表明存在酮和醛类化合物。在1450 cm-1和1370 cm-1处有较强的C H弯曲振动峰,说明存在脂肪类化合物。从其他吸收峰还可以看出,油中有醇、酚、醚、酯及芳香烃类物质的存在。
图5(b)为石油醚洗脱馏分(A1-1)的红外光谱图,从图中可以看出,在2850 cm-1和2960 cm-1附近有强烈振动峰为C H键的伸缩振动吸收峰,在1450 cm-1和1370 cm-1处有较强的C H弯曲振动峰,在1600 cm-1附近有较弱的吸收峰,可能是C C键伸缩振动吸收峰,由此可以推断该组分可能为烯烃类物质。
图5(c)为石油醚:乙酸乙酯洗脱的馏分(A2-1,A2-2,A2-3,A2-4,A2-5,A2-6和A2-7)的红外光谱图,从图中可以看出,A2-1和A2-2的红外曲线与A1-1的红外光谱图较为相似,其组分可能为烃类物质;A2-3,A2-4,A2-5,A2-6和A2-7的红外曲线均在1700 cm-1处有C O伸缩振动峰,且在3400~3600 cm-1范围内有振动吸收峰,说明存在 OH官能团,此外,在2850 cm-1和2960 cm-1附近有强烈振动峰为C H键的伸缩振动吸收峰,由此可以推断A2-3,A2-4,A2-5,A2-6和A2-7可能为脂肪酸类化合物。
图5(d)为石油醚:丙酮洗脱的馏分(A3-1,A3-2和A3-3)的红外光谱图,从图中可以看出,A3-1,A3-2和A3-3的红外曲线均在1700 cm-1处有C O伸缩振动峰,且在3700 cm-1范围内有振动吸收峰,说明存在 NH2官能团,由此推断可能为酰胺类 物质。

图5 二氯甲烷相及分离出的各个组分红外光谱图 Fig.5 FT-IR spectroscopy analysis of dichloromethane soluble and fraction of separated
图5(e)为石油醚:甲醇洗脱馏分(A4-1,A4-2,A4-3和A4-4)的红外光谱图,从图中可以看出,A4-3的红外曲线均在1700 cm-1处有C O伸缩振动峰,且在3400~3600 cm-1范围内有振动吸收峰,说明存在 OH官能团,此外,在2850 cm-1和2960 cm-1附近有强烈振动峰为C H键的伸缩振动吸收峰,由此可以推断其可能为脂肪酸类化合物;其他组分在2850 cm-1和2960 cm-1附近有强烈振动峰为C H键的伸缩振动吸收峰,在1450 cm-1和1370 cm-1处有较强的C H弯曲振动峰,由此可以推断该组分可能为烃类物质。
图5(f)为甲醇洗脱馏分(A5-1)的红外光谱图,从图中可以看出,在2850 cm-1和2960 cm-1附近有强烈振动峰为C H键的伸缩振动吸收峰,且在3400~3600 cm-1范围内有振动吸收峰,说明存在 OH官能团,1700 cm-1处有C O伸缩振动峰,可能为羧酸或者羧酸衍生物;此外,该组分的红外光谱在1000 cm-1为C Cl的伸缩振动吸收峰,可能含有少量二氯甲烷。
图5(b)~(f)中各组分的红外谱图叠加起来与图5(a)的二氯甲烷相基本吻合,但是经柱层析后所得红外谱图较为简单,可以获得较清晰的红外振动吸收峰,这说明通过柱层析能获取纯度较高物质,而各个组分中的具体物质具体组成信息需要结合其他分析手段深入剖析。
2.4 柱层析产物的二次质谱分析
二氯甲烷相经柱层析分离后所得产物,用GC-MS难以获得其组分的信息,故对柱层析所得各组分进行了二次质谱分析,并结合FT-IR图来鉴定化合物的组成,所得主要化合物及相对应组分的回收率如表4所示。由表4可以看出,随着洗脱剂极性的增加,极性大的醇类和酰胺类物质被洗脱出来,其中被分离出的物质有机酸占了很大的比例,其中硬脂酸、棕榈酸的含量是最高的,与之对应的洗脱剂是石油醚:乙酸乙酯=5:1。此外,表4中所显示的物质中,硬脂酸、棕榈酰胺和棕榈酸已经被证实是微藻液化制备生物油的重要组成成分[3,22],十五烯、十四烷和油酸也应属于藻类液化生物油的成分之一,但是其他组分却鲜有报道。由表4可以看出 二氯甲烷相经柱层析分离后,可得到16个馏分,分别是石油醚洗脱馏分(A1),主要是烯烃类物质;石油醚:乙酸乙酯洗脱的馏分(A2),主要是酸类化合物;石油醚:丙酮洗脱的馏分(A3),主要是含氮的酰胺类物质,石油醚:甲醇洗脱馏分(A4),主要是烷烃类物质;甲醇洗脱馏分(A5),主要是十八碳烯酰胺。以上组分信息与红外光谱分析的结论基本吻合。由此可以表明经过柱层析可以获得较多的生物油组分信息,这为以后生物油的精制和实际应用提供了更多的参考依据,也为进一步剖析藻类液化生物油的液化机理提供了参考。

表4 分离出的各组分的MS结果 Table 4 MS result of fraction of separated from bio-oil
3 结 论
(1)杜氏盐藻水热液化所得生物油采用正己烷、二氯甲烷和乙醚进行溶剂分割,其中正己烷相和乙醚相直接通过GC-MS获取其组分信息。
(2)二氯甲烷相则通过柱层析进行分离纯化,分别选取石油醚,石油醚:乙酸乙酯,石油醚:丙酮,石油醚:甲醇和甲醇的混合溶液为洗脱剂,采用梯度洗脱的方式。柱层析产物的回收率达到91.38%,并分离纯化得到了16个组分,所得组分的红外光谱和二次质谱分析结果基本吻合,其结果表明柱层析可以获得较多的生物油组分信息。
(3)本文为生物油的精制和实际应用提供了更多的参考依据,也为进一步剖析藻类液化生物油的液化机理提供了参考。
[1] Glišić S, Lukic I, Skala D.Biodiesel synthesis at high pressure and temperature: Analysis of energy consumption on industrial scale [J].Bioresour.Technol., 2009, 100 (24): 6347-6354.
[2] Wijffels R H, Barbosa M J.An outlook on microalgal biofuels [J].Science, 2010, 239: 796-799.
[3] Chen Yu, Wu Yulong, Ding Ranran, Zhang Pan, Liu Ji, Yang Mingde.Catalytic hydrothermal liquefaction of D.tertiolectafor the production of bio-oil over different acid/base catalysts [J].AIChE J., 2015, 61 (4): 1118-1128.
[4] Zhang Dongdong, Wei Dali, Li Qi, Ge Xin, Guo Xuefeng, Xie Zaiku, Ding Weiping.High performance catalytic distillation using CNTs-based holistic catalyst for production of high quality biodiesel [J].Sci.Rep., 2014, 4: 4021.
[5] Thomas M Yeh, Jacob G Dickinson, Allison Franck, Suljo Linic, Levi T Thompson Jr, Phillip E Savage.Hydrothermal catalytic production of fuels and chemicals from aquatic biomass [J].J.Chem.Technol.Biotechnol., 2013, 88: 13-24.
[6] Zhang Qi, Chang Jie, Wang Tiejun, Xu Ying.Review of biomass pyrolysis oil properties and upgrading research [J].Energy Convers.Manage., 2007, 48 (1): 87-92.
[7] Wang Shurong, Gu Yueling, Liu Qian, Yao Yan, Guo Zuogang, Luo Zhongyang, Cen Kefa.Separation of bio-oil by molecular distillation [J].Fuel Process.Technol., 2009, 90 (5): 738-745.
[8] Demirbas M F, Balat M.Recent advances on the production and utilization trends of bio-fuels: a global perspective [J].Energy Conver.Manage., 2006, 47 (15): 2371-2381.
[9] Das P, Sreelatha T, Ganesh A.Bio-oil from pyrolysis of cashew nut shell-characterisation and related properties [J].Biomass Bioenergy, 2004, 27 (3): 265-275.
[10] Onay O, Gaines A F, Kocker O M, Adamsc M, Tyagic T R, Snape C E.Comparison of the generation of oil by the extraction and the hydropyrolysis of biomass [J].Fuel, 2006, 85: 382-392.
[11] Didem O, Aysegul E M.Characterization of biochar and bio-oil samples obtained from carbonization of various biomass materials [J].Renewable Energy, 2010, 35: 1319-1324.
[12] Adjaye J D, Bakhshi N N.Catalytic conversion of a biomass-derived oil to fuels and chemicals (Ⅰ): Model compound studies and reaction pathways [J].Biomass Bioenergy, 1995, 8 (3): 131-149.
[13] Laird D A, Brown R C, Amonette J E, Lehmann J.Review of the pyrolysis platform for coproducing bio-oil and biochar[J].Biofuels,Bioproducts and Biorefining, 2009, 3 (5): 547-562.
[14] Wang Z, Lin W G, Song W L, Du L, Li Z J, Yao J Z.Component fractionation of wood-tar by column chromatography with the packing material of silica gel [J].Chin.Sci.Bull., 2011, 56: 1434-1441.
[15] Liu Yang (柳杨), Yi Huaifeng (衣怀峰), Chen Yu (陈宇), Wu Yulong (吴玉龙), Yang Mingde (杨明德), Chen Zeng (陈曾), Tong Junmao (童军茂).Column chromatography purification and analysis of biodiesel by transesterification [J].Spectroscopy and Spectral Analysis(光谱学与光谱分析), 2012, 31: 505-509.
[16] Garscha Ulrike, Nilsson Tomas, Oliw Ernst H.Enantiomeric separation and analysis of unsaturated hydroperoxy fatty acids by chiral column chromatography-mass spectrometry [J].J.Chromatogr.B, 2008, 872 (1/2): 90-98.
[17] Alcalde-Eon C, Escribano Bailón M T, Santos-Buelga C.Separation of pyranoanthocyanins from red wine by column chromatography [J].Analytica Chimica Acta, 2004, 513 (1): 305-318.
[18] Zhang Suping (张素萍), Yan Yongjie (颜涌捷), Ren Zhengwei (任铮伟), Li Tingchen (李庭琛).Analysis of liquid product obtained by the fast pyrolysis of biomass [J].J.East China Univer.Sci.Tech.(华东理工大学学报), 2001, 27: 666-668.
[19] Li Shiguang (李世光), Xu Shaoping (徐绍平), Lu Qinghua (路庆花), Liu Shuqin (刘淑琴).Column chromatographic separation of bio-oil from fast pyrolysis of biomass [J].Acta Energ.Sol.Sin.(太阳能学报), 2005, 26: 549-555.
[20] Oasmaa A, Kuoppala E, Solantausta Y.Fast pyrolysis of forestry residue (Ⅱ): Physicochemical composition of product liquid [J].Energy Fuels, 2003, 17 (2): 433-443.
[21] Xu Shaoping (徐绍平), Liu Juan (刘娟), Li Shiguang (李世光), Liu Shuqin (刘淑琴), Lu Qinghua (路庆花).Solvent extraction-column chromatographic separation of bio-oil from fast pyrolysis of apricot stone and manufacture technology [J].J.Dalian Univer.Technol.(大连理工大学学报), 2005, 45 (4):505-510.
[22] Zou S P, Wu Y L, Yang M D, Li C, Tong J M.Bio-oil production from sub- and supercritical water liquefaction of microalgae Dunaliella tertiolectaand related properties [J].Energy Environ.Sci., 2010, 3: 1073-1078.
[23] Kostiainen R, Kauppila T J.Effect of eluent on the ionization process in liquid chromatography-mass spectrometry [J].J.Chromatogr.A, 2009, 1216 (4): 685-699.
[24] Ikai T, Okamoto Y.Structure control of polysaccharide derivatives for efficient separation of enantiomers by chromatography [J].Chem.Rev., 2009, 109 (11): 6077-6101.

