1株耐辐射酵母菌的鉴定及其生长特性和产物的检测
杭姣 陈亚利 陈可泉 韦萍

摘要:对未知菌种的鉴定是研究挖掘此菌种功能用途以及产物的基础之一。根据形态学、生理生化鉴定以及26S rRNA的D1/D2区域的测序、5.8S rRNA-ITS的RFLP分析等对1株酵母菌进行了鉴定,并探究了其特殊的生长特性与产物。研究结果,该酵母菌被鉴定为圆形或者卵圆形,以出芽生殖为主,菌落为乳白色、圆形、凸起、边缘光滑的浅白隐球酵母;经过研究还发现,该酵母菌能在较大的pH值范围(pH值3~13)内生长,能在比较高的温度(39 ℃)以及强酸强碱下生长,检测到其产物为多糖,与以往浅白隐球酵母的产物有区别。
关键词:耐辐射;酵母菌;鉴定;核糖体序列分析
中图分类号: TQ920.1 文献标志码: A 文章编号:1002-1302(2015)07-0320-05
傳统的也是权威的酵母菌鉴定方法是首先依据形态学特征和生理生化进行分析。20世纪90年代开始应用的商业化Biolog系统[1-2],即测试微生物在鉴定板各孔中对不同碳源的代谢能力进行菌种鉴定,这种鉴定也被称为代谢指纹图谱分析。但该方法对于那些并未得到很好分离纯化的酵母菌,在特殊条件(如强辐射、光照、酸碱条件等)下产生变异的新菌种,其遗传密码和代谢途径可能发生了变化有时也难以辨别。与传统分类法互补的分子生物学方法研究酵母菌的基因型,主要以遗传物质核酸作为研究对象,更能反映其遗传本质,对酵母菌的多样性分析能够提供基因水平的详细信息,使鉴定更具准确性和遗传特异性。目前,常用分子生物学鉴定酵母菌株的遗传信息最直接检测对象为:染色体基因组DNA、核糖体DNA、线粒体DNA,具体方法主要有基于聚合酶链反应(PCR)的酵母核糖体基因序列分析,例如26S rRNA的D1/D2区域基因序列测序,5.8S rRNA-ITS-RFLP分析等。本研究对于1株未知菌株从表型到代谢图谱到基因型多种手段进行的鉴定,得出此菌株为浅白隐球酵母菌。由于其独特的生长环境,该酵母菌各方面的特性都比较好,产物中有含量比较高的多糖,而多糖的存在可能是菌体对环境中普遍存在的抗菌物质的反应,如表面活性物质、细菌毒素、噬菌体、抗生素、抗体等,所以野生菌株产生的胞外多糖对细菌的黏附以及在竞争环境中的存活和生长都具有重要的作用[3]。近年来,研究发现多种细菌的胞外多糖具有很强的生物学活性和医学作用,然而浅白隐球菌一般是一种病原菌,有进一步分析多糖的潜在研究价值。
1 材料与方法
1.1 材料
菌株:实验室保藏编号为J2002的菌株(由罗布泊地区分离得到);酵母菌基因提取试剂盒:OMIGA公司产品;PCR引物:由金斯瑞公司合成;KOD-Plus DNA Polymerase,dNTPs:TOYOBO公司产品;HhaⅠ、HaeⅢ、Hinf Ⅰ3种酶:TOYOBO公司产品;PCR扩增仪:Applied Biosystems公司生产;GIS-2009 凝胶成像仪:伯乐公司生产;DYY-6B电泳仪:北京六一公司生产;Bioloy生物自动分析仪以及96微孔板(YT板):华粤公司生产;其他培养基所用试剂均为市售分析纯试剂。
1.2 方法
1.2.1 酵母菌的鉴定
1.2.1.1 酵母菌形态观察 酵母菌在YPD斜面培养基(YPD培养基:葡萄糖2%,蛋白胨2%,酵母提取物1%,琼脂粉2%)30 ℃条件下培养2 d,直接刮取制成玻片,在显微镜下观察未染色以及染色后的酵母菌的形态,同时又将活化的酵母菌转接到液体培养基上30 ℃过夜培养,稀释涂布于平板上观察酵母菌的外观形态。
1.2.1.2 酵母菌生理生化试验 酵母菌的生理生化试验主要是利用Biolog自动分析仪来进行。将分离到的纯种用棉签挑到无菌水中,配成指定细胞浓度的(酵母菌为47%[4],由比浊仪测量浊度)菌悬液。将菌悬液按每孔100 μL的量加到YT板(即96微孔孵育板)后孵育(此孵育条件根据仪器扫描所要的培养条件来定,各种菌有不同的培养需要,酵母菌为 26 ℃ 孵育)。所有孔在刚开始时候都是无色的,当孵育一段时间之后,那些能被细胞利用的碳源孔中的呼吸作用增强了。增强呼吸作用导致四唑氧化还原染料被还原,变成紫色。同时,能被利用的碳源孔中的微生物也开始生长,导致浊度变高。孵育24、48、72 h后,通过YT板上显紫色及浊度变化所产生的指纹图谱同Biolog数据库中的数据进行比对。如果找到匹配的,所分离出来的微生物即可得到鉴定。
1.2.1.3 酵母菌的26S rDNA的D1/D2区域基因序列分析 以提取的酵母菌总DNA为模板,用真菌26S rDNA的 D1/D2 区通用引物NL1 和NL4[5](NL1:5′-GCATATCAATAAGCGGAAAAG-3′;NL4:5′-GGTCCGTGTTTCAAGACG-3′)作为上下游引物,扩增菌株26S rDNA的D1/D2区域片段,PCR条件为:94 ℃预变性2 min,94 ℃变性30 s,56 ℃退火30 s,68 ℃延伸45 s。PCR产物经电泳验证,将纯化后的PCR产物送至金斯瑞公司测序,拼接后的26S rDNA D1/D2区序列于NCBI-GenBank 数据库中的进行搜索,应用BLAST工具与已登陆的酵母菌26S rDNA 序列进行比对,并利用软件MEGA制成系统发育树。
1.2.1.4 酵母菌的5.8S rDNA-RFLP酶切 以提取的酵母菌的总DNA为扩增模版,以ITS1/ITS4[6](ITS1:5′-TCCGTAGGTGAACCTGCGC-3′;ITS4 5′-TCCTCCGCTTATTGATATGC-3′)为上下游引物扩增5.8S-ITS区域,PCR条件为:94 ℃预变性2 min,94 ℃变性30 s,58 ℃退火30 s,68 ℃ 延伸45 s。将扩增的片段用3种限制酶,分别是HhaⅠ、HaeⅢ、 Hinf Ⅰ[7]进行单酶切,酶切的片段在TBE缓冲液中电泳。电泳结果与由 Esteve-Zarzoso等在1999年首次做的5.8S rDNA-RFLP的酶切图谱大全[8]进行比对。
1.2.2 酵母菌生长条件的研究
1.2.2.1 温度对酵母菌生长的影响 酵母菌于YPD斜面培养基上30 ℃活化2 d,继而转接于YPD液体培养基,液体培养基的装液量为50 mL,接种量为2%。30 ℃过夜培养,调整到统一的D600 nm=1.0,进行2次扩大培养,培养条件相同,设计不同的温度;温度分别为27、30、33、36、39、41 ℃,不同温度下通过D600 nm值检测其细胞生长密度。
1.2.2.2 pH值对酵母菌生长的影响 酵母菌于YPD斜面培养基上活化2 d,培养条件同上,调整到统一的D600 nm=10,再次转接到YPD液体培养基中,设计不同的pH值:pH值分别为1.0、2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、110、12.0、13.0、14.0,在不同pH值下通过D600nm处的值简单检测其生长状况。
1.2.2.3 酵母菌生长曲线的研究 在YPD斜面培养活化酵母菌,转接到YPD培养液中过夜培养,调整到统一的D600 nm为1.0,2次转接于YPD培养液中,于30 ℃培养条件下,根据培养时间、生长密度,绘制出其培养周期内的生长曲线。
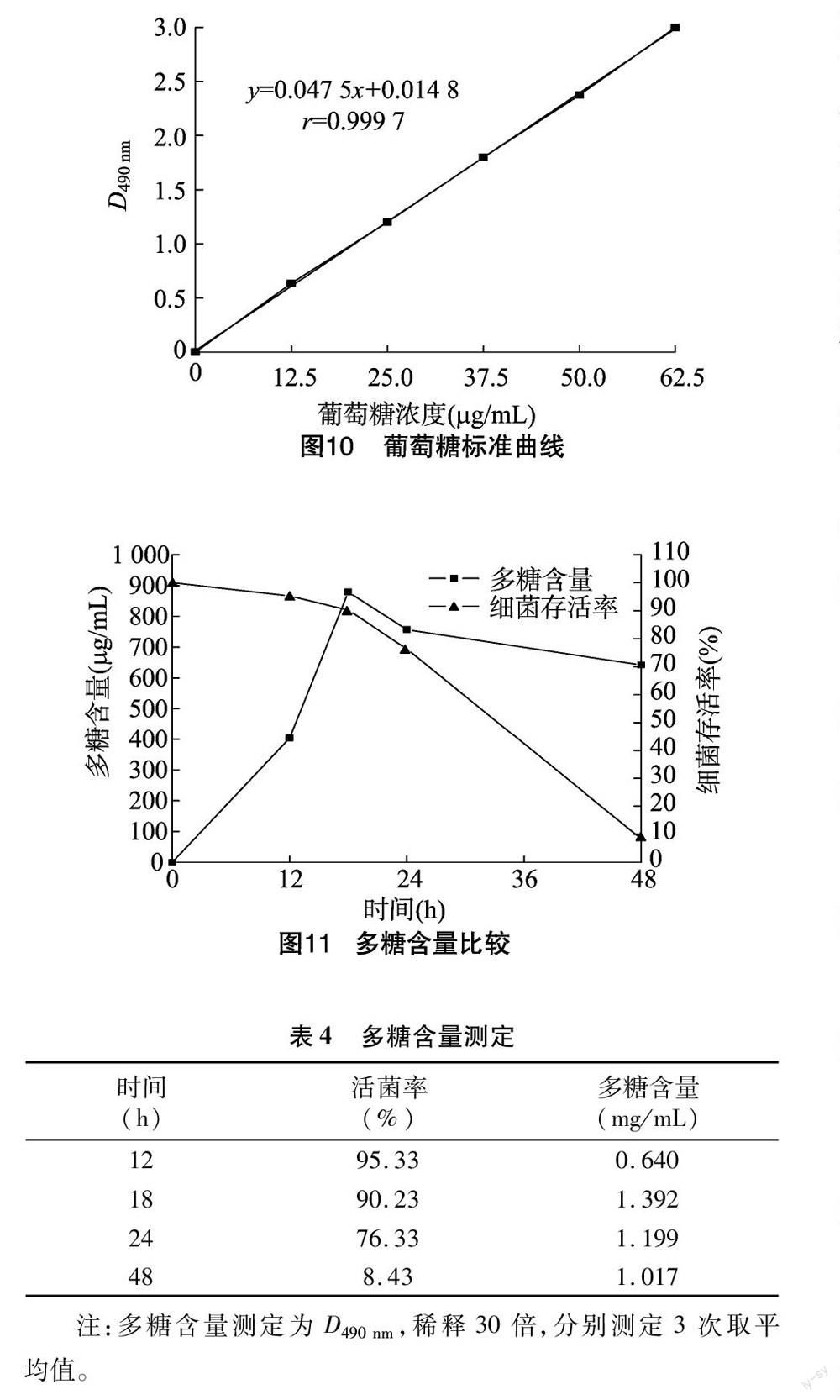
1.2.3 浅白隐球酵母产物的发现及含量测定 浅白隐球酵母的产物方面已报道过的一般为油脂[9-10],但是这株经过强辐射后的浅白隐球酵母的产物中有多糖。菌体以YPD培养基按上述培养条件培养6~8 h,控制菌数大约在1×107个/mL,按上述接种量转接至发酵培养基。发酵培养基含葡萄糖3%、硫酸铵0.3%、酵母提取物0.2%、水硫酸镁0.05%。培养基也以上述培养基条件培养,多糖含量以改进的苯酚-硫酸法跟踪测定[11]。10 mg葡萄糖定容至100 mL,根据表1内容绘制葡萄糖标准曲线。
2 结果与分析
2.1 酵母菌碳氮源的利用分析及其检测
利用Biolog自动扫描仪进行的分析,对碳/氮检测结果见表2。
由表2可以初步得出,该酵母菌是浅白隐球酵母。根据源数据进行分析,该酵母菌能利用多种碳氮源,具体利用情况见表3,并且经过验证试验发现,对于葡萄糖跟蔗糖的利用程度差不多,可利用碳源有:糊精、菊糖、纤维二糖、龙胆二糖、麦芽糖、麦芽三糖、松三糖、棉籽糖、海藻糖。处于临界值:乙酸、琥珀酸、异麦芽酮糖、山梨糖、水杨苷、山梨醇、阿拉伯糖醇。与《酵母菌的特征与鉴定手册》中浅白隐球酵母的同化试验数据相比大多碳氮源利用相同。
2.2 酵母菌的26S rDNA的D1/D2区域基因序列以及树状图分析
以NL1 和NL4 作为上下游引物,扩增菌株26S rDNA的D1/D2区域片段,片段长度在700 bp左右,电泳结果见图1。
该电泳结果条带单一,将此产物纯化后送至金斯瑞公司测序,反馈的序列经过比对的系统发育树见图2。
系统发育树的分支表示是亲缘关系,离得越远亲缘关系越低,彼此靠近的二者基本可以认定为同种(如果blast出来后发现二者同源性非常高的话),而它们之间那个数值表示这个同源性的可靠程度多高。数值越高表示二者的亲缘关系(也就是同种)越可信。一般要>95才能表示是同种,66以上可以表示是亚种或者变种之类。构建此酵母系统发育树时,选择了相似性高达95%以上的序列作为比对对象,分析出该酵母菌与模式菌株10666等构成1个大分支,与浅白隐球酵母为同1个种,与罗伦隐球酵母为亚种关系或者变种(图2)。
2.3 酵母菌5.8S rDNA-RFLP单酶切结果
以引物扩增5.8S-ITS区域PCR产物电泳见图3,片段长度大概在600bp左右,酶切片段见图4。图中目的条带清〗
晰而明亮,长度约为600 bp,但是有杂带和引物二聚体条带,本试验将目的条带切胶回收后进行单酶切反应。
从图3、图4看出,第一泳道为HaeⅢ酶切片段,片段长度为500+70+60 bp;第二泳道为HhaⅠ酶切片段,片段长度为330+330 bp;HinfⅠ酶切片段,片段长度为350+160+120 bp。参照 Esteve-Zarzoso等在1999年首次做的5.8S rDNA-RFLP的酶切图谱大全的结果可以判定此酵母菌为浅白隐球酵母。
2.4 温度、pH值对浅白隐球酵母生长的影响
将浅白隐球酵母培养于YPD培养基上,进行2次转接后以D600nm为指标检测其生长状态,结果见图5、图6。
由于该浅白隐球酵母取自新疆羅布泊强辐射地区,生长特性比一般酵母菌顽强,能在比较高的温度(39 ℃)下生长,除此之外强酸强碱(pH值3~13)下也能较好地生长。相关特性还需进一步研究。
2.5 浅白隐球酵母在最适温度以及pH值下的各生长时期
浅白隐球酵母于最适培养条件下探究其各个时期的具体生长时间。
这株浅白隐球酵母的各生长时期与典型的酵母菌的生长有很大的相似之处,在生长4~5 h后进入对数生长期,在 22~24 h 后进入延缓期,27 h后进入衰退期(图7)。
2.6 浅白隐球酵母形态特征
此株浅白隐球酵母呈现圆形或者卵圆形,以出芽生殖为主,菌落为乳白色,圆形,凸起,边缘光滑(图8、图9)。
2.7 浅白隐球酵母多糖的含量
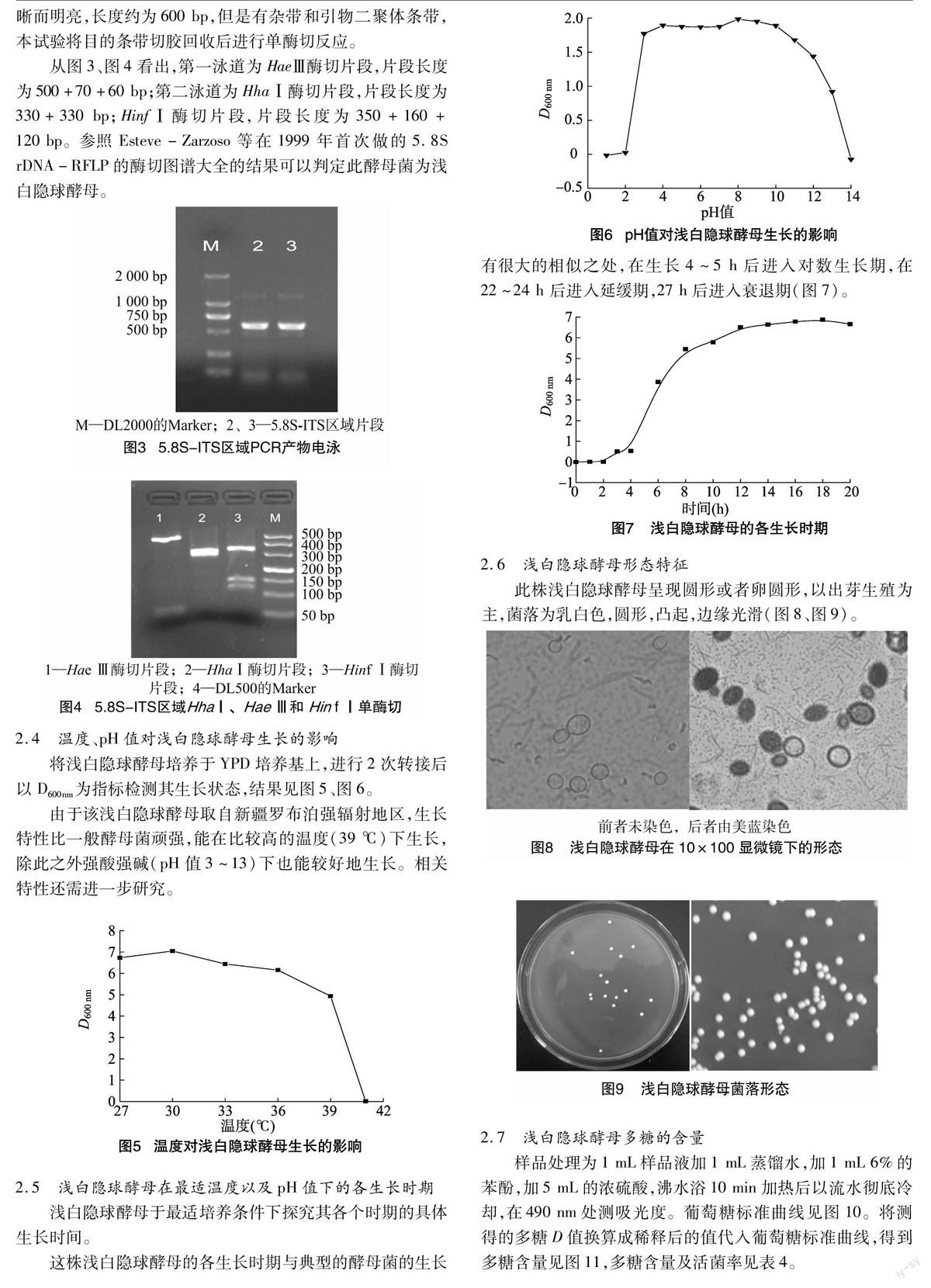
样品处理为1 mL样品液加1 mL蒸馏水,加1 mL 6%的苯酚,加5 mL的浓硫酸,沸水浴10 min加热后以流水彻底冷却,在490 nm处测吸光度。葡萄糖标准曲线见图10。将测得的多糖D值换算成稀释后的值代入葡萄糖标准曲线,得到多糖含量见图11,多糖含量及活菌率见表4。
由图10得到葡萄糖标准曲线拟合方程为y=0.047 5x+0.014 8,r=0.999 7。该曲线方程的趋势线拟合度很高,相关系数高达0.999 7。
根据以上结果可以得出,浅白隐球酵母产物中的多糖含量最高可达0.9 mg/mL,在摇瓶发酵至18 h后,产量达到最高后随着菌体死亡速度的加快而下降。
3 结论与讨论
经多种方法鉴定得知,该酵母菌为浅白隐球酵母。该菌株生长能够耐受较高温度,最高温度能达到39 ℃, 该菌株能在强酸强碱中生存,最酸坏境pH值仅为3.0,最高碱度pH值可达13。经试验验证发现,自新疆罗布泊地区分离所得的该浅白隐球酵母菌具有一定的抗辐射性能。酵母菌耐辐射性质揭示,可能该酵母菌自身所产生的物质如多糖、蛋白质或者多糖与蛋白的复合物,本菌株的产物可能是多糖具有抗辐射性能,相关报道认为,多糖等物质能耐受辐射,王璐璐研究发现,多糖AEPS具有清除自由基的能力,尤其是对羟基自由基和超氧阴离子的清除能力非常显著[12];也有可能是酵母菌本身的生长、代谢机制在外界条件下发生了变化,进一步研究,有可能找到一种微生物耐辐射的新机制,有望将这类酵母菌选作其他有利于微生物生长的候选产物的宿主细胞;也有可能就是此酵母菌自身的某些特定基因的表达能耐受强辐射,张永芹等利用pprI 基因转染救治小鼠致死性辐射损伤的研究表明,PprI 蛋白质有可能成为一种新的来自原核生物的辐射防护剂[13]。他们研究发现,pprI 基因是一个对电离辐射抗性起关键作用的DNA 修复开关基因。
无论是寻找到抗辐射产物,还是寻找耐辐射相关基因,对这1株特殊条件地域获得的浅白隐球酵母的进一步研究都有可能发现宿主细胞或者表达产物的新视野。
参考文献:
[1]李金霞,程 池,姚 粟,等. Biolog微生物自动分析系统——酵母菌鉴定操作规程的研究[J]. 食品与发酵工业,2006,32(7):50-53.
[2]程 池,杨 梅,李金霞,等. 微生物自动分析系统——细菌鉴定操作规程的研究[J]. 食品与发酵工业,2006,32(5):50-54.
[3]Costerton J W,Irvin R T,Cheng K J. The bacterial glycocalyx in nature and disease[J]. Annual Review of Microbiology,1981,35:299-305.
[4]Praphailong W,van Gestel M,Fleet G H,et al. Evaluation of the biolog system for the identification of food and beverags yeasts[J]. Letters in Applied Microbiology,1997,24:455-459.
[5]Kurtzman C P,Christie J R. Identification and phylogeny of ascomycetous yeasts from analysis of nuclear large subunit(26S) ribosomal DNA partial sequences[J]. Antonie van Leeuwenhoek,1998,73(4):331-371.
[6]Tay S T,Na S L,Tajuddin T H. Natural occurrence and growth reaction on canavanine-glycine-bromothymol blue agar of non-neoformans Cryptococcus spp.in Malaysia[J]. Original Article,2008,52:515-519.
[7]N′ Guessan K F , Brou K,Jacques N ,et al.Identification of yeasts during alcoholic fermentation of tchapalo,a traditional sorghum beer from Cted,Ivoire[J]. Antonie van Leeuwenhoek,2011,99:855-864.
[8]Esteve-Zarzoso B,Belloch C,Uruburu F,et al. Identification of yeasts by RFLP analysis of the 5.8S rRNA gene and the two ribosomal internal transcribed spacers[J]. International Journal of Systematic Bacteriology,1999,49:329-337.
[9]吳开云,程俊文,李纪元,等. 浅白隐球酵母产油工程菌液体深层发酵技术研究[J]. 湖南农业科学,2012(21):12-15.
[10]中国林业科学研究院亚热带林业研究所. 一种高产油酸的浅白隐球酵母工程菌株的构建方法:中国,CN 101892250 A[P]. 2010-11-04.
[11]Dubois M,Gilles K A,Hamilton J K,et al. A colorimetric method for the determination of sugars[J]. Nature,1951,28(7):167-168.
[12]王璐璐. 土芽孢杆菌TS3-9胞外多糖的初步研究[D]. 杭州:浙江工商大学,2013:1-82.
[13]张永芹,周 辉,陈 洁,等. 耐辐射球菌PprI蛋白质表达及其纯化的实验研究[J]. 辐射研究与辐射工艺学报,2011,29(2):117-122.

