奥拉西坦的逐步冻凝结晶
杜世超,李康丽,张育,高志峰,王晨光,郭柏松,李代禧,汤伟伟,龚俊波
(1 国家工业结晶工程技术研究中心,天津 300072;2 天津化学化工协同创新中心,天津 300072; 3 石药集团欧意药业有限公司,河北 石家庄 050051;4 上海东富龙科技股份有限公司,上海 201109; 5 上海理工大学,上海 200093)
引 言
奥拉西坦,英文名Oxiracetam,化学名为4-羟基-2-氧代-1-吡咯烷乙酰胺,其结构式如图1 所示,分子式为C6H10N2O3。奥拉西坦是一种被广泛应用的治疗脑损伤及记忆障碍等疾病的处方药,它的多种临床功效已被广泛证实[1-3]。奥拉西坦有左旋、右旋两种异构体,目前药品中多用其外消旋体,左旋奥拉西坦及外消旋奥拉西坦分别有多晶型、水合物及共晶被报道[4-6],不同的晶型可能会导致不同的药效。现在被广泛使用的奥拉西坦处方药剂多为胶囊和针剂,其中奥拉西坦针剂是由“冻干”技术制成,经过冻干技术得到的奥拉西坦处方粉针剂复水性好,药效明显。

图1 奥拉西坦结构式Fig.1 Chemical structure of oxiracetam
“冻干”技术是真空冷冻干燥技术的简称,是将湿物料冻结到共晶点温度以下,使溶剂和溶质均变成固态,然后在一定的温度和真空度下利用溶剂的升华脱除溶剂而获得干燥制品的技术[7-9]。冻干过程中一般要加入冻干保护剂,冻干保护剂可以提高冻干湿物料的的共熔点和共晶点,从而提高预冻温度和升华干燥及解析干燥的温度,加快冻干过程,节省能量[10-11]。冻干的一个核心步骤为预冻步骤,预冻过程的好坏对后期的干燥尤其是升华干燥影响很大,而预冻结果的好坏取决于预冻过程中各组分的晶体形态。预冻过程事实上就是一个降温逐步冻凝的结晶过程[12-15],目前对预冻工艺的研究基本上集中在确定预冻温度和预冻速率上[16-17],而对预冻过程中的微观粒子变化(结晶)研究较少,无文献报道奥拉西坦的冻干相关内容。
奥拉西坦冻干粉针剂的处方为奥拉西坦、山梨醇和水[18],不同于传统的低浓度的冻干过程,奥拉西坦和山梨醇处方利用高浓度(固体质量分数超过40%)的水溶液进行冻干生产。由于体系的黏度较大,不利于药物活性组分奥拉西坦和冻干保护剂山梨醇的晶体的形成,利用传统的简单预冻工艺,极易使溶液冻凝成玻璃态,造成升华干燥困难,甚至引起“喷瓶”的现象,导致冻干时间长、成品率低。本文从分子角度分析预冻过程,从逐步冻凝结晶的角度考虑改善预冻工艺。首先,通过分子模拟计算了山梨醇和奥拉西坦之间的相互作用能,从理论上评估山梨醇对奥拉西坦结晶的影响。并通过离线测试手段确定奥拉西坦处方冻干产品的晶体形态。通过在线手段探究不同的预冻工艺对冻干过程中各组分结晶过程的影响,分析玻璃态形成的原因。然后改变预冻工艺,避免处方溶液冻凝成玻璃态,利用各组分在逐步冻凝过程中的出晶顺序,使得奥拉西坦、水和山梨醇组分分别冻凝形成微晶,从而制造通畅的孔道,极大缩短了冻干所需时间,提高了药品的成品率。
1 实验材料和方法
1.1 材料
奥拉西坦(纯度>99%,石药集团欧意药业);山梨醇(纯度>99%,石药集团欧意药业);去离子水(市售)。
1.2 实验装置
冻干机(上海东富龙科技股份有限公司)。
1.3 分析测试仪器
粉末X 射线衍射仪(PXRD,D/Max-250,日本理学电机株式会社):X 射线发生器CuKαλ= 0.15418 nm;电压/电流40 kV/100 mA;扫描范围2°~50°;扫描步长0.02°;扫描速度8(°)·min-1。单晶X 射线单晶衍射仪(SXRD,Riguku R-rapid II日本理学电机株式会社):X 射线发生器MoKαλ=0.071073 nm;电压/电流50 kV/90 mA。
差示扫描量热仪(DSC,DSC1/500,瑞士梅特勒托雷多公司):高纯氮气流速50 ml·min-1;测量温度范围-40~25℃,降温速率0.35~10℃·min-1。
热台显微镜(LTS350,德国徕卡公司):控温部分型号TMs94,降温速率0.35~10℃·min-1。
拉曼光谱(RXN2,美国Kaiser 公司):激发波长785 nm;扫描范围100~1890 cm-1;扫描步长4 cm-1;曝光时间30 s。
1.4 单晶培养
取奥拉西坦2 g,室温下溶于5 ml 的去离子水中,用0.22 μm 的滤膜过滤至试管中,室温下缓慢蒸发7 d,即可得到奥拉西坦晶体,挑选较好的晶体做X 射线单晶衍射。
1.5 逐步冻凝结晶实验
奥拉西坦处方的制备:奥拉西坦(40 g)+山梨醇(12 g)+水,配备100 ml 溶液,过0.22 μm 滤膜备用。
玻璃态预冻:分别以0.35、1、5 和10℃·min-1的降温速率将奥拉西坦处方溶液从25℃连续降温至-40℃,-40℃恒温2 h。分别用DSC 和热台显微镜观测预冻冻凝结晶过程。
晶体态预冻:分别以0.5、1、5 和10℃·min-1的降温速率将奥拉西坦处方溶液从25℃连续降温至-17℃,在-17℃恒温2 h 以上,再降温至-40℃,-40℃恒温2 h 以上。分别用DSC 和热台显微镜观测预冻过程中各组分的结晶行为。
1.6 冻干实验
将配好的奥拉西坦处方放置在冻干机中,分别用1.5 节所述预冻方法预冻处方溶液,再用相同的条件进行升华干燥和解析干燥,得到冻干产品,用PXRD 和拉曼测试冻干产品。
2 实验结果与讨论
2.1 山梨醇对奥拉西坦结晶的影响
由于粉针剂产品的复水性和溶解速率与产品的晶习和粒度大小相关,因此需要探究山梨醇对奥拉西坦晶习的影响。山梨醇本身具有多个羟基,理论上很容易跟水及奥拉西坦分子发生分子间相互作用,为了探究山梨醇对奥拉西坦晶习的影响,用Material Studio 软件计算山梨醇和奥拉西坦分子间的相互作用。
经过单晶衍射,解析出奥拉西坦的晶体结构。由单晶数据可以看出本实验所用的外消旋奥拉西坦的原料在水中得到的晶体为无水晶型,晶体为正交晶系,空间群为Pca21,晶胞参数见表1。
根据单晶数据计算出的粉末图谱和原料本身的粉末衍射图谱衍射峰位置一致,如图2 所示,说明解析出的单晶和原料是同一晶型,可以用单晶数据进行进一步的分子模拟计算。
对晶体结构进行几何优化和动力学优化后,选用BFDH 模型对奥拉西坦进行晶习模拟,得到奥拉西坦为块状晶习,和奥拉西坦的原料比较接近。选取主要的3 个晶面:100、010 和001,如图3 所示。
切出晶面,构建真空层,弛豫晶体表面的单层晶体分子,进行分子动力学计算,步长1 fs,动力学时长为200 ps。构建山梨醇聚合物分子,进行动力学优化,待分子处于平衡后,将其置于晶面上方的真空层中。弛豫晶体表面的单层分子和聚合物分子,进行分子动力学计算,步长为0.01 fs,动力学时长为200 ps。计算山梨醇和奥拉西坦各个晶面的相互作用,通过体系总能量、晶面能和冻干保护剂山梨醇的能量得到[19-21]。晶面的相互作用由式(1)计算,得到的结果见表2。
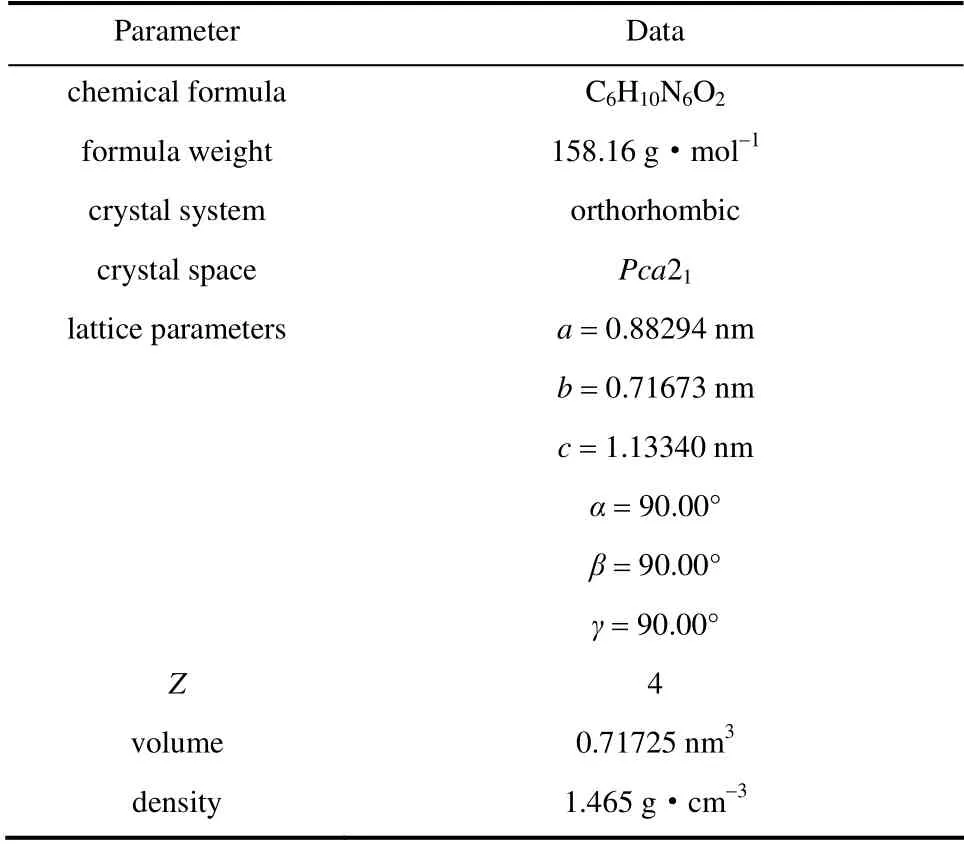
表1 奥拉西坦的单晶结构数据Table 1 Crystal structure data of oxiracetam
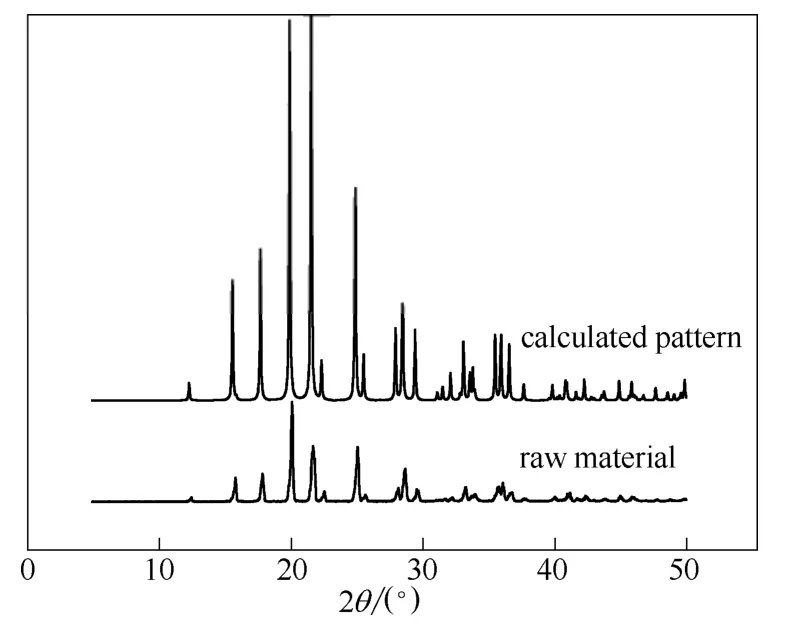
图2 奥拉西坦粉末衍射Fig.2 PXRD patterns of oxiracetam
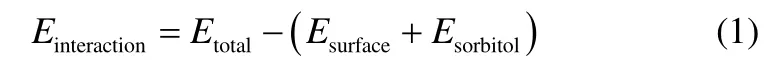
式中,Einteration为山梨醇和奥拉西坦之间的相互作用能;Etotal为奥拉西坦和山梨醇的总能量;Esurface为奥拉西坦的晶面能;Esorbital为山梨醇的总能量。
表中,Einteraction为总的晶面相互作用能, EvanderWaals为范德华力导致的山梨醇分子对晶面的相互作用能,由计算数值可以看出,山梨醇分子对各个晶面的相互作用能都很小。这是因为奥拉西坦3 个主要晶面中暴露的基团都很少,尤其是羟基,几乎都在晶体内部,这样很难与山梨醇形成氢键等相互作用。即便是在模拟环境的真空条件下,山梨醇对奥拉西坦各个晶面的作用都很小,对奥拉西坦的晶习影响很微弱。而在处方溶液中,山梨醇更容易和水形成氢键,对奥拉西坦的晶习影响更小。实验也验证了这个结论。因此,在冻干过程中山梨醇并不会影响奥拉西坦的晶习。

图3 奥拉西坦主要晶面剖析图Fig.3 Main crystal surface of oxiracetam

表2 山梨醇对奥拉西坦各晶面的作用能Table 2 Interaction energy of sorbital on oxiracetam crystal surface
综合上面的研究发现,山梨醇的浓度可以适当增大而不会影响奥拉西坦的晶型和晶习,同时又能提高共熔点和共晶点。
2.2 冻干过程中各组分晶型的变化
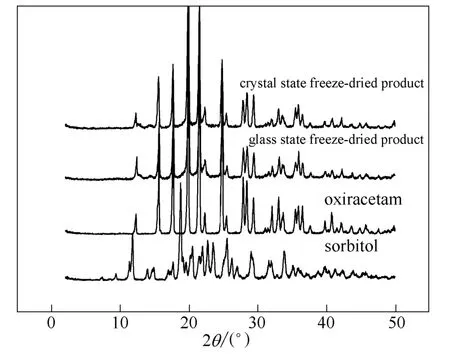
图4 奥拉西坦冻干产品粉末衍射图谱Fig.4 PXRD patterns of freeze-dried product of oxiracetam
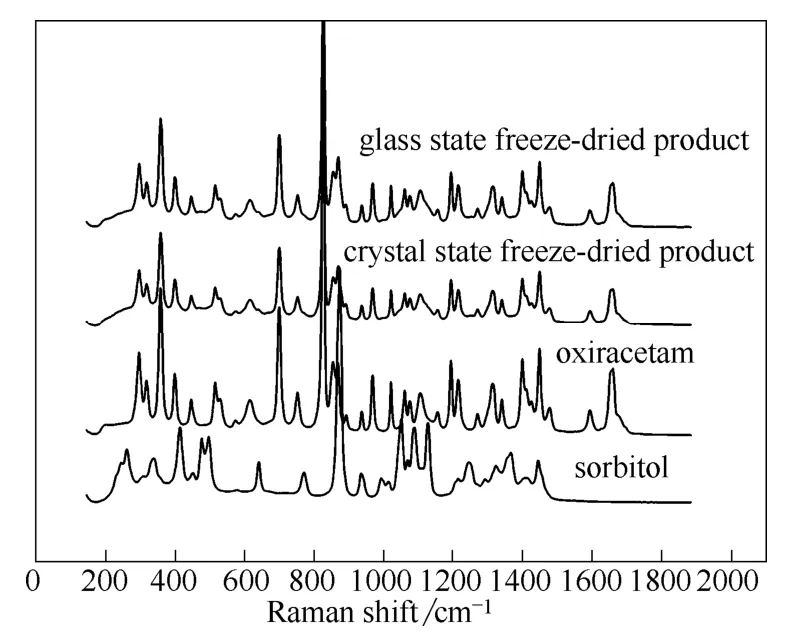
图5 奥拉西坦冻干产品的拉曼图谱Fig.5 Raman patterns of freeze-dried product of oxiracetam
药物晶型会对药效产生影响,因此必须确认冻干前后处方中各组分的晶型变化。分别按照玻璃态预冻和晶态预冻工艺对奥拉西坦处方进行预冻,并冷冻干燥至无水状态,对所得冻干产品进行PXRD 和拉曼光谱测试,结果如图4 和图5 所示。PXRD图谱显示,不同的冻干工艺得到的产品的粉末衍射的特征吸收峰,基本上和奥拉西坦原料吻合,并未发现山梨醇的晶体特征峰,山梨醇只有类似于无定形的峰出现。因此,冻干产品中奥拉西坦是以晶体态存在,而山梨醇最终是以无定形态存在。
拉曼图谱显示,两种冻干工艺得到的产品也只显示晶体奥拉西坦的特征峰,山梨醇的特征峰几乎全都消失。因此,山梨醇在最终的产品中是以无定形的形式存在,这说明冻干保护剂山梨醇不影响奥拉西坦的晶型。同时拉曼图谱中奥拉西坦的吸收峰位置均和原料一样,并没有产生峰的偏移或者不同于山梨醇和奥拉西坦的新峰出现,说明奥拉西坦和山梨醇并不形成共晶或者盐,而是以单独的组分混合存在。
2.3 奥拉西坦处方简单冻凝过程研究
实验中所用的几种降温速率的预冻条件下,冻干所需时间均很长,而且降温速率越快,最后越不易升华干燥和解析干燥,运用此种预冻工艺,一批产品冻干时间要7 d 左右,成品率却只有20%左右。运用冻干技术中经常采用的“退火”技术,效果也不明显。为了探究其原因,用在线的热台显微镜,观察预冻过程中体系逐步冻凝的结晶状态。
以0.35℃·min-1的降温速率为例,分析奥拉西坦处方玻璃态冻凝过程中的结晶过程。热台显微镜分析结果显示(图6):从初始温度的澄清溶液(a,25℃)开始逐渐降温,溶液中逐渐出现六边形块状晶体,并慢慢生长(b,3.6℃到c,-5.7℃),直至近饱和状态,经判断改晶体为奥拉西坦晶体。此过程在快速降温过程中未发现,说明逐步冻凝前期奥拉西坦的过饱和度并不大,而且在快速降温时介稳区更宽,不易出晶。继续降温,有雪花状晶体出现和生长(d,-11.8℃到e,-14.1℃),判断该晶体为冰晶体。到-16.5℃左右,冰晶体周围出现一些性状同奥拉西坦相似的晶体(f 中的黑色固体),这是由于水快速结晶后奥拉西坦的浓度快速上升,导致其过饱和度急剧升高而爆发出晶。继续降温,溶液变 得致密,不再有晶体折光性(f,-21.3℃),分析为山梨醇及溶液体系内各组分同时冻凝为玻璃态。继续降温和养晶,冻凝产品仍然为玻璃态(h,-40℃)。

图6 奥拉西坦处方玻璃态预冻过程热台图片Fig.6 Hot-stage microcopy pictures of glass state prefreezing process
DSC 测试结果如图7 所示,热量曲线中显示一个大的吸热峰,结合热台显微镜的结果综合分析:在-10℃之前几乎没有看到奥拉西坦的结晶放热峰,这说明前期奥拉西坦出晶量比较少,降温速率越快前期奥拉西坦的出晶越少。该放热峰的主体部分(-17~-11℃)对应着冰晶体的产生,同时伴随着奥拉西坦的部分爆发出晶产生的热量(图6 的d到f 过程),但是紧接着产生了一个玻璃化转变的峰-21.3℃,进一步证明山梨醇和剩余组分冻凝成玻 璃态。

图7 奥拉西坦处方玻璃态预冻过程Fig.7 DSC curve of glass state prefreezing process
综合分析得出结论:连续降温至预冻温度,会使处方冻凝形成致密的类玻璃态,使得山梨醇、奥拉西坦和水不能通过冻凝结晶分离出来,而是紧密地连在一起。这导致水分很难升华出来,升华速度极慢,还容易造成产品上移、喷瓶等残次品,这就是导致目前冻干工艺有缺陷的关键问题。而形成玻璃态的原因是该冻凝过程使山梨醇冻凝成玻璃态,进而使整个体系冻凝成玻璃态。
2.4 奥拉西坦变速降温逐步冻凝结晶过程研究
为了防止预冻过程中各组分冻凝成玻璃态,需要改变预冻工艺,使各组分分别冻凝成微晶。上面实验已经发现单纯改变降温速率的恒速连续降温冻凝不能避免玻璃态的产生,可以考虑变速降温的逐步冻凝。奥拉西坦处方是三组分体系,而且体系黏度很大,同时奥拉西坦和山梨醇在水中的溶解度都很大,由于传质困难,很容易在逐步冻凝过程中形成玻璃态。如果能确定一个温度点,同时确定一个平衡时间,使三组分能分别冻凝结晶出各组分晶体,就可以避免玻璃态的形成。
首先,需要确定冻凝分离的温度点。根据上面玻璃态冻凝过程的研究发现,在-21.3℃之前,处方溶液中并未形成玻璃态,而是逐渐冻凝出了奥拉西坦晶体和冰晶体。而从图7 可以看出,从-17℃开始,放热峰开始变缓,直至出现玻璃态,而山梨醇在上述冻凝过程中始终没有从体系中结晶出来。分析发现,-17℃可能为晶态到玻璃态转变的一个关键节点,如果在-17℃增加一个恒温段,可能会使各组分充分地平衡,进而冻凝分离出各组分的晶体,因此先确定-17℃为分离温度点。
其次需要确定分离平衡时间,初步设定恒温时间为10 h,可以根据DSC 的结果确定实际需要的平衡时间。因此,确定新的预冻冻凝条件为25℃处方溶液先恒速降温至-17℃,恒温10 h,再恒速降温至-40℃恒温一段时间。
热台显微镜显示了整个预冻冻凝过程,如图8所示:澄清溶液(a,25℃),奥拉西坦先出晶和生长(b,-5.3℃到c,-8.1℃),直至近饱和状态;然后冰晶体出现和生长(d,-10.9℃到e,-12.3℃),药液被浓缩;到-17℃恒温过程时,先是奥拉西坦产生微晶,一段时间后显微镜下出现不同于奥拉西 坦和冰晶的晶体(f 中的黑色晶体),分析确定是山梨醇的结晶,继续降温直至-40℃,冻凝产品为晶体态。
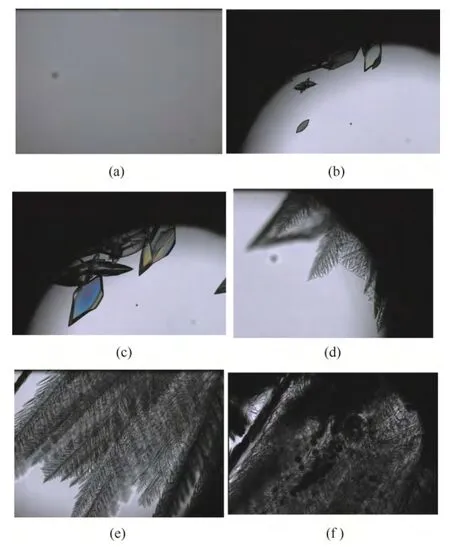
图8 奥拉西坦处方晶体预冻过程Fig.8 Hot-stage microcopy pictures of crystal state prefreezing process
图9 为DSC 监测结果:除了和前面相同的奥拉西坦晶体和冰晶产生的放热峰,在-17℃恒温过程中,DSC 图谱上产生了一个新的结晶放热峰[图9 (b)],对应着山梨醇的结晶峰,该结晶峰在恒温2 h之后趋于平缓,证明体系在该温度下达到平衡,继续降温又有放热效应,对应着各组分缓慢析出微晶。山梨醇结晶与否是控制整个预冻冻凝结晶过程的关键因素。
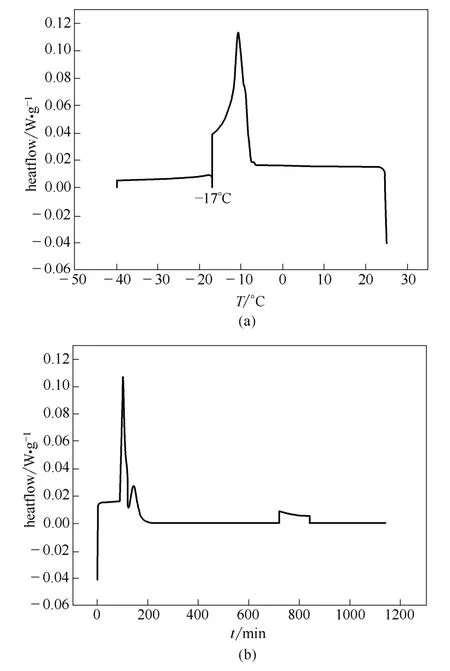
图9 奥拉西坦处方晶体预冻过程Fig.9 DSC curve of crystal state prefreezing process
改变预冻工艺条件后,形成的是晶态冻凝产品,里面的药物活性组分(奥拉西坦)以微晶的形式存在,形成了通畅的升华孔道,十分有利于升华干燥过程,而且能有效避免吹瓶现象的发生,使生产周期由7 d 左右缩短到2 d,成品率达到95%以上,所得产品为松散的块状固体,复水性很好。但是最终经过升华干燥和解析干燥后,奥拉西坦仍然为晶态,而山梨醇却转变成无定形的形式存在,山梨醇晶型的转化机理还在研究之中。
根据实验结果,开发出一种新型的预冻工艺,即将室温下的奥拉西坦处方溶液以 0.5 ~10℃·min-1的降温速率恒速降温至-17℃,接着在 -17℃恒温2 h 以上,然后以一定的降温速率降温至 -40℃,再恒温冻晶2 h 以上。通过以上预冻工艺,各组分可分别逐步冻凝结晶为微晶态,很容易进行后续的升华干燥和解析干燥。目前该工艺已在石药集团欧意药业实现放大和产业化,该工艺使冻干时间和能耗大幅度减少,产品质量得到很大提高,经济效益十分显著。
3 结 论
(1)经过分子模拟计算得出山梨醇和奥拉西坦晶体各晶面的相互作用能很小,在奥拉西坦处方的冻干过程中几乎不影响奥拉西坦的晶习。实验验证山梨醇在冻干过程中也不影响奥拉西坦的晶型,冻干产品中奥拉西坦以晶体态存在,而山梨醇以无定形形式存在。
(2)简单逐步冻凝工艺(玻璃态预冻),会使山梨醇冻凝成玻璃态,导致3 个组分一起冻凝成玻璃态,进而使后续冻干步骤非常困难。
(3)通过改变预冻的降温曲线,在产生玻璃态之前增加了一个低温养晶的过程,使山梨醇、奥拉西坦和水都逐步冻凝出微晶,制造了通畅的升华孔道,大大加速了后期的升华干燥。
(4)从分子角度和逐步冻凝结晶的角度分析预冻过程,首创了低温养晶、结晶、冻晶升华工艺,冻干所需时间大幅度缩短,产品质量得到很大提高。突破了低共熔点高浓度物质冻干的技术瓶颈,解决了类玻璃态物质冻干产业化的技术难题,为类似产品开发新的冻干工艺提供了新思路。
符 号 说 明
a,b,c ——分别为晶轴长度
Einteration——相互作用能
Esorbital——山梨醇分子间的能量
Esurface——晶面能
Etotal——奥拉西坦和山梨醇的总能量
EvanderWaals——基于范德华力的相互作用能
Z ——晶胞分子数
α, β, γ ——晶轴角
[1]Belfiore P, Ponzio F, Biagetti R, Berettera C, Magnani M, Pozzi O.Oxiracetam prevents the hippocampal cholinergic hypofunction induced by the NMDA receptor blocker AP7 [J].Neuroscience Letters, 1992, 143 (1): 127-130.
[2]Spignoli G, Pepeu G.Oxiracetam prevents electroshock- induced decrease in brain acetylcholine and amnesia [J].European Journal of Pharmacology, 1986, 126 (3): 253- 257.
[3]Saletu B, Linzmayer L, Grünberger J, Pietschmann H.Double-blind, placebo-controlled, clinical, psychometric and neurophysiological investigations with oxiracetam in the organic brain syndrome of late life [J].Neuropsychobiology, 1985, 13 (1/2): 44-52.
[4]Ye Lei.(S)-4-hydroxy-2-oxo-1-pyrrolidineacetamide racemate crystal form ii and preparation method therefor [P]: US, 14/237894.2012-4-24.
[5]Iriuchijima S, Kobayashi H, Aoki K, et al.Process for producing oxiracetam [P]: U.S, 4686296.1987-8-11.
[6]Wang Z Z, Chen J M, Lu T B.Enhancing the hygroscopic stability of S-oxiracetam via pharmaceutical cocrystals [J].Crystal Growth & Design, 2012, 12(9): 4562-4566.
[7]Mellor J D.Fundamentals of Freeze-Drying [M].London: Academic Press Inc.Ltd., 1978.
[8]Pikal M J.Freeze-drying of proteins.Process, formulation, and stability [J].ChemInform, 1995, 26(4).DOI: 10.1002/chin.199504315.
[9]Liapis A I, Pim M L, Bruttini R.Research and development needs and opportunities in freeze drying [J].Drying Technology, 1996, 14 (6): 1265-1300.
[10]Yu Jianping, Liu J H, Pu L Q, Cui Xiangdong, Wang Changzheng, Ouyang S L, Gao Dayong.Freeze-drying of human red blood cells: influence of carbohydrates and their concentrations [J].Cell Preservation Technology, 2004, 2 (4): 270-275.
[11]Zhou Xinli (周新丽), Liu Jianfeng (刘建峰), Zhang Shaozhi (张绍志), Chen Guangming (陈光明).Thermal analysis on lyoprotectants for biomaterials [J]Journal of Refrigeration (制冷学报), 2008, 29 (5): 54-57.
[12]Wang Jingkang (王静康).Crystallization (结晶)//Shi Jun (时钧), Wang Jiading (汪家鼎), Yu Kuo Tsung (余国琮), Chen Minheng (陈敏恒).Handbook of Chemical Engineering (化学工程手册) [M].Beijing: Chemical Industry Press.1996.
[13]Dubochet J, Chang J J, Freeman R, Lepault J, McDowall A W.Frozen aqueous suspensions [J].Ultramicroscopy, 1982, 10 (1): 55-61.
[14]Liu H, Lelièvre J.Transitions in frozen gelatinized-starch systems studied by differential scanning calorimetry [J].Carbohydrate Polymers, 1992, 19 (3): 179-183.
[15]Varshney D B, Kumar S, Shalaev E Y, Kang S W, Gatlin L A, Suryanarayanan R.Solute crystallization in frozen systems—use of synchrotron radiation to improve sensitivity [J].Pharmaceutical Research, 2006, 23 (10): 2368-2374.
[16]Zhu Liang(朱亮).Effects of pre-freeze in the freeze drying process [J].Drying Technology & Equipment (干燥技术与设备), 2014, 12 (1): 32-34.
[17]López-Urueña E, Alvarez M, Gomes-Alves S, et al.Tolerance of brown bear spermatozoa to conditions of pre-freezing cooling rate and equilibration time [J].Theriogenology, 2014, 81 (9): 1229-1238.
[18]Gao Zhifeng(高志峰).A freeze-dried powder and preparation method of oxiracetam [P]: CN, 102274195 A.2011-07-18.
[19]Yani Y, Chow P S, Tan R B H.Molecular simulation study of the effect of various additives on salbutamol sulfate crystal habi [J].Molecular pharmaceutics, 2011, 8 (5): 1910-1918.
[20]Schmidt C, Ulrich J.Morphology prediction of crystals grown in the presence of impurities and solvents—an evaluation of the state of the art [J].Journal of Crystal Growth, 2012, 353 (1): 168-173.
[21]Gupta P, Thilagavathi R, Chakraborti A K, Bansal A K.Role of molecular interaction in stability of celecoxib-PVP amorphous systems [J].Molecular Pharmaceutics, 2005, 2 (5): 384-391.

