氯化铁催化木糖降解制备糠醛反应动力学
马赛,李凭力,朱涛,林龙
(1天津大学化工学院化学工程研究所,天津 300072; 2天津市膜科学与海水淡化技术重点实验室,天津 300072)
生物质是一种可再生资源,同时也是唯一一种可再生碳源。发展生物质能源是节能减排、发展低碳经济的主要措施之一,是解决未来能源危机的重要途径[1-2]。我国生物质资源非常丰富,每年产生的植物秸秆就达8亿吨。植物秸秆主要由纤维素、半纤维素和木质素构成。纤维素是由葡萄糖联结而成的高分子聚合物,它主要应用于取代石油和粮食来生产乙醇等。半纤维素由不同的戊糖聚合而成,包括木聚糖、阿拉伯聚糖等,在酸性条件下,它可以水解得到以木糖为主的单糖,得到的单糖通过脱水环化进一步生成糠醛[3-4]。糠醛不仅在工业上有着很重要的用途,还可作为化工原料发生氢化、氧化、氯化、硝化和缩合等化学反应,产生1600多种衍生物,产品覆盖石油化工、合成树脂、食品、医药、精细化工以及合成纤维等诸多行业[5]。
戊糖降解生成糠醛的动力学研究通常使用木糖作为原料,阿拉伯糖的降解过程类似于木糖[6]。早期的动力学模型可追溯到20世纪40年代,Dunlop[7]使用纯木糖作原料,通过硫酸或盐酸催化得到糠醛。最近的木糖降解动力学研究主要用非均相催化剂[8]、高温液态水[9]、有机酸[10]和矿物酸[11-12]等。
工业上糠醛生产主要使用矿物酸作催化剂,然而,因使用矿物酸而带来的环境问题相当严重[2]。非均相催化剂和高温液态水催化可以避免污染问题,但是由于技术问题目前工业上并不可行。有机酸可以通过精馏等手段得到有效回收,但是其酸性较弱,催化效果不是很理想。金属氯化物尤其是氯化铁价格便宜,对半纤维素水解和戊糖脱水过程都有很好的催化效果,而且可以减轻设备腐蚀和污染问题[13-15]。然而,氯化铁催化木糖降解生产糠醛动力学尚未有报道。因此,本文使用氯化铁作催化剂,研究糠醛生成和降解过程的动力学过程。
1 实 验
1.1 原料
木糖,≥ 99%,济南圣泉唐和唐生物科技有限公司;氯化铁(CP,≥97.0%),糠醛(AR,≥ 99.0%),国药集团化学试剂有限公司。
1.2 实验装置与步骤
实验的主要装置为一个高温高压反应釜,釜体采用电加热。将一定体积的含有氯化铁(0.1mol/L)的木糖或糠醛溶液(初始浓度均为20g/L)加入反应釜中,在不同温度条件下(443.15~483.15K)进行反应,反应结束后冷却反应釜并测定釜内溶液中木糖和糠醛含量。
1.3 分析方法
糠醛和木糖含量的测定使用装有Aminex HPX-87H糖柱的安捷伦液相色谱仪,流动相为0.005mol/L稀硫酸,柱箱温度为60℃,示差检测器温度为40℃。定量方法为外标法。木糖转化率和糠醛收率的定义为式(1)、式(2)。


2 结果与讨论
2.1 氯化铁催化木糖降解过程
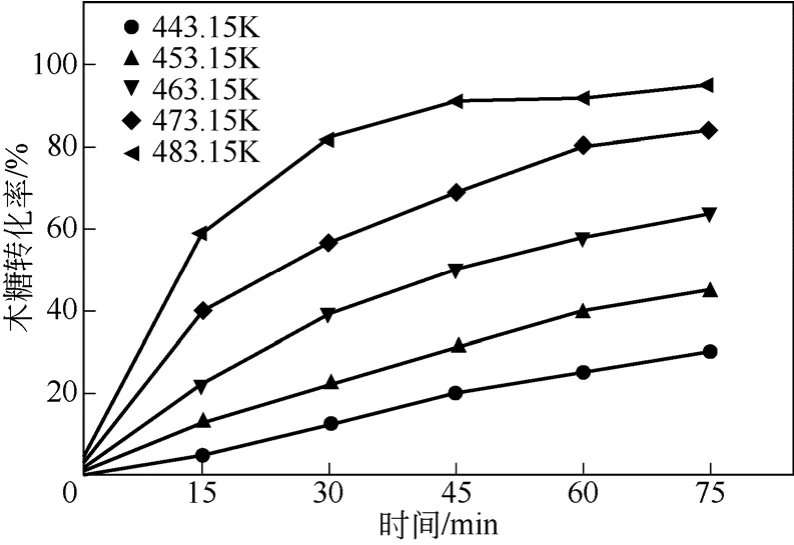
图1 不同反应温度下木糖转化率随反应时间的变化

图2 不同反应温度下糠醛收率随反应时间的变化
考察了443.15~483.15K下不同反应时间的木糖转化率和糠醛收率,结果如图1和图2。由图1可以看出,木糖转化率随温度的增加而迅速增加。443.15K条件下,75min时木糖转化率仅为30%, 而483.15K条件下,45min内木糖转化率就可达到91%。由图2可以看出,反应温度越高,产物糠醛的收率越高,在483.15K条件下反应60min内可达到糠醛最大收率的78%,进一步延长反应时间,由于副反应的发生导致糠醛收率下降。
2.2 氯化铁催化糠醛降解过程
考察了443.15~483.15K下不同反应时间的糠醛转化率,结果如图3。由图3可以看出,温度较低时,糠醛降解速率较慢,443.15K条件下300min内只有15%的糠醛发生降解。随着温度的升高,糠醛降解速率迅速增加,483.15K条件下60min内糠 醛转化率达到12%,时间延长到300min时,已经有一半左右的糠醛发生降解反应。

图3 不同反应温度下糠醛转化率随反应时间的变化
2.3 氯化铁催化木糖反应动力学
Dunlop[7]认为木糖在生成糠醛过程中先生成一中间产物,中间产物再反应生成糠醛。糠醛一方面可降解生成低聚物和甲酸,另一方面可以与中间产物缩合生成其他产物。对于中间产物的研究,一些学者认为是木糖在酸性条件下异构化形成的1,2-烯二醇结构,之后1,2-烯二醇脱去三分子水生成糠 醛[16]。另一些学者则认为反应源于稳定的吡喃型木糖,在酸性条件下首先转化为呋喃型木糖,再脱水生成糠醛[17-18]。尽管结果没有定论,但反应路线都可以假设如图4所示。

图4 木糖反应路线
图4的反应路线中X代表木糖,I代表中间产物,F代表糠醛,D代表降解产物,P代表缩合产物。由反应路线,可得如式(1)~式(3)的反应速率方程。



式中,CX表示反应过程中木糖的浓度,g/L;CI表示中间产物的浓度,g/L;CF表示反应过程中糠醛的浓度,g/L;k1表示木糖降解速率常数,min-1;k1′为中间产物生成糠醛的反应速率常数,min-1;k2表示糠醛降解速率常数 ,min-1;k3′表示中间产物和糠醛的缩合反应速率常数,L/(g·min);t为反应时间,min。
为了验证反应路线是否正确,进行了如下实验:在保持木糖初始浓度20g/L,反应温度463.15K恒定的条件下,考察了糠醛初始浓度(0、4g/L、8g/L)变化对木糖降解速率和糠醛收率的影响。不同条件下木糖降解速率常数拟合结果如表1所示,糠醛收率随时间变化结果如图5所示。
从表1中可以看出,反应过程中糠醛初始浓度的变化对木糖降解速率没有太大影响,因此可以认 为反应过程中木糖和糠醛之间没有直接的反应。通过2.1节和2.2节对木糖和糠醛降解动力学的研究可知,反应过程中糠醛降解速率远小于木糖降解速率,因此可认为反应过程中糠醛降解对糠醛收率影响不大。而从图5中可以看出,糠醛初始浓度变化对反应过程中糠醛收率影响比较明显,糠醛初始浓度越高,木糖反应生成糠醛的收率越低。因此Dunlop假设木糖反应生成糠醛过程中有中间体存在,且糠醛与中间体发生缩合反应是合理的。

表1 不同糠醛初始浓度时木糖降解速率常数k1拟合 结果

图5 不同糠醛初始浓度时糠醛收率随反应时间变化关系
尽管通过实验已经验证了中间产物的存在,但是到目前为止还无法用现有的检测方法检测出来,因此可认为中间产物是瞬间存在的,利用稳态近似原理即假设中间产物随时间变化率为零,对式(3)求解可以得到式(4)。

反应过程中生成大量糠醛,而中间体却检测不到,那么假设式(5)成立。

即式(4)可以化为式(6)。

将式(6)带入式(2)中可得式(7)。


式(1)和式(8)给出了应用Dunlop模型建立的糠醛生成动力学方程。以上微分方程组模型的求解和动力学数据的拟合由Matlab软件进行,得到的动力学参数如表2所示。表观活化能数据(表3)通过阿伦尼乌斯曲线(图6)求得。
以木糖为原料生产糠醛的过程是一个相当复杂的反应过程,从活化能角度来看,木糖降解活化能大于糠醛降解和糠醛缩合的活化能,这说明高温有利于木糖脱水生成糠醛的反应。而从表2中可以看出,随着温度的升高,k1/k2、k1/k3和k1/(k2+k3)都变大,这同样说明高温条件下更有利于糠醛的生成。然而,温度过高副反应速率也大大提高,且随着时间的进行副反应一直发生,因此总体来看较高的温度和较短的反应时间有利于糠醛收率的提高。由图2可知,在反应温度483.15K、60min条件下,最大糠醛收率可达78%。
3 结 论
(1)本文测定了温度在443.15~483.15K时0.1mol/L氯化铁催化木糖脱水过程的反应动力学数据,建立并验证了试验范围内木糖脱水过程的动力学模型。
(2)试验范围内木糖降解反应、糠醛降解反应和缩合反应的表观活化能分别为107.94kJ/mol、 65.86kJ/mol和26.36kJ/mol。

表2 不同反应温度下各速率常数拟合结果

表3 木糖降解过程活化能数据的拟合结果

图6 木糖降解过程活化能的拟合
(3)较高的温温度和较短的反应时间有利于糠醛收率的提高。在反应温度483.15K、60min条件下,最大糠醛收率可达78%。
[1] Cai C M,Zhang T,Kumar R,et al. Integrated furfural production as a renewable fuel and chemical platform from lignocellulosic biomass[J].Journal of Chemical Technology &Biotechnology,2014,89(1):2-10.
[2] Mamman A S,Lee J M,Kim Y C,et al.Furfural:Hemicellulose/xylosederived biochemical[J].Biofuels,Bioproducts and Biorefining,2008,2(5):438-454.
[3] 王瑞芳,石蔚云. 糠醛的生产及应用[J]. 河南化工,2008,25(5):14-15.
[4] 薄得臣,李凭力. 糠醛生产技术发展及展望[J]. 林产化学与工业,2013,33(6):128-134.
[5] Zeitsch K J. The Chemistry and Technology of Furfural and its Many Byproducts (Sugar Series 13)[M]. Amsterdam:Elsevier Science,2000.
[6] Garrett E R,Dvorchik B H. Kinetics and mechanisms of the acid degradation of the aldopentoses to furfural[J].Journal of Pharmaceutical Sciences,1969,58(7):813-820.
[7] Dunlop A P. Furfural formation and behavior[J].Industrial and Engineering Chemistry,1948,40(2):204-209.
[8] O’neill R,Ahmad M N,Vanoye L,et al.Kinetics of aqueous phase dehydration of xylose into furfural catalyzed by ZSM-5 zeolite[J].Industrial & Engineering Chemistry Research,2009,48(9):4300-4306.
[9] Jing Q,Lü. Kinetics of non-catalyzed decomposition ofd-xylose in high temperature liquid water[J].Chinese Journal of Chemical Engineering,2007,15(5):666-669.
[10] Lamminpää K,Ahola J,Tanskanen J. Kinetics of xylose dehydration into furfural in formic acid[J].Industrial & Engineering Chemistry Research,2012,51(18):6297-6303.
[11] Weingarten R,Cho J,Conner J W C,et al.Kinetics of furfural production by dehydration of xylose in a biphasic reactor with microwave heating[J].Green Chemistry,2010,12(8):1423-1429.
[12] 白从广,刘学军,王燕,等.微波辐照木糖降解制备糠醛反应动力学[J]. 化学反应工程与工艺,2010,26(3):275-278.
[13] Liu L,Sun J,Li M,et al.Enhanced enzymatic hydrolysis and structural features of corn stover by FeCl3pretreatment[J].Bioresource Technology,2009,100(23):5853-5858.
[14] Liu C,Wyman C E. The enhancement of xylose monomer and xylotriose degradation by inorganic salts in aqueous solutions at 180℃[J].Carbohydrate Research,2006,341(15):2550-2556.
[15] 胡青松,陈明强,王君,等.金属盐催化木糖脱水制备糠醛的研究进展[J]. 生物质化学工程,2013,47(6):33-40.
[16] Tania Ahmad L K,Kjell Olsson,Olof Theander. The formation of 2-furaldehyde and formic acid from pentoses in slightly acidic deuterium oxide studied by1H HMR spectroscopy[J].Carbohydrate Research,1995,276:309-320.
[17] Mark R Nimlos,Qian Xianghong,Mark Davis,et al. Energetics of xylose decomposition as determined using quantum mechanics modeling[J].The Journal of Chemical Physics,2006,110:11824-11838.
[18] Antal Jr M J,Leesomboon T,Mok W S,et al.Mechanism of formation of 2-furaldehyde fromd-xylose[J].Carbohydrate Research,1991,217:71-85.

