二维Ti2C与Ti3C2表面OH、O、F、Au的吸附活性
杨建辉 张绍政 计嘉琳 韦世豪(衢州学院教师教育学院,浙江衢州4000;衢州学院化学与材料工程学院,浙江衢州4000;宁波大学理学院微电子科学与工程系,浙江宁波5)
二维Ti2C与Ti3C2表面OH、O、F、Au的吸附活性
杨建辉1,*张绍政1计嘉琳2韦世豪3
(1衢州学院教师教育学院,浙江衢州324000;2衢州学院化学与材料工程学院,浙江衢州324000;3宁波大学理学院微电子科学与工程系,浙江宁波315211)
较高的比表面积与稳定性使得二维Ti2C与Ti3C2结构在贵金属催化剂载体、锂离子电池、储氢材料等领域具有重要的应用前景.研究Ti2C、Ti3C2的表面吸附活性有助于认识其表面特征.第一性原理计算研究显示:Ti2C与Ti3C2对O、OH、F具有较强的吸附活性.通过比较Ti2C、Ti3C2、Ti(001)、TiC(001)的表面电子结构,我们发现Ti2C与Ti3C2较强的表面吸附活性来自于表面Ti原子未极化的3d轨道.这使得Ti2C、Ti3C2表面通常覆盖有O、F、OH.吸附了O、OH基团的Ti2C与Ti3C2结构(Ti2CO2-2x(OH)2x、Ti3C2O2-2x(OH)2x)对Au原子的吸附能随OH比例的增大而增大.
二维结构;第一性原理;Ti2C;吸附
www.whxb.pku.edu.cn
Mxene的表面吸附活性也因此成为一个重要的研究课题.计算与实验研究表明Ti2C和Ti3C2具有较高的表面吸附活性.它们极易与空气中的O2反应形成Tin+1CnO2结构.5,12,18,19H2与O2可以在Ti2C表面直接离解.12,18Ti3C2可以在常温下与H2O发生反应.5然而,Ti2C、Ti3C2高表面吸附活性的内在原因以及其与电子结构之间的关系尚不明确.另外,Ti2C、Ti3C2有望和TiC、TiO2一样成为Au催化剂载体.因此,研究其表面Au原子的吸附活性有助于促进其在Au催化剂载体领域的应用.
在本文中,我们利用第一性原理方法研究了Ti2C 与Ti3C2表面O、OH、F的吸附能,并将它们与Ti(001)、TiC(001)表面对比.较强的吸附能说明Ti2C与Ti3C2表面通常吸附有O、F、OH基团.电子结构研究显示Ti2C与Ti3C2表面吸附活性主要来自于表面Ti原子未极化的3d轨道.接着,分析了Ti2CO2-2x(OH)2x、Ti2CO2-2xF2x、Ti3C2O2-2x(OH)2x、Ti3C2O2-2xF2x(0≤x≤1)表面OH、F、O的电子结构特征.最后,计算了Au原子在这些二维结构表面的吸附能,分析了O、OH、F电子结构特征与x值对Au吸附能的影响.
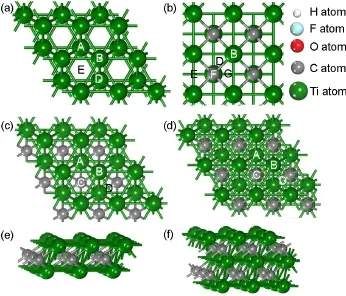
图1 Ti(001)(a)、TiC(001)(b)、Ti2C(c)和Ti3C2(d)的俯视图;Ti2C(e)和Ti3C2(f)的侧视图Fig.1 Top views of Ti(001)(a),TiC(001)(b),Ti2C(c),and Ti3C2(d);side views of Ti2C(e)and Ti3C2(f)
2 晶胞模型与计算方法
我们选择3×3的二维Ti2C、Ti3C2结构的超晶胞为模拟对象,结构如图1所示.晶格参数为3a0×3a0× 30,其中a0是通过能量优化得到的晶格长度.计算得到Ti2C、Ti3C2的a0分别是0.307、0.310 nm,与先前的研究结果3,12相吻合.对于Ti2C、Ti3C2结构表面的单原子吸附,其覆盖度为1/9 ML(monolayer),此时晶格参数固定不变.满吸附时,即吸附原子或基团数目等于表面Ti原子数目,晶格参数与原子位置都得到了优化.计算结果显示满吸附对晶格长度存在较小的影响.H、O、F、OH在Ti2C表面满吸附时的晶格长度分别是0.307、0.304、0.306、0.307 nm;在Ti3C2表面满吸附时的晶格长度分别是0.307、0.304、0.308、0.310 nm.我们选择5层2×2与3×3的超晶胞结构作为TiC(001)与Ti(001)的表面模型,其中真空层厚度大于1.5 nm.对于Ti2C与Ti3C2表面原子或基团的吸附位点,计算了第二层为Ti原子的空心位点(A)、Ti顶位(B)、第二层为C原子的空心位点(C)以及桥位(D).对于Ti(001)表面,计算了Ti顶位(B)、Ti桥位(D)、底部没有原子的空心位(C)以及第二层具有一个Ti原子的空心位(A).对于TiC(001)表面,计算了Ti顶位(B)、Ti-C桥位(D)、C顶位(F)、空心位(E).吸附能(Ead)的计算方法如下:

其中E1是基底的能量,E2是被吸附物气态时的能量.Et是吸附体系的总能量,m是吸附分子数或原子数.
计算采用自旋极化密度泛函理论,整个计算过程在VASP软件包20-22中完成.采用PAW赝势与PBE函数处理交换关联能.23平面波基函数的截断能为500 eV.24,25离子弛豫受力收敛标准为0.2 eV·nm-1.K空间网格采用M-P方法26设置.其中Ti2C、Ti3C2的K空间网格为3×3×1,TiC(001)与Ti(001)的K空间网格是5×5×1.研究过程采用Bader电荷分析方法27计算原子的电子数.
3 结果与讨论
3.1Ti2C、Ti3C2、Ti(001)以及TiC(001)的表面H、O、OH吸附活性
首先,通过比较H、O、F、OH分别在Ti2C、Ti3C2、Ti(001)以及TiC(001)表面的各种不同吸附位置的能量,我们寻找到了各吸附物在这四个表面的最稳定吸附位点,见表1.H、O、F以及OH在Ti2C、Ti3C2表面的最稳定吸附位点均为空心位点(A).它们在Ti2C表面的最稳定吸附构型见图2.此时,吸附物与周围3个Ti原子均成键.Ti顶位(B)与桥位(D)的吸附非常不稳定.在结构优化过程中,吸附原子直接迁移到空心位点(A).
众所周知,Ti(001)结构具有较强的还原性,这导致其对H、O、F、OH的吸附能较强.Ti2C、Ti3C2表面这些最稳定吸附位点的吸附能显示:它们对H、O、F、OH的吸附能也非常大,接近Ti(001)表面,远高于TiC(001)表面.以F原子的吸附为例,Ti2C、Ti3C2表面F原子的吸附能分别为6.61、6.53 eV,与Ti(001)表面的吸附能(6.59 eV)相近,而TiC(001)表面F原子的吸附能则只有3.87 eV.H、O、OH的吸附能也具有相类似的趋势.之后,将从电子结构角度分析这一现象的内在原因.
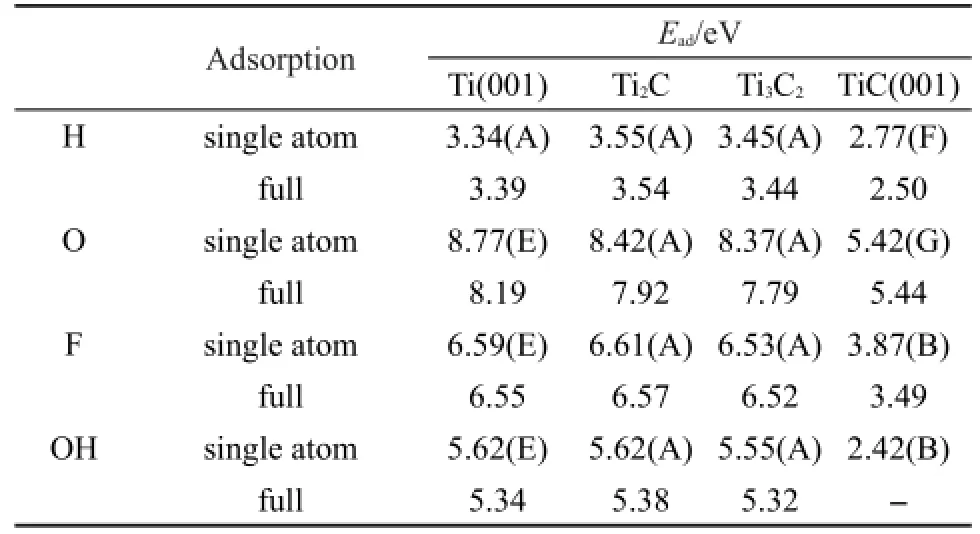
表1 H、O、F、OH在Ti2C、Ti3C2、Ti(001)以及TiC(001)表面的吸附能(Ead)Table 1 Adsorption energies(Ead)of H,O,F,and OH adsorption on Ti2C,Ti3C2,Ti(001),and TiC(001)surfaces
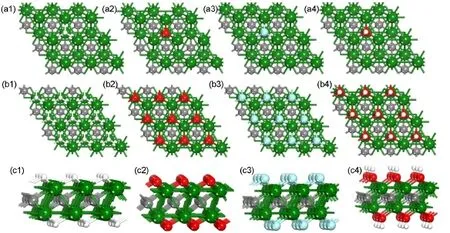
图2 H、O、F、OH在Ti2C表面吸附时,单原子吸附的俯视图(a1,a2,a3,a4)、满吸附的俯视图(b1,b2,b3,b4)和侧视图(c1,c2,c3,c4)Fig.2 Top views of single atom adsorption(a1,a2,a3,a4),top views of full adsorption(b1,b2,b3,b4),and side views of full adsorption(c1,c2,c3,c4)for H,O,F,and OH adsorption on Ti2C surfaces
其次,O、F、OH在Ti2C、Ti3C2表面的吸附能均高于5.50 eV.其中O在Ti2C、Ti3C2表面的吸附能分别高达8.42、8.37 eV.当H、F、O、OH在Ti2C、Ti3C2表面最稳定吸附位点(A)满吸附时,吸附构型见图2,它们的平均吸附能略小于单原子吸附能.但Ti2C与Ti3C2表面的吸附能仍接近Ti(001)表面,并且O、F、OH的吸附能均高于5.30 eV.如此高的表面吸附能使得Ti2C、Ti3C2极易与O2、H2O以及HF反应,最后导致其表面覆盖有O、F、OH原子或基团.同时,H原子在Ti2C、Ti3C2表面的吸附能小于O、OH、F.因此,在Ti2C、Ti3C2与氢氟酸溶液反应的过程中,H原子极易被后三者取代,最后形成H2分子脱离Ti2C、Ti3C2表面.17
3.2Ti2C、Ti3C2、Ti(001)以及TiC(001)的电子特征
Ti(001)、Ti2C、Ti3C2、TiC(001)的表面吸附活性与其表面电子结构密切相关.Bader电荷分析显示Ti(001)表面Ti原子的电子数是4.39,其3d轨道主要聚集在-3-1 eV之间,没有发生极化现象,如图3所示.这些费米能级附近未极化的Ti-3d电子具有较强的还原性,使得Ti(001)表面对O、OH、F具有较高的表面吸附活性.
与Ti(001)不同,TiC(001)表面Ti原子的电子数是1.81,并且3d轨道发生了明显极化现象.成键轨道、反键轨道分别聚集在-4.5--0.5 eV、0.5-3.5 eV之间,见图3.C-2p轨道具有与Ti-3d轨道相似的分布区域(-4.5--0.5 eV).这说明TiC结构中C-2p 与Ti-3d轨道之间存在较强的耦合作用.TiC(001)表面Ti原子的轨道和电子数都与内部Ti原子相似.这说明TiC表面Ti原子的悬挂键对其电子结构的影响较小.事实上,TiC表面与内部电子结构的差异主要表现在C原子上.表面C原子具有6.08个电子,而内部C原子则有6.25个电子.因此,随着Ti-3d电子被完全极化,TiC(001)表面Ti原子对O、OH、F的吸附活性较小.
Ti2C、Ti3C2表面Ti原子的电子投影态密度介于Ti(001)与TiC(001)表面Ti原子之间.Ti2C、Ti3C2表面Ti原子的电子轨道也都发生了极化,并在-5--2 eV区域与C-2p轨道发生了明显共振.同时,它们的部分电子轨道在-2-1 eV之间与Ti(001)表面比较相似.因此,Ti2C、Ti3C2与Ti(001)类似,其表面的Ti原子在费米能级附近具有部分未极化的3d轨道. TiC(001)表面Ti原子的3d轨道则都被极化.事实上,Ti(001)、Ti2C、Ti3C2、TiC(001)四种结构的表面Ti原子均具有悬挂键.而Ti2C、Ti3C2中的Ti含量过多,使得Ti原子与C原子成键过程中存在部分Ti-3d轨道未与C-2p轨道参与耦合作用.与Ti(001)表面类似,正是这些未被极化的Ti-3d轨道使得Ti2C、Ti3C2对O、F、OH具有较高的表面吸附活性.然而,TiC (001)表面的Ti-3d轨道均被极化,因此,其对O、F、OH的吸附活性较低.为了验证这些Ti2C、Ti3C2表面未被极化的Ti-3d电子轨道的影响,进一步比较了O、OH、F满吸附前后的Ti原子的电子结构变化.当Ti2C、Ti3C2表面满吸附O原子时,表面Ti原子费米能级附近的3d轨道被完全极化,成键与反键轨道密度增大,见图4.这使得Ti2CO2成为半导体结构.由于OH与F只有一个空轨道,因此,当Ti2C与Ti3C2表面满吸附OH、F时,表面Ti原子费米能级附近仍存在部分3d轨道.

图3 Ti(001)、Ti2C、Ti3C2、TiC(001)结构中Ti、C原子的投影态密度(PDOS)Fig.3 Projected density of states(PDOS)of Ti and C atoms in Ti(001),Ti2C,Ti3C2,and Ti(001)structures
总体而言,Ti2C、Ti3C2表面未被极化的Ti-3d电子轨道使得它们具有较强的还原性,进而对O、F、OH有较高的表面吸附活性,最后使得它们极易与O2、H2O发生反应.因此,水中或氢氟酸溶液中的Ti2C、Ti3C2表面通常覆盖有OH、O、F基团,1,5形成了Tin+1CnO2-2x(OH)2x与Tin+1CnO2-2xF2x结构,其中0<x<1.在高温作用下,这些表面基团可以被部分脱离.19
3.3Ti2CO2-2x(OH)2x与Ti2CO2-2xF2x表面O、F、OH的电子特征
Ti2C、Ti3C2的实验制备过程中,O、OH、F基团可能同时出现在Ti2C、Ti3C2表面.5,10为了研究Ti2C在Au催化剂载体领域的应用以及O、F、OH基团对表面Au原子吸附活性的影响,计算了Ti2CO2-2x(OH)2x、Ti2CO2-2xF2x(其中x=k/9,k为1-9的整数)的电子结构与Au原子的吸附能.选择O、OH或F高对称排列的结构作为研究对象,其相应结构如图5所示.
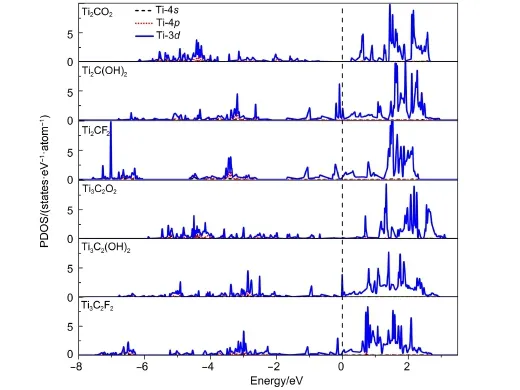
图4 Tin+1CnT2(n=1,2;T=O,OH,F)表面Ti原子的PDOSFig.4 PDOS of Ti atoms on Tin+1CnT2(n=1,2;T=O,OH,F)surfaces
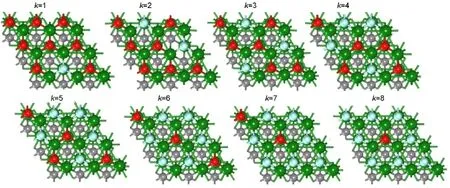
图5 Ti2CO2-2xF2x(x=k/9)结构俯视图Fig.5 Top views of Ti2CO2-2xF2x(x=k/9)structures
Ti2CO2中O原子与Ti2CF2中的F原子的电子数分别是7.32、7.83.当Ti、C、O或者F结合形成Ti2CT2(T=O,F)时,电子从Ti转移到O与F原子上,使得F、O的电子轨道填充度增加.Ti2CO2-2x(OH)2x、Ti2CO2-2xF2x结构中,表面O原子的平均电荷数随x的增大而单调上升,见图6.随着表面O原子比率的减少,更多的电子聚集到每个O原子的电子轨道上.例如,Ti2CO0.22(OH)1.78表面O原子的电子填充度远高于Ti2CO2表面O原子的电子填充度,见图6(a,c). Ti3C2O2-2xT2x(T=OH,F)也具有类似的变化趋势.事实上,O原子的价电子数为6,低于OH与F的价电子数(7).因此,当Ti2CT2表面OH与F的含量增加时,O原子的电子轨道上的平均电子数也相应增加.F、O原子较高的电子填充度使得它们变得更为惰性.
3.4表面原子或基团O、F、OH对Au原子的吸附活性
我们考虑了Au在Ti2CO2-2x(OH)2x、Ti2CO2-2xF2x表面的各种高对称的吸附位点:O与F原子的顶位、桥位与空心位.计算结果显示Au趋向于吸附在Ti2CO2、Ti2CF2的O、F顶位,它们的吸附活性非常弱.如图7所示,Au在Ti2CO2表面O顶位的吸附能只有0.35 eV,远低于其在TiO2(001)表面的吸附能(1.67 eV).Ti2CF2表面F原子的活性则更弱,Au原子的吸附能只有0.1 eV.在Ti2CO2-2xF2x结构中,部分O被F原子取代,Au的吸附能仍非常小,介于Ti2CO2与Ti2CF2之间.
当x<0.3时,Au趋向于吸附在Ti2CO2-2x(OH)2x的OH顶位,吸附能大于Ti2CO2.随着x的增大,OH基团的吸附活性也相应增强.这时,Au趋向于吸附在Ti2CO2-2x(OH)2x表面的OH桥位与空心位.当x从0.11变化到1时,Au的吸附能从0.38 eV增大到3.07 eV.与此同时,更多的电子从Ti2CO2-2x(OH)2x转移到Au原子,使得Au原子的电子数从11.15增加到11.67.这表明Ti2CO2-2x(OH)2x的还原性随着x的增大而增强.因此,可以通过改变Mxene表面OH的比例调节其表面吸附活性与电子结构.在表面O原子上加H就可以将表面O原子改变成OH基团.先前的研究28也表明在Pt、Pd的催化作用下氢分子可以离解到氧化物表面.
与Ti2CO2-2x(OH)2x、Ti2CO2-2xF2x类似,Ti3C2O2-2xF2x表面F原子具有较高的电子填充度,其对Au原子的吸附活性也非常弱,Au原子仍趋向于吸附在O顶位;Ti3C2O2-2x(OH)2x表面OH对Au原子的吸附能随x的增大而增大.在Ti3C2O0.22(OH)1.78表面,Au趋向于吸附在OH顶位,吸附能为0.40 eV.随着x的增大,OH顶位、桥位、空心位对Au的吸附能单调上升,如图8所示.当x=1时(Ti3C2(OH)2),Au原子的吸附能达到3.22 eV.因此,Ti3C2O2-2x(OH)2x与Ti3C2O2-2x(OH)2x一样,具有一定的还原性,并且该还原性随x的增大而增强.
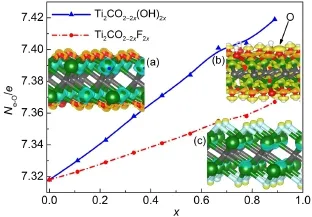
图6 Ti2CO2-2xT2x(T=OH,F)表面O原子的平均电子数(Ne-O)Fig.6 Average number of electrons of O atom(Ne-O)in Ti2CO2-2xT2x(T=OH,F)(a),(b),and(c)(insets)are the electron density differences of Ti2CO2,Ti2CF2,and Ti2CO0.22(OH)1.78,respectively.The isosurface levels are set to 5 e·nm-3for(a)and(c),28 e·nm-3for(b).Yellow and cyan represent electron depletion and accumulation,respectively.

图7 Au在Ti2CO2-2x(OH)2x、Ti2CO2-2xF2x表面的吸附能(a)以及吸附态下Au原子的电子数(Ne-Au)(b)Fig.7 Adsorption energies ofAu on Ti2CO2-2x(OH)2xand Ti2CO2-2xF2xsurfaces(a)and the number of electrons of Au atom(Ne-Au)for the adsorption state(b)Inset is the electron density difference ofAu adsorption on Ti2CO0.22(OH)1.78surface.Isosurface level of the inset panel is set to 5 e·nm-3.
与Ti2CO2-2x(OH)2x与Ti2CO2-2xF2x不同,当x较小时(x<0.22),Ti3C2O2-2x(OH)2x与Ti3C2O2-2xF2x表面O原子对Au原子的吸附活性较强.此时,被吸附的Au原子失去电子,Ti3C2O2-2x(OH)2x与Ti3C2O2-2xF2x具有一定的氧化性.例如,在Ti3C2O2表面,Au原子趋向于吸附在O顶位,吸附能为0.63 eV,大于Ti2CO2表面的吸附能(0.36 eV).结构上,Ti3C2O2-2x(OH)2x与Ti3C2O2-2xF2x比Ti2CO2-2x(OH)2x、Ti2CO2-2xF2x多一层TiC,而它们的表面特征一致.我们先前的研究29,30显示,TiC是缺电子体系,其具有一定的氧化性.因此,TiC层增强了Ti3C2O2-2x(OH)2x与Ti3C2O2-2xF2(x<0.22)的氧化性.进而导致其表面O原子对Au原子的吸附活性较强. Bader电荷分析也显示,在Ti2CO2表面,Au失去0.32个电子,而在Ti3C2O2表面则失去0.38个电子.
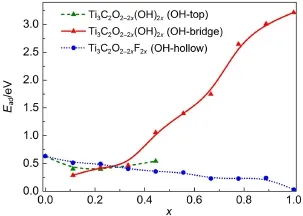
图8 Au在Ti3C2O2-2x(OH)2x与Ti3C2O2-2xF2x表面的吸附能Fig.8 Adsorption energies ofAu on Ti3C2O2-2x(OH)2xand Ti3C2O2-2xF2xsurfaces
4 结论
第一性原理计算研究显示Ti2C、Ti3C2对O、OH、F具有较高的表面吸附活性,接近Ti(001)表面,远高于TiC(001)表面.电子结构分析表明Ti2C、Ti3C2表面活性来自于未极化的Ti-3d轨道,而非悬挂键.O、OH、F在Ti2C、Ti3C2表面的吸附能高于5.5 eV.如此高的表面吸附能使得二维Ti2C、Ti3C2表面通常覆盖有O、OH、F.Ti2CO2-2xF2x表面F、O原子较高的电子填充度使得它们对Au原子的吸附能较小,低于0.4 eV.Ti2CO2-2x(OH)2x中OH对Au的吸附能随x的增大而增大.Ti2C(OH)2、Ti3C2(OH)2表面Au原子的吸附能高于3 eV.因此,通过改变Ti2CT2、Ti3C2T2表面的OH比例可以调节其电子结构与表面Au原子的活性.
致谢:该计算在宁波大学超算中心完成,在此表示非常感谢.
References
(1)Naguib,M.;Halim,J.;Lu,J.;Cook,K.M.;Hultman,L.;Gogotsi,Y.;Barsoum,M.W.J.Am.Chem.Soc.2013,135,15966.doi:10.1021/ja405735d
(2)Lukatskaya,M.R.;Mashtalir,O.;Ren,C.E.;Dall'Agnese,Y.;
Rozier,P.;Taberna,P.L.;Naguib,M.;Simon,P.;Barsoum,M. W.;Gogotsi,Y.Science 2013,341,1502.doi:10.1126/ science.1241488
(3)Shein,I.R.;Ivanovskii,A.L.Comput.Mater.Sci.2012,65,104.doi:10.1016/j.commatsci.2012.07.011
(4)Mashtalir,O.;Naguib,M.;Dyatkin,B.;Gogotsi,Y.;Barsoum,M.W.Mater.Chem.Phys.2013,139,147.doi:10.1016/j. matchemphys.2013.01.008
(5)Naguib,M.;Kurtoglu,M.;Presser,V.;Lu,J.;Niu,J.;Heon,M.;Hultman,L.;Gogotsi,Y.;Barsoum,M.W.Adv.Mater.2011,23,4248.doi:10.1002/adma.201102306
(6)Mashtalir,O.;Naguib,M.;Mochalin,V.;Dall'Agnese,Y.;Heon,M.;Barsoum,M.;Gogotsi,Y.Nature Commun.2013,4,1716. doi:10.1038/ncomms2664
(7)Naguib,M.;Mashtalir,O.;Carle,J.;Presser,V.;Lu,J.;Hultman,L.;Gogotsi,Y.;Barsoum,M.W.ACS Nano 2012,6,1322.doi:10.1021/nn204153h
(8)Tang,Q.;Zhou,Z.;Shen,P.W.J.Am.Chem.Soc.2012,134,16909.doi:10.1021/ja308463r
(9)Come,J.;Naguib,M.;Rozier,P.;Barsoum,M.W.;Gogotsi,Y.;Taberna,P.L.;Morcrette,M.;Simon,P.J.Electrochem.Soc. 2012,159,1368.doi:10.1149/2.003208jes
(10)Naguib,M.;Come,J.;Dyatkin,B.;Presser,V.;Taberna,P.L.;Simon,P.;Barsoum,M.W.;Gogotsi,Y.Electrochem.Commun. 2012,16,61.doi:10.1016/j.elecom.2012.01.002
(11)Peng,Q.M.;Guo,J.X.;Zhang,Q.R.;Xiang,J.Y.;Liu,B.Z.;Zhou,A.G.;Liu,R.P.;Tian,Y.J.J.Am.Chem.Soc.2014,136,4113.doi:10.1021/ja500506k
(12)Hu,Q.K.;Sun,D.D.;Wu,Q.H.;Wang,H.Y.;Wang,L.B.;Liu,B.Z.;Zhou,A.G.;He,J.L.J.Phys.Chem.A 2013,117,14253.doi:10.1021/jp409585v
(13)Hu,Q.K.;Wang,H.Y.;Wu,Q.H.;Ye,X.T.;Zhou,A.G.;Sun,D.D.;Wang,L.B.;Liu,B.Z.;He,J.L.Int.J.Hydrog.Energy 2014,39,10606.doi:10.1016/j.ijhydene.2014.05.037
(14)Khazaei,M.;Arai,M.;Sasaki,T.;Chung,C.Y.;Venkataramanan,N.S.;Estili,M.;Sakka,Y.;Kawazoe,Y.Adv. Funct.Mater.2013,23,2185.doi:10.1002/adfm.v23.17
(15)Moussa,S.;Abdelsayed,V.;El-Shall,M.S.Chem.Phys.Lett. 2011,510,179.
(16)Song,E.H.;Wen,Z.;Jiang,Q.J.Phys.Chem.C 2011,115,3678.doi:10.1021/jp108978c
(17)Zan,R.;Bangert,U.;Ramasse,Q.;Novoselov,K.S.Nano Lett. 2011,11,1087.doi:10.1021/nl103980h
(18)Gan,L.Y.;Huang,D.;Schwingenschlogl,U.J.Mater.Chem.A 2013,1,13672.doi:10.1039/c3ta12032e
(19)Xie,Y.;Naguib,M.;Mochalin,V.N.;Barsoum,M.W.;Gogotsi,Y.;Yu,X.;Nam,K.W.;Yang,X.Q.;Kolesnikov,A.I.;Kent,P. R.C.J.Am.Chem.Soc.2014,136,6385.doi:10.1021/ ja501520b
(20)Kresse,G.;Furthmuller,J.Comput.Mater.Sci.1996,6,15.doi:10.1016/0927-0256(96)00008-0
(21)Kresse,G.;Furthmuller,J.Phys.Rev.B 1996,54,11169.doi:10.1103/PhysRevB.54.11169
(22)Kresse,G.;Hafner,J.Phys.Rev.B 1994,49,14251.doi:10.1103/PhysRevB.49.14251
(23)Perdew,J.P.;Burke,K.;Ernzerhof,M.Phys.Rev.Lett.1997,78,1396.
(24)Kresse,G.;Joubert,D.Phys.l Rev.B 1999,59,1758.doi:10.1103/PhysRevB.59.1758
(26)Monkhorst,H.J.;Pack,J.D.Phys.Rev.B 1976,13,5188.doi:10.1103/PhysRevB.13.5188
(27)Tang,W.;Sanville,E.;Henkelman,G.J.Phys.-Condes.Matter 2009,21,084204.doi:10.1088/0953-8984/21/8/084204
(28)Li,B.;Yim,W.L.;Zhang,Q.;Chen,L.J.Phys.Chem.C 2010,114,3052.
(29)Yang,J.H.;Chen,Y.X.;Wu,L.H.;Wei,S.H.Acta Phys.Sin. 2014,63,237301.[杨建辉,陈言星,吴丽慧,韦世豪.物理学报,2014,63,237301.]
(30)Yang,J.H.;Ji,J.L.;Li,L.;Wei,S.H.Acta Phys.-Chim.Sin. 2014,30,1821.[杨建辉,计嘉琳,李林,韦世豪.物理化学学报,2014,30,1821.]doi:10.3866/PKU.WHXB201408192
Adsorption Activities of O,OH,F and Au on Two-Dimensional Ti2C and Ti3C2Surfaces
YANG Jian-Hui1,*ZHANG Shao-Zheng1JI Jia-Lin2WEI Shi-Hao3
(1College of Teacher Education,Quzhou University,Quzhou 324000,Zhejiang Province,P.R.China;2College of Chemical and Material Engineering,Quzhou University,Quzhou 324000,Zhejiang Province,P.R.China;3Department of Microelectronic Science and Engineering,Faculty of Science,Ningbo University,Ningbo 315211,Zhejiang Province,P.R.China)
Two-dimensional Ti2C and Ti3C2structures are highly stable and have high specific surface areas,and therefore represent promising materials with potential applications as carriers in transition metal catalysis,Li-ion batteries,and hydrogen storage devices.It was envisaged that investigating the surface adsorption activities of Ti2C and Ti3C2would provide useful information about their surface properties.The results of a firstprinciples study showed that the adsorption energies of OH,O,and F on Ti2C and Ti3C2surfaces were quite high. By comparing the electronic properties of Ti2C,Ti3C2,Ti(001),and TiC(001),we found that the un-polarized Ti-3d orbitals were responsible for the high surface adsorption activities of these materials.The high surface adsorption activities of the Ti2C and Ti3C2materials caused them to be terminated with O,F,and OH surface groups.The surface adsorption energies of theAu particles on the Ti2CO2-2x(OH)2xand Ti3C2O2-2x(OH)2x)surfaces increase as the ratio of OH increased.
Two-dimensional structure;First-principles;Ti2C;Adsorption
1 引言
实验研究发现前过渡金属碳氮化物(Ti2C、Ti2N、 Ti3C2、Ti4C3、V2C、Nb2C等)可以形成稳定的、只有3-7层原子厚的二维结构,称为Mxene.1-7目前的实验与计算研究进一步表明它们在电化学电容器、2锂电池、6,8-10Pb原子吸附、11储氢12,13和贵金属催化剂载体等领域具有重要的应用前景.Mxene的化学式为Mn+1Xn,其中n=1,2,3;X=C,N;M为前过渡金属.将三元层状结构Mn+1AXn(其中A为Al、Si等)浸泡在氢氟酸中可以得到Mxene结构.制备过程使得Mxene表面通常覆盖有O、F、OH基团.10Mxene具有多样性的元素组合.通过改变组成元素,Mxene的电子特征可以得到相应调节,从而使其在电子器件领域具有重要的应用前景.5,8例如,表面吸附有氧原子的Sc2C、Zr2C、Hf2C结构是超薄的半导体材料.14再者,Mxene超薄的特性使得其具有较高的比表面积.因此,它们与石墨烯类似,有望成为贵金属催化剂(Au、Pt等)的载体.15-17
October 17,2014;Revised:December 12,2014;Published on Web:December 12,2014.
O647
10.3866/PKU.WHXB201412121
The project was supported by the National Natural Science Foundation of China(11347138)and Talent Training Funds of Quzhou University,China (BSYJ201311).
国家自然科学基金(11347138)和衢州学院人才基金(BSYJ201311)资助项目
©Editorial office ofActa Physico-Chimica Sinica

