流动注射化学发光检测药物制剂中异丙肾上腺素及机理研究
王 辉,曹俊涛,李 森,刘彦明
(信阳师范学院 化学化工学院,河南 信阳 464000)
0 引言
异丙肾上腺素(IP)是一种拟交感β肾上腺素受体激动剂药物,常应用于治疗支气管炎、心肌梗死和心脏病[1].然而IP的过度使用,可能会引起心力衰竭和心律失常[2].因此,IP的检测在临床试验和药物制剂生产中都很重要.目前,用于检测IP的分析方法主要包括分光光度法(如紫外可见分析方法)[3]、荧光法[4]、电化学分析法[5]和化学发光法[6].近年来,化学发光法(CL)因其灵敏度高、线性范围宽、仪器简单等优点受到关注.目前,该技术已被用于毛细管电泳[7]、免疫测定[8]和流动注射(FI)[9]分析中.CL检测与FI技术相结合具有灵敏度高、通量高、重现性好、速度快等优点.FI-CL方法已被用于多种化合物的分析,包括氨基酸[10]、蛋白质[11]、核酸[12]和药物制剂[13]等.Sun等人[14]基于IP对luminol-KClO3化学发光体系的抑制作用,提出了一种检测IP的FI-CL方法.
基于IP对luminol-KIO4化学发光体系的显著增强作用,本文提出了一种灵敏检测IP的FI-CL方法,对影响CL和重现性的条件进行了系统优化.将该方法应用于药物制剂盐酸异丙肾上腺素注射液中异丙肾上腺素含量的检测,对IP-luminol-KIO4化学发光体系信号增强的机理也进行了讨论.
1 实验部分
1.1 试剂与溶液
异丙肾上腺素,Sigma公司(美国);luminol,苏州亚科化学试剂有限公司;KIO4,北京西辉化工厂;盐酸异丙肾上腺素注射液(H31021344),上海医药有限公司;所有氨基酸均购自中国药品生物制品鉴定所,其他化学试剂均为分析纯;所用溶液均用超纯水配制,18.2 MΩ·cm,台湾艾柯-成都康宁实验专用纯水设备厂.
1.2 仪器装置
FI-CL分析采用IFFM-E型FI-CL分析仪(西安瑞迈分析仪器有限公司,中国),示意图见文献[9].系统包括两个蠕动泵(P1, P2)、一个换向阀(S)、两个Y型混合阀(Y1, Y2)、流通池(F)和CL检测器(光电倍增管).蠕动泵用于所有溶液的传输.聚四氟乙烯管(直径0.8 mm)用于连接流通体系中各部分组件.螺旋形无色硅胶管作为流通池置于光电倍增管上方.CL信号由FI-CL系统软件记录.UVmini-1240型紫外可见分光光度计(岛津Shimadzu,京都,日本)用于测定紫外吸收光谱图.CL光谱图通过Cary Eclipse型荧光分光光度计(Varian,沃尔纳特克里克,美国)测定,测定时关闭激发光源.
1.3 实验方法
在该FI-CL分析体系中,一个分析过程包括两个步骤.在第一步的前2 s,当换向阀的方向位于负载位置时,水和空白溶液(或样品溶液)通过泵P1以恒速0.68 mL/min被引入流动体系.同时,luminol和KIO4溶液通过泵P2以1.4 mL/min引入体系.在第二步的前25 s,换向阀、泵P1和泵P2同时运行,换向阀的方向改为检测位置.水和空白溶液(或样品)通过泵P1以1.14 mL/min的速度被泵入.Luminol和KIO4通过泵P2以0.23 mL/min速度被泵入.在第二步的最后几秒钟,换向阀由检测位转向负载位,样品与luminol和KIO4的混合溶液在流通池中发生反应,产生CL信号.实验发现,IP对luminol-KIO4系统具有显著增强作用.因此,IP的浓度可以通过CL信号强度的变化(△ICL)进行定量,△ICL=IS-I0,其中IS和I0分别为IP和空白溶液的CL强度.
2 结果与讨论
2.1 反应条件优化
为实现灵敏检测,对NaOH、luminol和KIO4的浓度进行了优化.在0~0.24 mol/L范围内对NaOH浓度进行优化,如图1a所示,CL随NaOH浓度的增加而逐渐增加,当浓度增至0.12 mol/L时达最大值,进一步增加NaOH浓度,CL强度下降.因此,选择NaOH浓度为0.12 mol/L.Luminol作为该体系中的化学发光试剂,其浓度也有重要影响.由图1b可知,CL强度随着luminol浓度的增加而增强,当浓度为1.5×10-4mol/L时,CL强度最大,之后CL强度变化不明显,故选用的luminol浓度为1.5×10-4mol/L.考察了氧化剂KIO4在4.0×10-5~6.0×10-4mol/L浓度范围内对CL强度的影响(如图1c所示),可见,当KIO4浓度为2.5×10-4mol/L时CL强度最大,进一步增加浓度信号下降.所以,选取KIO4的浓度为2.5×10-4mol/L.
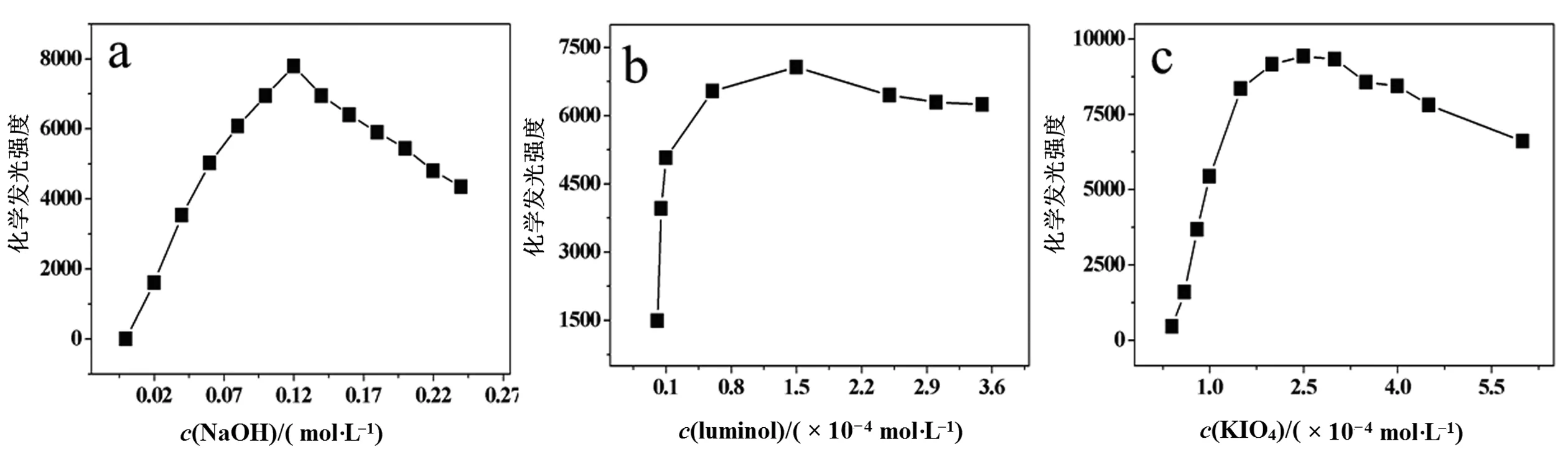
图1 NaOH(a),luminol(b)和KIO4(c)浓度对CL强度的影响Fig. 1 Effects of the concentrations of NaOH (a), luminol (b) and KIO4 (c) on CL intensity
2.2 FI-CL体系运行参数优化
为实现高的灵敏度和好的重现性,对FI-CL系统的运行参数进行了考察,结果见表1.
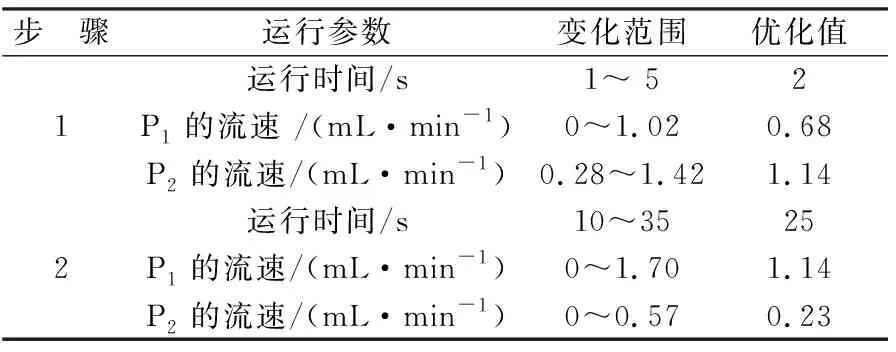
表1 系统运行参数优化及结果Tab.1 Effects of running parameters of FI-CL system and the optimum values
2.3 线性范围、检出限和重现性
在优化实验条件下,体系的CL强度与IP浓度有关.CL信号强度随IP浓度的增加而增强(图2),其中IP浓度在5.0×10-9~1.5×10-6mol/L内与△ICL呈线性关系,线性方程为△ICL= 2.4×1010C-836.2(C是IP的浓度),相关系数为0.998 8(见图2中插图).检出限为5.8×10-10mol/L.对5.0×10-7mol/L IP进行12次平行测定的相对标准偏差(RSD)为1.7%.
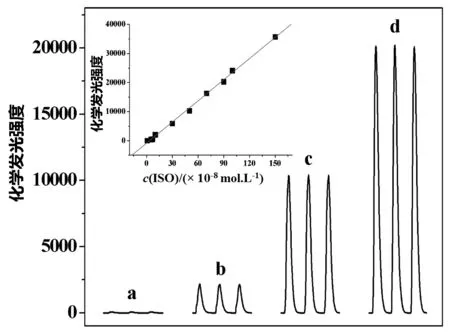
图2 IP对luminol-KIO4化学发光体系的增强作用 插图:IP的标准曲线 a.无IP; b.1.0×10-7mol/L IP; c.5.0×10-7mol/L IP; d.9.0×10-7 mol/L IP.Fig. 2 The enhancement of IP on luminol-KIO4 CL reaction
2.4 干扰试验
考察了一些常见的干扰物对IP测定的影响.选取IP的浓度为5.0×10-7mol/L,CL变化在±5%之内视为基本不干扰,结果见表2.由表2可知,所列的物质对IP的测定基本不干扰,表明该方法对IP的测定具有较好的选择性.
2.5 实际样品分析
将提出的FI-CL方法应用于药物制剂盐酸异丙肾上腺素注射剂中IP的检测,结果见表3.由表3可以看出,IP测定值与标定值相近.加标回收率为99.2%~103.2%.连续11次平行测定样品的相对标准偏差不高于1.2%.结果表明,该方法对药物制剂IP的检测具有高的灵敏度和好的精确度.
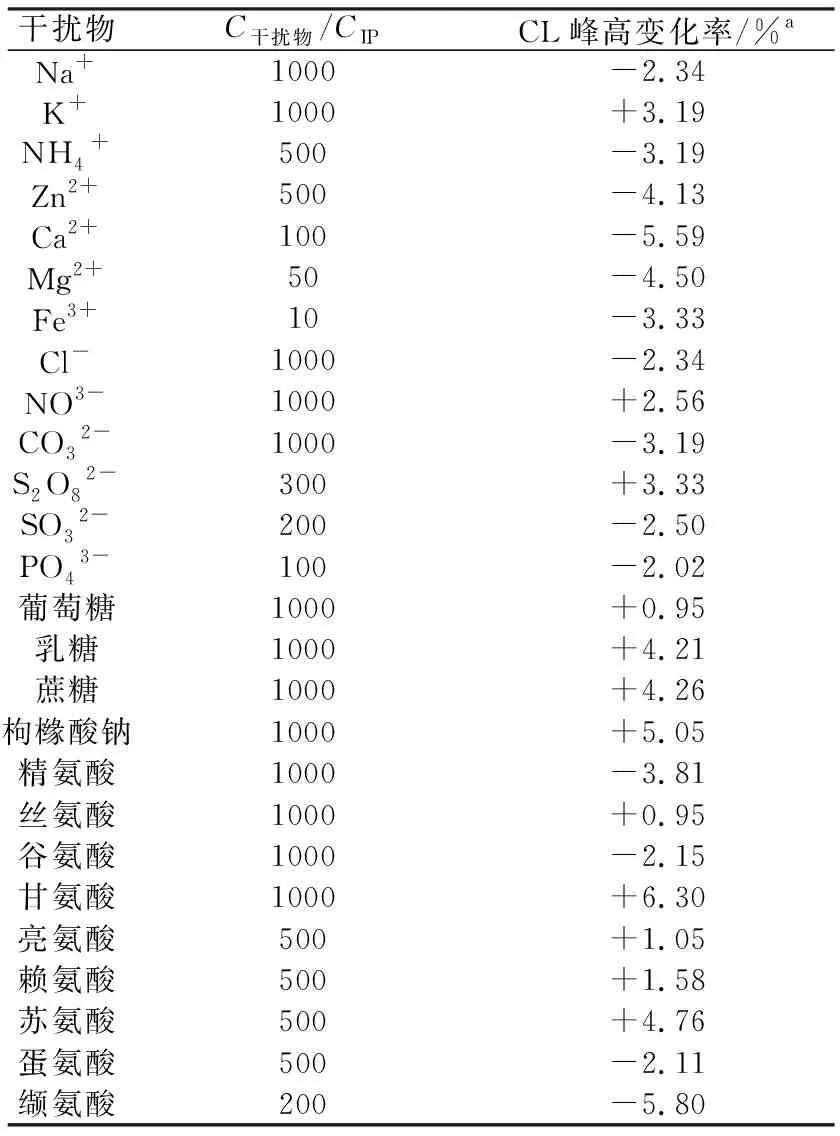
表2 不同干扰物对IP测定的影响Tab.2 Tolerable concentration ratios for interfering species in the analysis of 5.0×10-7 mol/L IP
注:a.CL峰高的变化(%):(I干扰物+IP-IIP)/IIP.
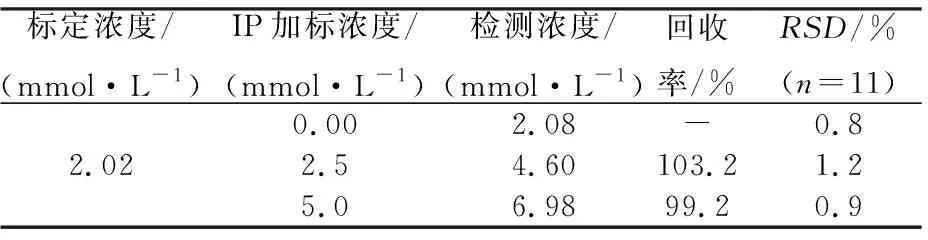
表3 盐酸异丙肾上腺素注射液中IP测定结果Tab. 3 Analytical results of IP in isoprenaline hydrochloride injection
2.6 机理研究
对luminol-KIO4化学发光反应体系的研究已有报道[15].研究表明,该化学发光体系的最大发光波长为425 nm,与3-aminophthalate(luminol的氧化产物)的发光光谱一致.为探索luminol-KIO4-IP体系的发光机理,分别测定了luminol-KIO4和luminol-KIO4-IP体系的化学发光光谱,如图3所示.由图3可知,luminol-KIO4和luminol-KIO4-IP体系的最大发光波长均为425 nm,表明两体系的发光物质相同,仍为3-aminophthalate.IP、KIO4、luminol、luminol-KIO4、luminol-KIO4-IP溶液的紫外可见光谱图见图4.由图4可见,IP与KIO4混合后出现两个新的吸收峰(315, 500 nm),表明IP和KIO4之间发生了反应.据报道,多酚可以被氧化为苯氧自由基,所产生的能量使苯氧自由基由基态跃迁至激发态[16].IP是一种儿茶酚胺化合物,有一个含有两个羟基的苯环和连接在苯环上的胺构成,在强氧化剂存在下极易被氧化为激发态.基于以上分析,IP对luminol-KIO4体系的CL增强机理如下:
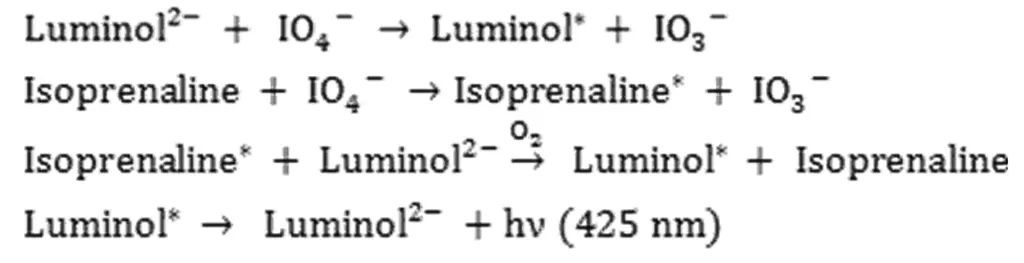
图3 CL光谱: a. luminol-KIO4; b. a + IP 实验条件: luminol,1.5×10-4 mol/L;NaOH,0.12 mol/L;KIO4, 2.5×10-4 mol/L;IP,1.0×10-7 mol/L.Fig. 3 CL emission spectra of luminol-KIO4 (a) and luminol-KIO4-IP(b)
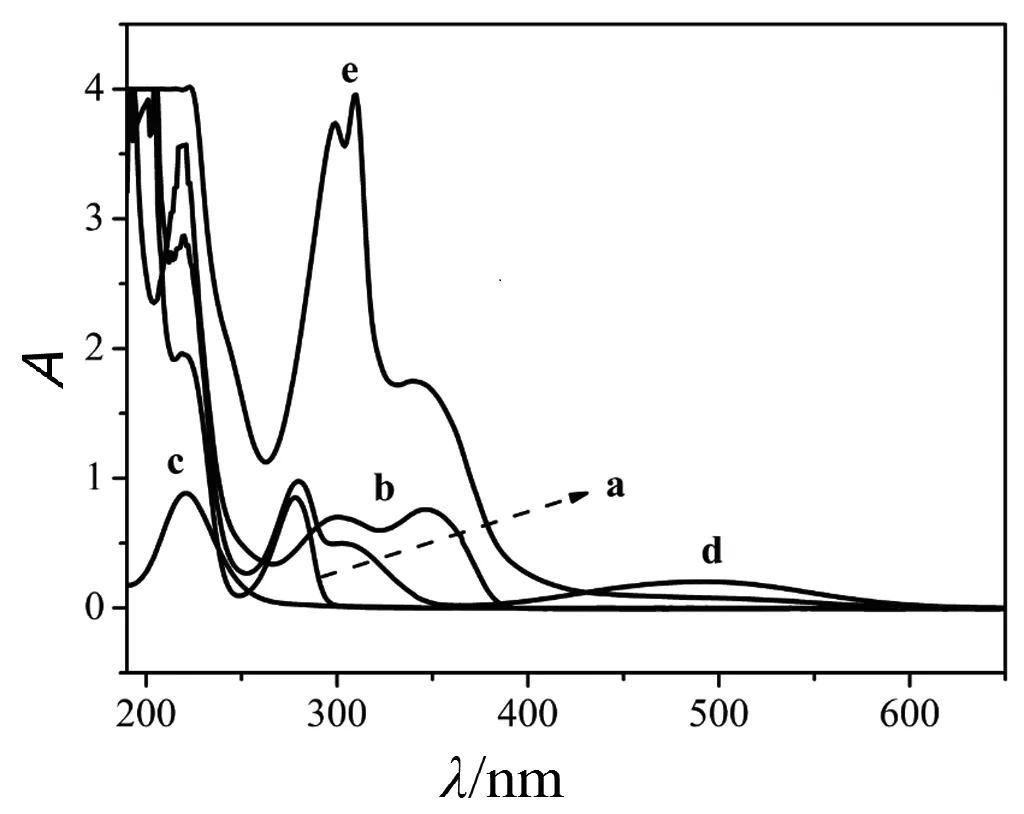
图4 紫外可见吸收光谱:a,IP;b,luminol;c,KIO4; d,luminol-KIO4;e,luminol-KIO4-IP.实验条件如图3.Fig. 4 UV-visible spectra. a. IP; b. luminol;c.KIO4; d.luminol-KIO4;e.luminol-KIO4-IP
3 结论
基于IP对luminol-KIO4CL体系的显著增强作用,提出了一种简单、灵敏检测IP的FI-CL新方法.该方法具有灵敏度高、精密度好和线性范围等优点.将该方法应用于药物制剂中IP的检测,为药物等生物样品中IP的分析提供了一种新技术.

