化学修饰的凋亡细胞诱导小鼠异体皮肤移植耐受的研究
丁健科, 苏映军, 张栋梁, 陈 晨, 陈建武, 余 州, 宋雅娟, 庄 然, 郭树忠
实验研究
化学修饰的凋亡细胞诱导小鼠异体皮肤移植耐受的研究
丁健科, 苏映军, 张栋梁, 陈 晨, 陈建武, 余 州, 宋雅娟, 庄 然, 郭树忠
资金项目:国家自然科学基金资助项目(30830102) 作者单位:710032 陕西 西安,第四军医大学西京医院 全军整形外科研究所(丁健科,苏映军, 张栋梁,陈 晨,陈建武,余 州, 宋雅娟,郭树忠);第四军医大学 基础部免疫教研室(庄 然) 第一作者:丁健科(1990-),男,四川人,硕士研究生. 通信作者:郭树忠,710032,第四军医大学西京医院 全军整形外科研究所,电子信箱:shuzhong@fmmu.edu.cn
目的 研究ECDI处理的脾细胞对同种异体皮片存活的影响,并初步探讨其机制。方法 建立小鼠尾部全厚皮片移植模型,随机法分5组。control组:免疫排斥组;rapa组:单独使用3 mg/kg雷帕霉素组;ECDI-SPs twice组:移植前7 d及移植后1 d输注108ECDI-SPs联合雷帕霉素组;SPs组:移植前7 d及移植后1 d输注未经处理脾细胞联合雷帕霉素组;ECDI-SPs x3组:移植前7 d、移植后1 d及7 d 3次输注ECDI-SPs联合雷帕霉素组。结果 ECDI处理的脾细胞迅速发生了凋亡,ECDI-SPs两次输注明显延长了同种异体小鼠皮片存活时间(P<0.05),ECDI-SPs 3次输注皮片存活同2次输注差异无统计学意义(P>0.05)。ECDI-SP输注后小鼠体内调节性T细胞比例增加(P<0.05)。结论 ECDI-SPs联合雷帕霉素能延长同种异体小鼠皮片存活时间,可能机制与调节性T细胞升高有关。
乙基碳二亚胺; 凋亡; 皮片移植; 复合组织移植; 免疫耐受; 雷帕霉素
异体复合组织移植在过去十年间已成功地在临床开展。截止目前,全球至少进行了28例脸移植,124例手移植[1],这一方法已经成为临床修复严重创伤的一种有效手段。然而,免疫抑制剂所带来的不良反应给患者带来了沉重的负担。因此,像实体器官移植一样,构建安全、有效的诱导供体特异耐受的方法是解决这一问题的有效手段[2-6]。 诱导细胞凋亡可通过物理和化学方法实现[7-11],这些实验证据显示,ECDI在建立抗原特异性免疫耐受方面具有潜在的临床应用价值。尽管目前异体复合组织移植与实体器官移植所使用的免疫抑制剂方案类似,复合组织移植后发生急性排斥的概率更高[12]。一些动物实验发现,异体复合组织移植物在肌肉血管等组织完好的情况下,皮肤组织仍然发生了排斥[13]。因此,寻找诱导皮肤移植耐受的方案,是诱导复合组织移植耐受的首要任务。自2014年10月至2015年7月,我们研究探讨了ECDI-SPs细胞疗法对于免疫原性较强皮片移植的作用。
1 材料与方法
1.1 实验动物及主要试剂
近交系雌性Balb/c小鼠,雌性C57bl/6小鼠,6~10周龄,均来自第四军医大学实验动物中心;小鼠饲养于SPF级环境。ECDI(美国SIGMA公司);红细胞裂解液、Annexin-V-PI凋亡检测试剂盒、流式细胞仪C6(美国BD公司);戊巴比妥(佛山市实验化工厂);小鼠Treg测定试剂盒、Foxp3抗体、CD25抗体、CD4抗体(美国EBIOSCIENCE公司)。
1.2 实验方法
1.2.1 小鼠全厚皮片移植模型及实验动物分组 供体皮肤来自Balb/c小鼠尾部全厚皮1 cm×1 cm,受区为C57小鼠左侧胸壁全层皮肤去除后创面。植皮后术区包扎固定,定期观察皮片排斥情况,部分小鼠植皮区定期取材,标本经固定、包埋、切片、染色后,行镜下组织病理学检查。实验动物分为5组(图2a):control组:受体小鼠仅接受皮片移植;rapa组:小鼠接受皮片移植后,于植皮术前1 d,开始每日给予3 mg/kg雷帕霉素至术后28 d,或至移植皮片完全排斥时;ECDI-SPs 2组:植皮术前7 d及植皮后1 d,分别给予受体小鼠输注ECDI-SPs,并于植皮术前1 d至术后28 d,给予小鼠3 mg/kg雷帕霉素;SPs组:植皮前7 d及植皮后1 d,分别输注未处理SPs并给予雷帕霉素,剂量及给药时间同上;ECDI-SPs x3组:于植皮前7 d、植皮后1 d及7 d,分别3次输注ECDI-SPs并给予雷帕霉素,剂量及给药时间同上。
1.2.2 ECDI处理SPs及输注方法 在无菌条件下,获取Balb/c小鼠脾脏并制备单个脾细胞(splenocyte, SPs)悬液,以红细胞裂解液(BD)去除红细胞后,以台酚蓝染色示细胞活性大于90%,再以PBS反复洗2次,重悬细胞至3.2×108/ml,加入0.171 ml新鲜配置的浓度为150 mg/ml的ECDI。冰上孵育1 h, PBS洗2次,重悬细胞至5×108/ml,经球后静脉丛给予小鼠200 μl细胞悬液,对照组小鼠输注未经ECDI处理的相同体积与细胞数量的SPs悬液。
1.2.3 流式细胞仪检测细胞凋亡及调节性T细胞 采用细胞凋亡试剂盒进行检测,将ECDI处理以及未经处理的小鼠SPs以PBS洗2次后,一部分细胞以Binding buffer重悬至2×106/ml,然后将这些细胞与FITC结合的Annexin-V(美国BD公司)以及PI常温下孵育15 min,经流式细胞仪C6(美国BD公司)检测细胞凋亡坏死情况;其余SPs用完全培养基重悬至2×106/ml,利用6孔板培养于37°、5% CO2孵箱,固定时间点再次染色上机。各组部分实验小鼠在移植后10 d,颈椎脱臼处死,取小鼠脾脏,制备小鼠单个SPs悬液;经红细胞裂解液处理后去除红细胞,获得SPs细胞悬液,利用FITC结合的CD4抗体、APC结合的CD25抗体进行细胞膜表面染色,破膜后,用PE结合的Foxp3抗体进行胞内染色,上机检测Treg占CD4+T细胞比例。
1.2.4 病理学观察 当移植皮肤出现肉眼可见的红斑时,即判断为排斥反应开始发生。当红斑区域较大,进而发展为皮片组织坏死、结痂、脱落、出现创面,至受累面积达到整个移植皮片80%时,设为排斥终点。
植皮术后10 d,分别取各组小鼠移植皮片标本,经4%多聚甲醛固定、脱水、石蜡包埋、切片后,进行苏木精-伊红(HE)染色,镜下观察皮肤组织中炎症细胞浸润情况,参考Banff 2007评价排斥反应程度[14]。
2 结果
2.1 ECDI处理对SPs的影响
通过FITC结合的Annexin-V染色和流式细胞仪检测,我们检测了小鼠SPs在经ECDI处理1 h后的细胞凋亡状态。如图1所示,正常SPs凋亡染色比例占18%(图1a),经ECDI处理1 h后凋亡比例占52%(图1b);将细胞转移至孵箱继续培养4 h后,细胞凋亡比例高达87%(图1c),与ECDI处理前相比(图1d),此时,大部分细胞已经进入凋亡晚期(图1e)。图1为5次独立实验中的代表图。
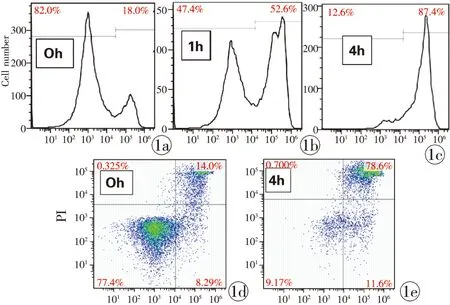
图1 ECDI处理诱导SPs凋亡 a~c. 经ECDI冰上处理1 h后,凋亡细胞比例逐渐增加,4 h后高达87% d,e. 处理4 h后细胞进入晚期凋亡阶段
Fig 1 Apoptosis of splenocyte exposured to ECDI. a~c. the proportion of SPs apoptosis increased after exposure to ECDI at 1 h and reached to 87% at 4 h. d,e. the advanced stage of SPs apoptosis at 4 h.
2.2 静脉输注ECDI-SPs明显延长了皮片存活时间
为了研究输注ECDI-SPs对MHC完全不匹配的小鼠皮肤移植存活的影响,我们在移植前7 d以及移植后1 d,静脉输注了1×108EDCI-SPs或SPs并联合应用了28 d的雷帕霉素。结果显示,两次输注ECDI-SPs使移植皮片中位生存时间(Median Survival Time, MST=28 d)显著长于仅使用雷帕霉素组(MST=14 d,P=0.0084)以及联合给予SPs和雷帕霉素组(MST=10,P=0.0019)。control组MST为11 d。静脉输注SPs联合雷帕霉素的D组小鼠皮片存活时间,短于单纯使用雷帕霉素的B组(MST=14,P=0.0039),二者差异有显著的统计学意义。腹腔注射3 mg/kg雷帕霉素,能在一定程度上延长皮片排斥时间(P=0.024),但是并不能长期有效地保护移植物。为了探讨ECDI-SPs对皮片的保护是否与细胞注射次数有关,我们还设计了ECDI-SPs3次输注组,但是单纯增加输注次数,并没有明显延长移植物的存活(P=0.508)。采用联合给予ECDI-SPs和雷帕霉素的方法,使小鼠皮片在移植后30 d,仍有部分存活,而其他组在移植早期均发生了免疫排斥。
2.3 病理组织学观察
经ECDI-SPs 2次及3次输入组移植皮片内可见血管周围及表皮有轻微炎症浸润而无表皮的角化不良,据Banff 2007标准为Grade Ⅱ度排斥;雷帕霉素组可见密集炎症细胞浸润伴有表皮轻微的坏死和角化不良,据Banff 2007标准为Grade Ⅲ度排斥;SPs组表皮严重角化不良,表皮真皮分离并伴有大量炎性细胞浸润,致坏死出现,据Banff 2007标准为Grade IVb度排斥。
2.4 静脉输注ECDI-SPs联合应用雷帕霉素增加了小鼠脾脏CD4+Foxp3+调节性T细胞比例
CD4+Foxp3+调节性T细胞在诱导和维持外周耐受中起重要作用,因此,我们在移植后10 d,获取各组小鼠脾脏细胞,检测Treg比例。ECDI-SPs 2次输入组以及3次输入组中Treg比例[(18±0.7)%,n=3;(21.6±2.8)%,n=3],均显著高于仅给予雷帕霉素组[(7.7±1)%,n=3,均P<0.05]和联合给予SPs和雷帕霉素组[(11.6±1.6)%,n=3,均P<0.05],后两组间无统计学意义(P=0.098),ECDI-SP 3次输入组与ECDI-SPs 2次输入组间,亦无统计学意义(P=0.14)。
3 讨论
美国西北大学Luo研究组采用输注ECDI-SPs的方法成功诱导了小鼠对异体胰岛细胞移植后的长期免疫耐受,这一诱导方案中无需免疫抑制剂、短暂淋巴细胞清除或共刺激分子阻断剂[6]。在高抗原性的皮肤组织移植研究中,Elliott等利用ECDI-SPs虽延长了MHC半相合小鼠移植皮片的存活时间[15],但该方法未能延长MHC完全不匹配的小鼠移植皮片存活时间。本研究利用多次输注ECDI-SPs联合雷帕霉素应用显著延长了MHC完全不匹配的小鼠移植皮片存活时间,经对比2次输注和3次输注ECDI-SPs细胞对移植物的影响,结果显示仅增加1次细胞输注并不能进一步延长皮片存活。
以往研究已证实,ECDI处理后的细胞在体外可迅速发生凋亡,此外, ECDI处理的细胞经尾静脉注射后3 h内,大部分细胞成为碎片[16]。ECDI-SPs在进入体内后迅速被脾边缘区巨噬细胞吞噬,并引发巨噬细胞产生抑制性细胞因子,如IL-10和TGF-β等。在富含抑制性细胞因子的微环境中抗原提呈细胞低表达共刺激分子CD80和CD86,导致异体抗原提呈给受体T细胞时引起供体特异性的T细胞无能[8]。另外一方面,共抑制分子PD-1也被证实在诱导耐受过程发挥重要作用,在利用抗体阻断PD-1或者PD-L1都将阻止耐受现象的产生[6]。
调节性T细胞被认为是诱导和维持外周耐受重要的细胞群,而其比例的增高与免疫耐受诱导成功率相关,并可以维持免疫耐受状态而使需免疫抑制剂的用量得以降低。近期的研究表明,移植物耐受取决于早期Tregs归巢至移植物引流淋巴结和移植物组织内,这样才能有效地抑制天然T细胞的激活和效应T细胞的功能[17]。本研究发现,在输注ECDI-SPs后,小鼠脾脏的Treg明显上升,ECDI-SPs 2次及3次组小鼠CD4+Foxp3+Treg明显高于雷帕组和SPs组。SPs组Treg相比对照也具有升高趋势,这可能是由于供体特异性输注能增高Treg的比例,但这并不能延长移植物的存活,这可能是因为提前大剂量的异体抗原输注引起了受体致敏,导致更为强烈的排斥反应。
目前,在临床上成功诱导移植物耐受的方案大多需要比较强的预处理,这很大程度上限制了耐受诱导方案的推广。而像复合组织移植作为一种整形手术,只有在安全的情况下才能推广,因此,寻找更加安全和低不良反应的耐受诱导方案十分重要。与心脏等实体器官不同,单纯ECDI-SPs联合免疫抑制剂并不能诱导皮肤移植耐受,可能与皮肤免疫原性最强有关,要诱导皮片移植长期存活还需要进一步实验探索。
[1] Khalifian S, Brazio PS, Mohan R, et al. Facial transplantation: the first 9 years[J]. Lancet, 2014,384(9960):2153-2163.
[2] Campisi L, Cummings RJ, Blander JM. Death-defining immune responses after apoptosis[J]. Am J Transplant, 2014,14(7):1488-1498.
[3] Voll RE, Herrmann M, Roth EA, et al. Immunosuppressive effects of apoptotic cells[J]. Nature, 1997,390(6658):350-351.
[4] Bittencourt MC, Perruche S, Contassot E, et al. Intravenous injection of apoptotic leukocytes enhances bone marrow engraftment across major histocompatibility barriers[J]. Blood, 2001,98(1):224-230.
[5] Chen G, Kheradmand T, Bryant J, et al. Intragraft CD11b(+) IDO(+) cells mediate cardiac allograft tolerance by ECDI-fixed donor splenocyte infusions[J]. Am J Transplant, 2012,12(11):2920-2929.
[6] Luo X, Pothoven K L, Mccarthy D, et al. ECDI-fixed allogeneic splenocytes induce donor-specific tolerance for long-term survival of islet transplants via two distinct mechanisms[J]. Proc Natl Acad Sci U S A, 2008,105(38):14527-14532.
[7] Ravishankar B, Shinde R, Liu H, et al. Marginal zone CD169+macrophages coordinate apoptotic cell-driven cellular recruitment and tolerance[J]. Proc Nati Acad Sci U S A, 2014,111(11):4215-4220.
[8] Mccarthy DP, Bryant J, Galvin JP, et al. Tempering allorecognition to induce transplant Tolerance with chemically modified apoptotic donor cells[J]. Am J Transplant, 2015,15(6):1475-1483.
[9] Wang S, Tasch J, Kheradmand T, et al. Transient B-cell depletion combined with apoptotic donor splenocytes induces xeno-specific T- and B-cell tolerance to islet xenografts[J]. Diabetes, 2013,62(9):3143.
[10] Starzl R, Brandacher G, Lee WP, et al. Review of the early diagnoses and assessment of rejection in vascularized composite allotransplantation[J]. Clin Dev Immunol, 2013,2013:402980.
[11] Hettiaratchy S, Melendy E, Randolph M A, et al. Tolerance to composite tissue allografts across a major histocompatibility barrier in miniature swine[J]. Transplantation, 2004,77(4):514-521.
[12] Cendales LC, Kanitakis J, Schneeberger S, et al. The Banff 2007 working classification of skin-containing composite tissue allograft pathology[J]. Am J Transplant, 2008,8(7):1396-1400.
[13] Elliott C, Wang K, Miller S, et al. Ethylcarbodiimide as an agent for induction of specific transplant tolerance[J]. Transplantation, 1994,58(8):966-968.
[14] Getts DR, Turley DM, Smith CE, et al. Tolerance induced by apoptotic antigen-coupled leukocytes is induced by PD-L1+and IL-10-Producing splenic macrophages and maintained by T regulatory cells[J]. J Immunol, 2011,187(5):2405-2417.
[15] Zhang N, Schroppel B, Lal G, et al. Regulatory T cells sequentially migrate from inflamed tissues to draining lymph nodes to suppress the alloimmune response[J]. Immunity, 2009,30(3):458-469.
[16] Eisenberger U, Seifried A, Patey N, et al. FoxP3 positive T cells in graft biopsies from living donor kidney transplants after donor-specific transfusions[J]. Transplantation, 2009,87(1):138-142.
[17] Kawai T, Cosimi AB, Spitzer TR, et al. HLA-mismatched renal transplantation without maintenance immunosuppression[J]. N Engl J Med, 2008,358(4):353-361.
读者·作者·编者
参考文献中英文作者名的著录方法
在医学期刊的论文中,引用英文文献的比例很高,但有不少作者将英、美人的姓名搞错,以至检索核对时出现错姓、错名或姓名全错。英、美人姓名的习惯写法是:名-名-姓,“名”可以有1个、2个或3个,但“姓”只有1个。因此,从书籍或期刊中的姓名转录到文献时,要将次序调整为姓-名-名。“姓”是不可以简写的;“名”可以缩写,用第一个字母大写,不用缩写点。数据库在著录作者姓名时,已经调整为“姓-名-名”,可照录。
Study on chemically modified apoptotic donor cells induced immune tolerance in skin allografts of mice
DINGJian-ke,SUYing-jun,ZHANGDong-liang,etal.
(DepartmentofPlasticSurgery,XijingHospital,FourthMilitaryMedicalUniversity,Xi′an710032,China)
Objective To investigate the effect of ECDI-SPs on the survival of a full-thickness skin allograft and its mechanism. Methods Full-thickness skin transplantation was established and mice were divided randomly into five groups; Control group: the skin allograft without treatment; Rapa group: skin allograft with 3 mg/kg rapamycin for 28 days; ECDI-SPs twice group: ECDI-treated splenocytes were injected i.v. on day 7 before(-7)and 1 day after (+1) skin transplantation with 3 mg/kg rapamycin for 28 days; SPs group: Untreated splenocytes were injected the same way and time as ECDI-SPs twice group with 3 mg/kg rapamycin for 28 days; ECDI-SPs x3 group: Another time of ECDI-treated splenocytes were injected 7 day after skin transplantation on the basis of ECDI-SPs twice group. Results Infusions of donor splenocytes treated with ECDI prolonged skin allograft survival significantly (P<0.05), and there were no significant difference between ECDI-SPs twice and x3 group (P>0.05), the proportion of regulatory T cells increased in ECDI-SPs twice and x3 group (P<0.05). Conclusion Pre-and post-transplant infusions of splenocytes treated with ECDI prolonged skin allograft survival probably by up-regulation of regulatory T cells in spleen.
Ethylene carbodiimide; Apoptosis; Skin transplantation; Composite tissue allotransplantation; Immune tolerance; Rapamycin
10.3969/j.issn.1673-7040.2015.12.021
R-322
A
1673-7040(2015)12-0761-04
2015-07-22)
——雷帕霉素

