高效液相色谱法测定菌群降解纤维素产物中的糖、有机酸和醇
姜 艳, 范桂芳, 杜 然, 李佩佩,姜 立, 赵 刚, 齐泮仑, 李十中*
(1.清华大学核能与新能源技术研究院,北京100084;2.北京市生物燃料工程技术研究中心,北京100084;3.中国石油天然气股份有限公司石油化工研究院,北京100000)
利用菌群降解木质纤维素一步法生产燃料乙醇,由于操作工艺简单且无酶水解需要的纤维素酶成本,是近年来第二代燃料乙醇生产发展的重要方向[1-4]。测定菌群降解纤维素发酵液中各种糖类、有机酸及乙醇代谢成分组成的变化,对揭示其代谢途径以及控制发酵过程,进而从代谢工程角度改良菌群和优化发酵工艺条件具有重要的意义。
传统的第二代燃料乙醇生产技术首先将木质纤维素预处理、酶解糖化成可发酵糖,然后经过发酵将糖转化为乙醇[4]。在纤维素降解产物分析中,Geng等[5]用毛细管电泳-电喷雾质谱法检测了木质纤维素酸预处理过程中产生的碳水化合物和木质素衍生物,Ibanez等[6]用液相色谱-串联质谱法测定了木质纤维素酸预处理过程中的微量有机酸抑制物。离子色谱[7-10]和液相色谱[11,12]方法已经成功应用于产物中糖和有机酸检测;气相色谱[13]已经成功应用于产物中醇和有机酸的检测。
然而,菌群降解纤维素发酵生产燃料乙醇的体系中含有糖、有机酸和醇3大类物质以及菌群的培养基,我们需要对这些物质进行具体分析来判断能否同时检测。培养基对检测的干扰来自两个方面,一是培养基中存在的钙离子会与色谱柱说明书里推荐的稀硫酸流动相产生沉淀,从而堵塞色谱柱;二是培养基中包含的有机物也会在色谱图里出峰。不同于化学降解法产物复杂[5,6],纤维素生物降解产生的有机酸和醇相对简单;杜然等[1]、Wang 等[14]和Guo等[15]用气相色谱-质谱联用法检测出菌群发酵液的主要挥发性产物包含乙醇、乙二醇、乙酸、丙酸、丁酸、异戊酸和甘油;本文的研究体系用气相色谱未检测到丙酸,所以后续分析不考虑检测丙酸。对于体系中可能存在的糖,由于本文采用的发酵底物滤纸是纯纤维素,也就是葡聚糖以β-1,4糖苷键连接,其降解产物是纤维二糖和葡萄糖。综合以上分析及色谱图结果,本文确定纤维二糖、葡萄糖、乙醇、丁醇、甘油、乙酸与丁酸7种组分为代谢产物,并采用加酸除钙和调节pH的样品预处理方法,在HPLC仪器上利用Bio-Rad Aminex HPX-87H糖分析柱分离,利用示差折光检测器(RID)检测,建立了同时测定这7种组分的分析方法。
1 实验部分
1.1 仪器、试剂与材料
岛津SHIMADZU液相色谱仪LC-20A(配岛津化学工作站);HERMLE Z216MK高速冷冻离心机(德国HERMLE公司);Cascada IX超纯水设备(美国 PALL公司)。乙醇(纯度为 99.5%,美国MREDA公司)、丁醇(纯度为99.5%,北京化工厂)、甘油(纯度为99.5%,美国Amresco公司)、葡萄糖(纯度为99.5%,美国Sigma公司)、纤维二糖(纯度为99.0%,美国 Sigma公司)、乙酸(纯度为99.5%,北京化工厂)、丁酸(纯度为99.0%,北京化工厂)。硫酸(纯度为99.5%,北京化工厂)、乙酸乙酯(纯度为 99.9% ,美国 Sigma)。
1.2 实验条件
1.2.1 色谱条件
色谱柱:Bio-Rad Aminex HPX-87H(300 mm ×7.8 mm);流动相:0.005 mol/L H2SO4;流速:0.5 mL/min;进样量:20 μL;柱温:60 ℃;检测器:RID。
1.2.2 样品预处理
取5 mL发酵液,稀释适当倍数,加入硫酸调节pH=3以防止有机酸离解并使钙离子沉淀,离心(10 000 r/min,3 min)。上清液用 0.22 μm 水系膜过滤后进样。
1.2.3 定性与定量
在相同的条件下,将样品色谱图与标准品色谱图对照,根据保留时间确定样品中各组分的色谱峰;在标准品与样品进样量相同的情况下,应用外标法定量,计算样品中各组分的含量。
2 结果与讨论
2.1 线性关系及检出限
精确称取纤维二糖、葡萄糖、甘油、乙酸、丁酸、乙醇、丁醇标准品,用超纯水溶解配制成标准溶液,各标准溶液的质量浓度分别为 0.020、0.040、0.080、0.100、0.200、0.400、0.800 和 1.000 g/L。以峰面积y对质量浓度x(g/L)进行线性回归,各标准品的线性回归方程、线性范围、线性相关系数见表1。对标准溶液进行稀释,取S/N=3时组分的浓度为检出限,结果见表1。

表1 化合物的保留时间、线性关系和检出限(S/N=3)Table 1 Retention times,linear relationships and limits of detection (LODs,S/N =3)of the compounds
2.2 组分的确定
在1.2.1节色谱条件下分别检测待测糖、醇和有机酸的单标准溶液,确定各组分的保留时间;相同条件下分别测定待测组分的混合标准溶液、实际样品和培养基溶液,结果见图1。从图1可以看出,各组分能有效分离,出峰顺序为纤维二糖、葡萄糖、丁醇、甘油、乙酸、丁酸和乙醇。
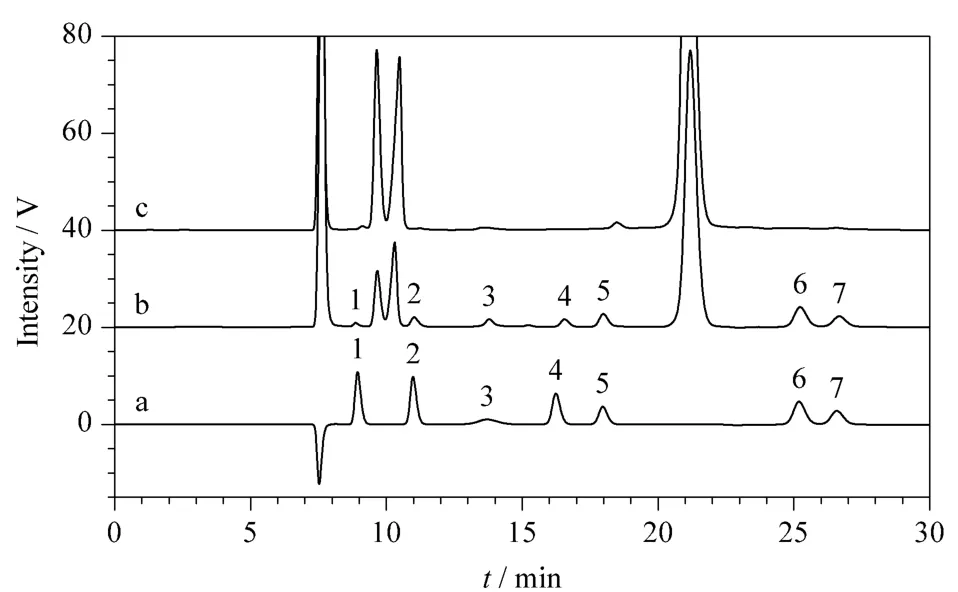
图1 (a)标准溶液、(b)样品和(c)培养基溶液的液相色谱图Fig.1 HPLC chromatograms of(a)standard solution,(b)sample and (c)cell culture solution
为了辅助定性几种有机酸和醇,样品经乙酸乙酯萃取,萃取液经气相色谱分析(Agilent 7890A气相色谱仪,火焰光度检测器(FID),CP-Wax-57CB色谱柱(50 m ×0.25 mm ×0.2 μm),载气为 N2)见图2,图2显示了乙酸乙酯溶剂、乙酸乙酯萃取的标准溶液和乙酸乙酯萃取的样品的气相色谱分离图。由图2可知,该菌群发酵液中的主要挥发性产物为乙醇、丁醇、乙酸、丁酸,未检出丙酸。本文采取的气相色谱汽化条件没能使甘油汽化,故气相色谱分析没有检测到甘油。
2.3 回收率与精密度
取菌群降解纤维素发酵初始液1份,添加不同水平的混合标准溶液,按1.2.2节方法处理并按1.2.1节条件测定,每一加标水平平行测定6次,计算平均回收率。由表2可见7种组分的平均加标回收率为85.41%~115.60%,RSD≤4.62%。结果表明,在不同的加标水平下,7种组分的回收率较为稳定,精密度良好,满足样品分析要求。
表3为一个发酵样品中目标组分的测定结果。由表3可见,6次测定样品中纤维二糖、葡萄糖、甘油、乙酸、丁酸、乙醇和丁醇质量浓度的RSD分别为3.94%、0.97%、4.54%、3.19%、3.86%、4.47% 和4.70%。

图2 (a)溶剂、(b)标准溶液和(c)样品的气相色谱图Fig.2 GC chromatograms of(a)a solvent,(b)a standard solution and (c)a sample

表2 样品中7种组分的加标回收率及相对标准偏差(n=6)Table 2 Recoveries and RSDs of the seven compounds spiked in the samples(n=6)
2.4 检测过程的干扰因素
如图1所示,由培养基带来的主要色谱峰对发酵产物色谱峰不形成干扰。但是保留时间在18.04 min处的小峰与产物乙酸的峰不能完全分离。当发酵液中乙酸的质量浓度为1.100 g/L时,两个峰的分离度为2.333,基本满足色谱分离的要求。

表3 菌群发酵液分析重复性试验结果Table 3 Repeated experiment results of microbial consortium fermentation broth g/L
3 结论
采用高效液相色谱法建立了菌群降解纤维素发酵液中多种醇、有机酸和糖类化合物的定量分析方法。该方法准确可靠,可实现对菌群降解纤维素发酵产物中纤维二糖、葡萄糖、甘油、丁醇、乙酸、丁酸和乙醇的同时快速、准确和高效分离检测,为研究纤维素菌群代谢途径,优化发酵过程提供了有效手段。
[1] Du R,Li S Z,Zhang X Q,et al.Chinese Journal of Biotechnology(杜然,李十中,章晓庆,等.生物工程学报),2010,26(7):960
[2] Du R,Yan J B,Li S Z,et al.Biotechnol Biofuels,2015,8:10
[3] Brethauer S,Studer M H.Energy Environ Sci,2014,7:1446
[4] Bhutto A W,Qureshi K,Harijan K,et al.RSC Adv,2014,4:3392
[5] Geng X M,Zhang S F,Wang Q,et al.J Chromatogr A,2008,1192:187
[6] Ibanez A B,Bauer S.Biotechnol Biofuels,2014,7:145
[7] Bogolitsyna A,Becker M,Dupont A L,et al.J Chromatogr A,2011,1218:8561
[8] Hu Q L,Tan L,Heng Z,et al.Energy Fuels,2012,26:2942
[9] Wang X,Xu Y,Lian Z N,et al.J Wood Chem Technol,2014,34(1):67
[10] Xiong Z Y,Dong Y,Zhou H B,et al.Chinese Journal of Chromatography(熊治渝,董英,周洪斌,等.色谱),2014,32(2):145
[11] Huang T Z,Wang S J,Liu X M,et al.Chinese Journal of Chromatography(黄天志,王世杰,刘秀明,等.色谱),2014,32(12):1356
[12] Lin X J,Wei W,He Z G,et al.Chinese Journal of Chromatography(林晓婕,魏巍,何志刚,等.色谱),2014,32(3):304
[13] Styarini D,Aristiawan Y,Aulia F,et al.Energy Procedia,2013,32:153
[14] Wang H,Li J J,Cui Z J,et al.Bioresource Technol,2013,136:481
[15] Guo P,Wang X F,Cui Z J,et al.J Environ Sci-China,2008,20:109

