赤霉素类植物激素分析方法研究进展
张晓娜, 卢明华*, 徐林芳, 校 瑞, 蔡宗苇
(1.河南大学化学化工学院,河南 开封475004;2.香港浸会大学化学系,香港999077)
植物激素作为植物体内广泛存在的一类痕量信号分子,对于调节植物的各种生长发育过程和环境应答具有非常重要的意义,根据其化合物结构和作用不同可以分为植物生长素、细胞分裂素(CK)、脱落酸(ABA)、乙烯、赤霉素(GAs)、聚胺类、茉莉酸、水杨酸和油菜素甾醇等[1]。GAs是植物体内一种四环双萜类化合物,1934年由日本植物病理学家Teijiro Yabuta等在恶苗病菌的发酵滤液中得到[2],随后人们便开始对其进行研究。GA3是第一个被鉴定的赤霉素,至今已鉴定出 136 种赤霉素[3,4]。这些化合物在化学结构上均含有赤霉素烷骨架(即4个环),仅环上双键、羟基数目和位置不同。目前发现仅GA1、GA3、GA4和 GA7等少数 GAs具有生物活性,其余均为活性GAs分子的代谢物或中间产物[5,6]。GAs亦可根据其分子内所含碳原子数的不同分为两类:分别是C20-赤霉素(C20-GAs)和C19-赤霉素(C19-GAs)。C19-GAs由 C20-GAs在代谢反应过程中丢失第20位碳,10位碳又与19位碳上的羧基形成一个内酯桥键(其结构如图1所示),C19-GAs所包含的种类较多,生理活性也比C20-GAs 要高[7,8]。
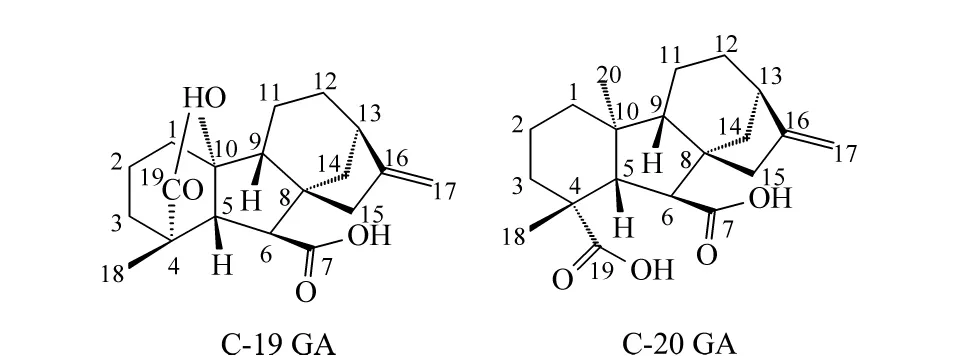
图1 C-19和C-20赤霉素的结构Fig.1 Structures of C-19 and C-20 gibberellins
作为内源性的植物激素,GAs在植物体内的含量通常很低(一般为ng/g,甚至为pg/g水平),且共存的基体成分繁杂,在植物体内各器官中其浓度表现出一定的波动。另一方面,由于GAs在促进植物种子萌发、表皮细胞分裂增长、茎叶扩大伸长以及花蕾发育等方面具有良好的生理作用,近年来在农业生产领域中得到广泛应用,但食品中GAs的残留也成为食品安全的隐患,其安全性也备受关注[9,10]。由于该类化合物没有特征生色基团,没有强的紫外、荧光和显著的化学反应[11]。因此,如何准确可靠的实现痕量GAs的定性和定量分析成为植物科学研究领域的发展瓶颈。
随着高效、快速的分离技术(如超高效液相色谱、毛细管电泳/电色谱)及高选择性和高灵敏检测技术(如软电离生物质谱)的出现,近年来痕量GAs的分析检测实现了重大突破。本文对近年来发表的基于色谱-质谱技术的GAs的分析检测方法(含样品前处理技术)进行综述,以期对GAs相关的研究提供帮助。
1 赤霉素样品前处理技术
样品前处理步骤作为色谱分析中最为重要的环节之一,其好坏不仅决定着整个分析过程的长短,同时也关系到分析结果的准确与否。由于GAs在植物体内不仅含量极低,而且所处的样品基质非常复杂,因此开发高效、快速的样品前处理技术对实际样品进行纯化或富集成为GAs分析的关键步骤。目前GAs分析过程中常用的样品前处理技术主要有固相萃取(SPE)、液相萃取(LPE)、液相微萃取(LPME)以及分子印迹萃取(MIE)等,中国科学院大连化物所关亚风研究员课题组[12]对植物激素样品的前处理方法进行了详细综述,下面仅针对GAs样品的前处理技术进行简单总结。
1.1 固相萃取
SPE具有操作简单、重现性好,易于实现自动化等优点,也是目前应用最为广泛的样品除杂纯化方法之一。目前,C18-SPE法是GAs样品前处理的常用方法,陈小鹏等[13]将成熟黄瓜样品经100%冷乙腈处理抽滤,去除色素和杂质后,用乙酸乙酯提取激素,以甲醇-水(含5%冰乙酸)作为流动相,在μ-Band pak C18柱上分离后,通过高效液相色谱实现了黄瓜样品中 GA3含量的测定,回收率达到80.12%。Bastiá等[14]用乙酸乙酯提取样品中游离的赤霉素(GA1和GA3),用10%甲醇进行稀释后注入反相C18色谱柱内萃取,并与HPLC联用对固氮醋酸菌和草螺菌中的GA1和GA3的含量进行了测定。Yu等[15]建立了在线固相萃取与 LC-MS/MS的联用技术,对葡萄中ABA、GA3、吲哚乙酸等5种酸性内源性植物激素进行检测,采用3 mm×4 mm的C18萃取柱,将样品富集在柱上以后,采用10%(v/v)的甲醇水溶液以0.6 mL/min流速清洗5 min,样品提纯后经HPLC-MS检测,GA3的 LOD和 LOQ分别为0.39 μg/kg 和1.32 μg/kg。黄红林等[16]以丙酮水溶液(丙酮和水的体积比为5∶1)作提取液,分别研究了C18萃取柱、硅胶、β-环糊精键合固定相、50目碳纳米管等4种固相萃取材料对番茄中GA3的富集行为,研究发现C18-SPE的净化效果最好,可以去除提取液中可溶性的酯、糖等杂质,该方法的LOD 为0.011 mg/L (S/N=3)。当植物体中含有大量的非极性基质时,会产生较强的基质干扰峰,因此C18柱常常用于基质不太复杂的样品。
1.2 液相萃取
传统的LPE是利用混合各组分对某一溶剂的不同溶解度而使各组分得到分离和提纯的操作过程,王丰莉等[17]建立了异丙醇/硫酸铵-水溶液组成的醇盐-水双液相萃取体系,对GA3进行了提取。研究表明:体系酸度pH=4.0,醇盐比(异丙醇/硫酸铵)为 1.5 mL/4.3 g,在 GA3质量浓度小于0.064 g/L时,提取率达到 93.47%,富集倍数11.36,提取液经由气相色谱检测,在最佳条件下,以0.06 g/L的GA3样品做回收试验,回收率可达到93.5%,RSD为4.0%。选择恰当溶剂对样品液中的GAs进行提取和纯化,进一步提高富集倍数的双液相萃取技术,有着广阔的发展空间。
1.3 液相微萃取
常规的LPE,不仅样品需求量大,而且需要消耗大量有机溶剂,容易造成环境污染,从“绿色”化学的角度出发,LPME越来越受到重视。Li等[18]通过分散液相微萃取(DLLME)对水果样品进行富集净化,实验装置简单,原料廉价,仅需少量有机溶剂便可达到良好的富集效果,实验以1.2 mL丙酮作为分散剂、100 μL的CHCl3作为萃取剂,混合后迅速注入样品溶液,以2-(5-苯并吖啶)对甲苯磺酸乙酯(BAETS)作为荧光标记试剂,通过HPLC-FLD进行检测,单次实验检测出了茉莉酸、吲哚-3-乙酸、吲哚丁酸、吲哚丙酸、GA3等8种植物激素。Wu等[19]采用中空纤维基质液-液-液微萃取(HF-LLLME)技术,选择环己醇和辛醇(1∶3,v/v)作为有机膜,在30℃的温度下萃取90 min,通过高效液相色谱-串联三重四极杆质谱技术对大米样品中的GA1、GA3、GA4等8种GAs进行了分析,获得了较好的检测结果。
LPME从萃取方法上可分为单滴微萃取、室温离子液体萃取、浊点萃取等。单滴微萃取是通过一滴萃取液滴实现,整个萃取过程仅需微升级甚至更少的有机溶剂,是目前有机溶剂使用量最少的一种液相微萃取方式。北京大学刘虎威教授课题组[20]开发了一种单滴液-液-液微萃取(SD-LLLME)与实时直接分析质谱(DART-MS)联用技术,对果汁样品中的吲哚乙酸、茉莉酸、GA3、脱落酸等6种植物激素实现了在线检测。
1.4 分子印迹萃取
MIE是通过制备一种具有分子特异识别功能的印迹聚合物,将其作为SPE填料或SPME涂层应用于食品、环境、生物样品中目标物的净化与富集的技术,具有选择性高等优点。中山大学李攻科教授课题组[21]通过微波辐射合成了一种新型磁性GA3分子印迹聚合物(GA3-Mag-MIP),研究发现GA3与丙烯酰胺(AM)的结合强度要比GA3与其他功能单体的结合强度高出许多,而且GA3-Mag-MIP对目标化合物有较高的选择性和萃取能力(~708.4 pmol GA3),作者将 GA3磁性丙烯酸分子印迹聚合物(GA3-Mag-AM-MIP)作为萃取填料,对大米和黄瓜样品中的 GA1、GA3、GA4、GA7提纯富集,通过 HPLCMS进行分析,结果显示4种目标化合物的LOD在1.9~4.4 μg/L(S/N=3)之间,RSD 为2.6% ~7.0%,大米和黄瓜样品的加标回收率分别为76.0%~109.1%和79.9%~93.6%,RSD为2.8%~8.8%和3.1%~7.7%,该方法在实际大米样品中检测出了GA4,其含量为(121.5 ±1.4)μg/kg。
2 赤霉素类植物激素的分析方法
传统的植物激素检测方法主要有生物鉴定法和理化测定法两种,生物鉴定法是最早采用的植物激素测定方法,通过植物的组织和器官对赤霉素产生的特异性反应进行测定,生物鉴定法虽然操作简单,但对样品的纯度要求很高,需要多重的样品前处理步骤来实现,而且它的重复性和专一性较差,因此该方法的应用逐渐减少。植物激素检测中运用较多的还有免疫测定法,它是基于抗原和抗体的特异性结合而建立起的一种检测方法,具有良好的专一性,但是易受到交叉反应的干扰,同时抗体制备时间较长,使得整个实验周期延长,因此用这种方法对赤霉素进行检测的报道较少。理化法中除了常见的色谱法以外,还有电化学法[22]和光谱法[23]等,如 Murillo Pulgarín 等[24]利用光化学诱导荧光法,通过化学衍生对西红柿中的GA3进行检测,在50~150 ng/mL范围内表现出良好的线性关系,GA3的LOD为1.7 ng/mL,但该方法需多步提取净化,操作繁琐且专一性较差,目前将其与色谱方法结合进行光谱测定成为GAs检测的主流方法之一。
色谱-质谱联用技术的出现,特别是随着软电离质谱的发展,使得多种结构类似的GAs同时分离分析成为可能,本文着重介绍了近年来色谱-质谱技术在赤霉素检测方面的应用。
2.1 GC-MS 联用技术
由于单次检测可以同时鉴定出400多种化合物,GC-MS联用技术用于GAs分析的研究工作开始于19 世纪 60 年代[25]。Yang 等[26]采用 GC-MS技术对苹果样品中的7种内源性GAs(GA12、GA15、GA53、GA44、GA19、GA20和 GA3)进行了检测,实验结果表明GA20含量最多,GA19和GA14次之,GA3含量为 GA20含量的 1/3。黄红林等[27]通过固相萃取-气相色谱-质谱(SPE-GC-MS)技术对果品中的赤霉酸(GA3)残留进行研究,实验通过选择离子监测(SIM)模式消除样品中基体的干扰,提高检测灵敏度,方法的线性范围为0.11~3300 mg/L,LOD为0.11 mg/kg,回收率在75.3% ~101.3%之间。Nakayama等[28]运用GC-MS技术在未成熟的碧桃种子中检测到11种已知的内源性赤霉素(GA3、GA9、GA17、GA19、GA30、GA44、GA61、GA63、GA87、GA95和GA97),同时还发现了未知的GAs,并通过已知的GAs证实了他们所预测的结构,其中GA118和GA119是在高等植物中首次检测到的含有 1α-羟基的GAs,从而丰富和完善了赤霉素类植物激素的种类。Taylor等[29]采用GC-MS分析了草莓叶片在短日照的条件下分泌物中GAs的含量:调节pH为8.0,实验样品用乙酸乙酯溶解后,经C18柱分离提纯,通过全扫描质谱图谱和Kovats保留指数与标准图谱比对,发现其中含有 GA1、3-epi GA1、GA3和 GA3-异内酯。
2.2 HPLC 技术
赤霉素类植物激素对温度十分敏感,温度超过40℃就会发生快速分解,避免了高温试验条件的HPLC技术近年来被广泛应用于GAs的分析研究[12]。但由于GAs没有特征生色基团,没有强的紫外吸收、荧光和显著的化学反应,常规的HPLC技术难以实现对该类化合物的灵敏分析,往往需要特定的检测器或对其进行衍生化处理。Li等[30]建立了 HPLC-FLD 测定方法,以 2-(11H-苯[a]咔唑)乙基氯甲酸酯(BCETS)为标记试剂进行柱前荧光标记,同时检测出7种植物激素,包括吲哚乙酸、茉莉酸、GA3等,该方法中7种植物激素的LOD均在0.34 ~0.73 ng/mL 之间。Li等[18]以 2-(5-苯并吖啶)对甲苯磺酸乙酯(BAETS)作为荧光标记试剂进行HPLC-FLD分析,在最佳实验条件下,茉莉酸、吲哚-3-醋酸、吲哚丁酸、吲哚丙酸、GA3等8种植物激素的 LOD 为 0.19 ~0.44 ng/mL (S/N=3),其中GA3在荔枝样品中的LOD为21.71 ng/g,在樱桃样品中的 LOD为1.34 ng/g。该方法的准确度在92.32%~103.10%之间,日内保留时间和峰面积的RSD分别小于0.04%和3.8%,日间保留时间和峰面积的RSD分别小于0.97%和5.4%,从实验结果可以看出,与FLD联用的HPLC检测技术适用于复杂基质中目标植物激素的痕量分析。
2.3 LC-MS 联用技术
由于克服了GC-MS需要衍生的缺点,LC-MS联用技术近年来在GAs的检测、发现及生物活性研究方面发挥了巨大作用[31]。Pan 等[32,33]采用高效液相色谱-电喷雾电离质谱(HPLC-ESI/MS)技术对新鲜拟南芥组织中的植物激素(生长素、GAs、分裂素等)进行了分析,经过一级提取后,样品回收率达到95%之上,在S/N>10的情况下,赤霉素的LOQ为0.1~1 pg/g(鲜重)。中国科学院大连化物所关亚风研究员课题组[34]将拟南芥样品与C18混合研磨制成基质固相分散(MSPD)萃取柱,开发了基质固相分散萃取-液相色谱-质谱联用(MSPD-HPLC-MS/MS)技术,在负离子电喷雾电离(ESI-)和多反应监测(MRM)模式下,同时测定了拟南芥组织中的3种赤霉素(GA1、GA3和 GA4);实验选用 Merck RPC18色谱柱,柱温25 ℃,单次进样5 μL,结果表明,3种GAs在10~300 ng/g的范围内均呈现出良好的线性关系(R2为0.984 2~0.996 2),LOD在1.1~4.1 ng/g之间(S/N=3),LOQ 在 3.7 ~10.3 ng/g之间(S/N=10),在 10 ~50 ng/g 的添加水平下回收率在54.7%~102.6%范围内,RSD为3.2%~12.8%;进一步分析检测数据得出,在3份不同的拟南芥样品中GA1的含量最高,GA4次之,GA3最少。该方法将MSPD样品前处理技术与色谱技术相结合,实现了拟南芥中3种GAs的痕量测定,同时也为植物样品中痕量生物激素的分析检测提供了参考。
张军等[35]在 ESI-和 MRM 模式下,建立起HPLC-ESI/MS检测葡萄中吡效隆和赤霉素的方法,采用Strata-X小柱萃取提纯样品,一次进样5 μL,选择 Agilent SB-C18色谱柱,调节流速为 0.3 mL/min,柱温40℃进行检测,结果表明两种化合物在2.0~100.0 μg/L范围内相关系数(r)>0.999,赤霉素的 LOD 为0.3 μg/L(S/N=3),LOQ 为1.0 μg/L (S/N=10),回收率为90.3% ~94.2%,RSD为3.2% ~6.9%,均达到了检测要求。Flores等[36]建立了一种基于快速、简单、便宜、有效、坚固、安全(quick,easy,cheap,effective,rugged and safe,QuEChERS)的萃取方法,结合超高效液相色谱-质谱(UPLC-MS)技术成功测定了西葫芦样品中的3种植物激素(生长素、CK、GA3),其中GA3的线性范围在10~250 μg/kg之间(R2=0.998 5),LOD(S/N=3)和 LOQ(S/N=10)分别为 5 μg/kg 和 10 μg/kg。黄何何等[37]采用同样方法将植物样品经QuEChERS法处理后,选取 Agilent XDB-C18色谱柱,采用基质匹配标准溶液外标法定量。在最优的色谱条件和检测环境下,成功检测了水果中矮壮素、助壮素、GA3、ABA等在内的21种植物生长调节剂的残留量,其中GA3在苹果、梨、草莓、葡萄和橘子5种水果样品中的 LOD均为6 μg/kg,LOQ为15 μg/kg,样品平均回收率在73.0% ~111.0%之间,RSD 为3.0% ~17.2%。在10.0~1 000 μg/L范围内,R2均大于0.99,表现出良好的线性关系。从数据来看,该方法能够实现多种水果样品中21种植物生长残留剂的检测,有效地提高了检测通量和检测速度。
Sun等[38]利用稳定同位素稀释法(SIDA)测定了番茄酱中赤霉素的残留,通过LC-MS技术同时检测出番茄酱样品中的3种GAs(GA3、GA4和GA7),结果显示,GA3和 GA4的 LOD 为2 ng/g,GA7的LOD为0.3 ng/g,GA3和 GA4的线性范围为5~500 ng/g,GA7的线性范围为 1 ~100 ng/g,日内和日间实验的RSD分别为4.8%~9.4%和3.5%~11.9%,3种GAs外标法(ESM)和内标法(ISM)的回收率分别为42.6%~75.0%和91.1%~103.8%。Xie等[39]建立了在多反应监测模式下的LC-MS检测水果(苹果、桃子、葡萄等)中GA3含量的分析方法,实验表明,该方法具有良好的线性和选择性,LOQ 为10 μg/kg,在 3 个不同水平(10、20 和 200 μg/kg)的加标样品中,平均回收率达到77.8% ~96.2%,RSD小于13.7%,该方法操作简单,可用作水果中GA3的常规分析,此方法已运用于百余种水果中GA3的检测。武汉大学冯钰锜教授课题组[40]制备了一种阴离子交换/疏水聚合物整体柱,开发了一种基于该整体柱的毛细管液相色谱-质谱联用(cLC-MS)方法,实现了对多种目标GAs的分离,LOD 在0.62 ~0.90 fmol之间(S/N=3)。
Zhao等[41]建立了一种快速、高效、灵敏地检测水果和蔬菜中GA3含量的方法,将样品溶液的pH调节到3~4,用乙酸乙酯提取后经SPE-PAK-C18分离提纯,提纯后的溶液经HPLC-MS/MS检测,采用外 标 法 定 量,LOD 为 0.01 μg/mL。Urbanová等[42]采用UPLC-MS技术实现了对20种GAs的分析,方法的LOD在0.08~10 fmol之间,线性范围超过 4个数量级。Chiwocha等[43]采用 LC-ESIMS/MS技术实现了对休眠状态下种子中 GA1、GA3、GA4和GA7含量的测定,发现在种子发芽之后GA1含量明显降低。中国科学院大连化物所关亚风研究员课题组[19]采用中空纤维液-液-液微萃取(HF-LLLME)技术对样品进行前处理,通过高效液相色谱-串联三重四极杆质谱检测出大米样品中的8 种 GAs (GA1、GA3、GA4、GA7、GA8、GA9、GA19和GA20),在最佳条件下,此方法表现出良好的线性关系,R2在0.995 52~0.999 91之间,LOD在0.001 6~0.061 ng/mL 的范围内。Liu 等[44]采用反相阳离子(Oasis MCX)和反相阴离子(Oasis MAX)交换混合机制柱对24种植物激素进行两级SPE,单次进样可以同时检测出植物组织中24种甚至更多的微量植物激素,包括生长素、11种分裂素以及10种GAs(GA1、GA3、GA4、GA9、GA12、GA19、GA20、GA34、GA44和GA53),由实验数据可得,GAs的 LOD在0.2 ng/g左右,分裂素的 LOD 为 0.01 ng/g,脱落酸的LOD为0.1 ng/g,且均表现出较好的线性关系(R2为0.990 3~0.999 7),该方法已成功运用于数百种植物中不同组织的植物激素测定,包括草本类、藤本类以及木本类植物。
Kojima等[45]开发了一种基于质谱探针(MS-probe)的高效和高通量的LC-MS/MS技术用于分析检测植物激素,通过被分析物(植物激素)与2-溴乙基-三甲基溴化铵(BETAB)反应,使得植物激素含有一个带正电荷的基团,在质谱正离子模式下对分裂素、生长素、脱落酸和GAs等43种植物激素进行了分离检测,相对于常规的负离子模式LOD提高了50倍。武汉大学冯钰锜教授课题组[46]采用SPE与液液萃取(LLE)串联方法提纯酸性植物激素(含10种 GAs),通过化学修饰 3-溴丙酮基溴化胺(BTA)来提高酸性植物激素在ESI-MS正离子模式下的离子化效率,从而提高方法的检测灵敏度,使得方法的 LOD 达到 1.05 ~122.4 pg/mL(S/N=3),RSD低于11.9%,大米加标样品中目标分析物的回收率达到88.3%~104.3%,该方法可从5 mg大米样中定量检测出11种内源酸性植物激素。
Izumi等[47]发展了一种纳升液相色谱-电喷雾-离子阱质谱联用(LC-ESI-IT-MS/MS)测定植物激素(CK、ABA以及 GAs)的方法,比毛细管流 LCESI-IT-MS/MS的灵敏度要高出5~10倍,部分GAs的 LOD 低至飞摩尔级别(≤10-15mol,S/N=3),结果显示所有目标化合物的线性相关系数(R2)在0.9937~1.0000之间,保留时间RSD小于1.1%,峰面积RSD低于10.7%,该分析方法为复杂痕量植物激素样品的深入研究提供了一种解决方案。
2.4 CE-MS 联用技术
CE-MS由于具有样品需求量小,溶剂消耗量少等优点,近年来也被应用到赤霉素类植物激素的分析检测中。Ge等[48]开发了一种基于C18固相萃取柱的CE-MS方法,在25 min内从椰汁样品中分离鉴定出 11 种 GAs(GA1、GA3、GA4、GA5、GA6、GA7、GA13、GA19、GA20、GA24和 GA53),方法的 LOD 在0.31 ~ 1.02 μmol/L 之间。随后该课题组[49]发展了胶束电动色谱-质谱(MEKC-MS)分析GAs的技术,在 25 min 内实现了对 GA1、GA3、GA5、GA6、GA7、GA9、GA12和 GA13等 8 种 GAs 的分离和检测,并将该方法结合SPE应用到椰汁样品的分析,成功检测并定量了椰汁样品中的GA1和GA3。
武汉大学冯钰锜教授课题组[50]合成了3-溴丙酮基溴化铵(BTA)作为一种新的质谱探针,开发了基于BTA化学修饰的毛细管电泳-电喷雾电离-飞行时间质谱(CE-ESI-TOF-MS)技术,实现了对15种酸性植物激素(含 10 种 GAs:GA1、GA3、GA4、GA20、GA7、GA9、GA12、GA19、GA24、GA53)的快速灵敏分析,方法的 LOD为0.34~4.59 ng/mL,LOQ为1.12~15.3 ng/mL,标准样品液中目标化合物的回收率为84.6%~112.2%,日内和日间精密度试验的RSD分别低于6.7%和9.9%,显示了较好的重现性。
3 总结和展望
目前,赤霉素类植物激素的分析检测仍是生物化学和农业化学研究的热点,以高效液相色谱法为代表的理化检测仍是GAs检测的主流方法。在色谱技术发展的同时,GAs残留的生物盒检测也是一个重要的发展方向,将化学技术和生物技术做到有效结合,降低检测成本,实现实时快速测定。
[1] Bari R,Jones J D G.Plant Mol Biol,2009,69(4):473
[2] Li B Z,Zhao X,An G Y.Chinese Agricultural Science Bulletin(李保珠,赵翔,安国勇.中国农学通报),2011,27(1):1
[3] Kawaide H.Biosic Biotechnol Biochem,2006,70(3):583
[4] Tan X,Ma X R.Chinese Journal of Applied and Environmental Biology(谈心,马欣荣.应用与环境生物学报),2008,14(4):571
[5] Wu F Q,Jin B H,Chen B,et al.Science and Technology of Industry(吴凤琪,靳保辉,陈波,等.食品工业科技),2011,32 (3):435
[6] Sun T P.Curr Biol,2011,21(9):338
[7] Li D L,Duan H X,Liu H C,et al.Chinese Journal of Pesticide Science(李冬玲,段红霞,刘鸿晨,等.农药学学报),2013,15(6):601
[8] Silverstone A L,Sun T P.Trends Plant Sci,2000,5(1):1
[9] Frigerio M,Alabadi D,Perez-Gomez J,et al.Plant Physiol,2006,142:553
[10] Wittwer S H,Bukovac M J.Econ Bot,1958,12(3):213
[11] Zhu G M,Long S H,Sun H,et al.J Chromatogr B,2013,941:62
[12] Wu Q,Wang L,Wu D P,et al.Chinese Journal of Chromatography(吴倩,王璐,吴大朋,等.色谱),2014,32(4):319
[13] Chen X P,Wang X F,Sun X L,et al.Shandong Agricultural Sciences(陈小鹏,王秀峰,孙小镭,等.山东农业科学),2005(1):65
[14] Bastián F,Cohen A,Piccoli P,et al.Plant Growth Regul,1998,24(1):7
[15] Yu J N,Meng Q Y,Liu W J,et al.J Chromatogr Sci,2014,52(9):1145
[16] Huang H L,Liu S,Zhang T Z.Journal of Analytical Science(黄红林,刘实,张桃芝.分析科学学报),2005,21(1):75
[17] Wang F L,Sun X M,Li B H.Chinese Journal of Analytical Chemistry(王丰莉,孙小梅,李步海.分析化学),2007,35(3):405
[18] Li G L,Lu S M,Wu H L,et al.J Sep Sci,2015,38(2):187
[19] Wu Q,Wu D P,Duan C F,et al.J Chromatogr A,2012,1265:17
[20] Bai Y,Zhang J L,Liu H W.Anal Bioanal Chem,2012,403(8):2307
[21] Zhang Z M,Tan W,Hu Y L,et al.Analyst,2012,137(4):968
[22] De Toledo R A,Vaz C M P.Microchem J,2007,86(2):161
[23] Xue Q H,Li D.Journal of Northwest Sci-Tech University of Agriculture and Forestry(薛泉宏,李东.西北农业大学学报),2000,28(4):34
[24] Murillo Pulgarín J A, García Bermejo L F, Becedas Rodríguez S.J Agric Food Chem,2013,61(41):9769
[25] Jonsson P,Johansson A I,Gullberg J,et al.Anal Chem,2005,77(17):5635
[26] Yang X H,Brown S K,Davies P J.J Am Soc Hortic Sci,2013,138(3):178
[27] Huang H L,Zhang T Z,Liu S,et al.Physical Testing and Chemical Analysis Part B:Chemical Analysis(黄红林,张桃芝,刘实,等.理化检验-化学分册),2006,42(3):194
[28] Nakayama M,Koshioka M,Matsui H,et al.Phytochemistry,2001,57(5):749
[29] Taylor D R,Blake P S,Crisp C M.Plant Growth Regul,2000,30(3):221
[30] Li G L,Liu S C,Sun Z W,et al.Food Chem,2015,170:123
[31] Müller M,Munné-Bosch S.Plant Methods,2011,7(1):37
[32] Pan X Q,Welti R,Wang X M.Phytochemistry,2008,69(8):1771
[33] Pan X Q,Welti R,Wang X M.Nat Protoc,2010,5(6):986
[34] Wang L,Wu Q,Duan C F,et al.Chinese Journal of Chromatography(王璐,吴倩,段春凤,等.色谱),2011,29(9):923
[35] Zhang J,Du P.Chinese Journal of Chromatography (张军,杜平.色谱),2011,29(11):1133
[36] Flores M I A,Romero González R,Frenich A G,et al.J Sep Sci,2011,34(13):1517
[37] Huang H H,Zhang J,Xu D M,et al.Chinese Journal of Chromatography(黄何何,张缙,徐敦明,等.色谱),2014,32(7):707
[38] Sun L,Zhao Y S,Nie X M,et al.Chem Res Chinese Universities,2012,28(5):797
[39] Xie W,Han C,Zheng Z Q,et al.Food Chem,2011,127(2):890
[40] Chen M L,Su X,Xiong W,et al.PLoS One,2013,8(7):69629
[41] Zhao Y B,Zhou Y M,Xin X,et al.Electronic and Mechanical Engineering and Information Technology (EMEIT),2011,8(10):3981
[42] Urbanová T,Tarkowská D,Novák O,et al.Talanta,2013,112:85
[43] Chiwocha S D S,Abrams S R,Ambrose S J,et al.Plant J,2003,35(3):405
[44] Liu S C,Chen W Q,Qu L,et al.Anal Bioanal Chem,2013,405(4):1257
[45] Kojima M,Nobusada T K,Komatsu H,et al.Plant Cell Physiol,2009,50(7):1201
[46] Chen M L,Fu X M,Liu J Q,et al.J Chromatogr B,2012,905:67
[47] Izumi Y,Okazawa A,Bamba T,et al.Anal Chim Acta,2009,648(2):215
[48] Ge L Y,Peh C Y C,Yong J W H,et al.J Chromatogr A,2007,1159(1):242
[49] Ge L Y,Yong J W H,Tan S N,et al.Electrophoresis,2008,29(10):2126
[50] Chen M L,Huang Y Q,Liu J Q,et al.J Chromatogr B,2011,879(13):938

