1,3,5-三羟基苯与BSA相互作用的荧光光谱研究
冯建华,吴 刚,汪 丽,徐婷婷
蛋白质就像由分子组成的机器,它是细胞的基本组成模块和生命控制中心,蛋白质所具有的功能是非常多样化的,如物质酶的活性和输送就是在相关蛋白质的控制作用下基于对目标分子的高度特定的一种识别。血清白蛋白是最丰富的载体蛋白质类之一,它在血液中内源性和外源性化合物的输送和处置过程中扮演着非常重要的角色。人血清白蛋白(HSA)的生理作用就是在血液中运送长链脂肪酸,同时它也结合大量的外源性化合物,如药物、氨基酸、类固醇及金属元素等[1,2]。体内大量生物活性物质如代谢物、药物和其它有机化合物的分布和代谢是与它们对血清白蛋白的亲和力密切相关的,而血流中药物白蛋白的结合性能对药物的自由浓度和代谢有非常显著的影响[2,3]。因此,对小分子物质如染剂、药物和有毒化学品等与蛋白质之间相互作用的研究已成为生命科学、化学及临床医学等领域中的焦点[4,5]。
牛血清蛋白(BSA)是由582种氨基酸残基构成的,是基于二硫键和氨基酸序列分布的一种蛋白质,可认为它是由三种同源域(I、II和III)的物质结合在一起组成的,每个域又可细分为A和B两个子域。BSA有Trp-134和Trp-212两种色氨酸,分别内嵌在IB和IIA两个子域中[3,6]。由于BSA具有价格低廉、使用方便、不同寻常的配体结合属性及其结构类似于人血清白蛋白(HSA)等的特点,而且最重要的是BSA和HSA是同源蛋白质。因此,BSA常作为蛋白质的典型代表而用于科学研究。
1,3,5-三羟基苯类化合物作为解痉药之一,主要用于治疗胃肠道绞痛。为缓解疼痛并增加社会劳动力,该药物在二十世纪七十年代及八十年代前期而被广泛使用[5]。目前,该类化合物已用作醛类化合物的检测剂,同时也应用于重氮型复印和纺织印染行业。此外,1,3,5-三羟基苯衍生物是广泛存在于桃金娘科药用植物中次生代谢物的一个主要种类,同时也存在于藤黄科、大戟科、叉蕨科、菊科、芸香料、蔷薇科、金丝桃科、樟科、景天科、大麻科及壳斗科等植物系列中。研究表明,在海洋和微生物资源中也发现了该类化合物的存在[6]。本文中,我们采用荧光光谱及同步荧光光谱法对1,3,5-三羟基苯与BSA之间的作用机理进行了研究,考察了二者之间相互作用的热力学参数、结合常数及1,3,5-三羟基苯对BSA构象的影响。
1 实验部分
1.1 试剂与仪器
牛血清蛋白(BSA,合肥博美生物科技有限公司,纯度99%);1,3,5-三羟基苯(上海化学试剂公司);其余试剂均为分析纯;实验用水为超纯水;经检测均无荧光杂质。VARIAN Cary 100荧光分光光度计(带恒温装置,美国VARIAN公司);智能型超级恒温水槽ZC-10(宁波天恒仪器厂);pB-10型精密pH计(塞多利斯科学仪器有限公司);AY-120M电子分析天平(日本岛津公司)。
1.2 实验方法
数据处理用Origin6.10.52进行。以pH=7.4的磷酸盐缓冲剂为试剂,配制浓度为1×10-5mol/L的牛血清蛋白(BSA)试样,过夜使其均衡。以具有内源荧光的蛋白质作为荧光探针,采用荧光猝灭法对1,3,5-三羟基苯与BSA相互作用的结果进行研究。以10mL BSA试样为固定体积,在1,3,5-三羟基苯与蛋白质比率为0-50系列范围内,分别向试样中加入份量逐渐增加的1,3,5-三羟基苯样品以获得不同的络合产物。在激发波长为286nm下得到稳态的荧光光谱;在Δλ(Δλ=λem-λex)分别为15nm(Tyr)和60nm(Trp)条件下,测定并得到同步荧光光谱。
2 结果与讨论
2.1 1,3,5-三羟基苯浓度的影响
对于生物大分子来说,荧光性质的测定能给出小分子物质与蛋白质相互结合作用的一些信息,如结合机理、结合模式、结合常数、结合位点及分子间距离等。一种化合物的荧光强度可以通过各种各样的分子间的相互作用得到减弱,如激发态反应、分子重组、能量转移、基态复合物的形成及碰撞猝灭等,这种强度上的减弱被称为猝灭[7,8]。BSA中含有三种固有的荧光素可以被猝灭,即色氨酸、酪氨酸及苯丙氨酸。BSA的荧光主要源于色氨酸(约340nm)和酪氨酸(约315nm)残基的辐射。在激发波长为286nm下,BSA具有较强的荧光发射峰,其峰值在346nm处。固有的蛋白质荧光性的猝灭可以用来检索许多配体与蛋白质的结合作用信息。当BSA与1,3,5-三羟基苯相互作用时,随着1,3,5-三羟基苯浓度的不断增加,BSA的荧光发射强度逐渐被猝灭(见图1)。

图1 1,3,5-三羟基苯浓度的增加对BSA荧光猝灭的影响(BSA浓度为1×10-5 mol/L;1,3,5-三羟基苯浓度1-5分别为0,5×10-5,1×10-4,2×10-4,5×10-4 mol/L)
由于1,3,5-三羟基苯对BSA的固有荧光性能具有猝灭作用,我们使用它作为猝灭剂并分析其猝灭机理。猝灭机理通常可分为动态和静态猝灭,由于温度的升高会导致扩散系数的增大,动态猝灭常数将随着温度的升高而增大;相反,升高温度可能会导致化合物的稳定性降低,因此静态猝灭常数随着温度的增加将会减少[9]。为了确认BSA与1,3,5-三羟基苯之间相互作用的猝灭机理,我们通过Stern-Volmer方程分析了不同温度下的荧光光谱。

方程式中F0和F分别为有猝灭剂与没有猝灭剂时的荧光强度,[Q]表示猝灭剂的浓度,τ0为猝灭剂不存在时的荧光寿命,kq代表生物大分子的猝灭速率常数,KSV表示Stern-Volmer猝灭常数。以F0/F为纵坐标,[Q]为横坐标,在284K和303K下分析得到的荧光强度数据见图2,通过F0/F对[Q]的线性回归,由方程式(1)可确定KSV的值。当1,3,5-三羟基苯与BSA的比例在2到50范围内变化时,很明显图中的曲线具有良好的线性关系,表明产生的荧光猝灭是动态猝灭或静态猝灭。一般来说,可根据它们所依赖的温度的不同来区分动态或静态猝灭[10]。根据方程式(1),回归曲线的斜率就是Stern-Volmer猝灭常数。图2表明了在284K和303K下1,3,5-三羟基苯对BSA荧光猝灭过程的Stern-Volmer曲线,可以看出在实验浓度范围内,所得结果与Stern-Volmer方程具有较好的吻合关系。Stern-Volmer猝灭常数KSV在284K下等于2380 M-1?傆hs(R=0.98425),而 在303K 时 为9022M-1?傆 hs(R=0.97055),说 明 Stern-Volmer猝灭常数是随着温度的升高而不断增大的,表明1,3,5-三羟基苯与BSA之间的相互作用导致的荧光猝灭可归属为动态猝灭机理。
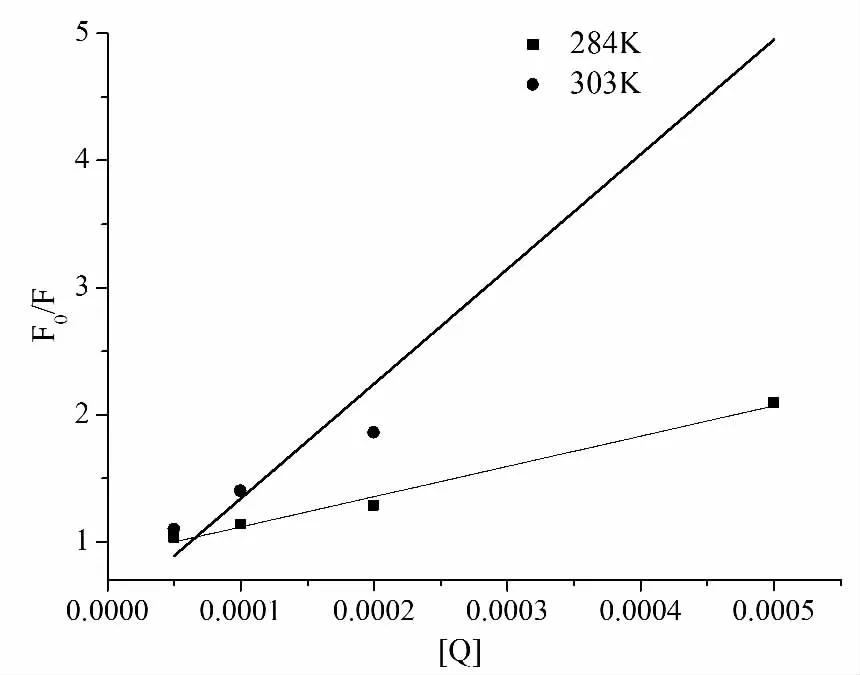
图2 284K和303K时BSA猝灭过程的Stern-Volmer曲线图
2.2 1,3,5-三羟基苯与BSA之间的相互作用力
小分子物质和蛋白质大分子之间主要存在四种相互作用力,即氢键、疏水作用力、静电作用力及范德华力。一种络合物的形成常常伴随有一定的热力学过程。蛋白质与小分子之间的作用力类型可由热力学参数ΔHΘ和ΔSΘ的值来确定。和温度有关的热力学参数如焓变化ΔHΘ、熵变化ΔSΘ及自由能变化ΔGΘ可用来描述1,3,5-三羟基苯与BSA之间的相互作用。实际上,ΔGΘ反映的是反应过程的自发性,而ΔHΘ和ΔSΘ则是用来确定作用力的主要证据。当ΔHΘ≈0,ΔSΘ>0时,疏水作用力占主要地位;当ΔHΘ<0,ΔSΘ>0时,主要作用力是静电效应;当ΔHΘ<0,ΔSΘ<0时,此时的作用力则主要是范德华力和氢键作用[11]。
结合参数的估算是基于经典的Scatchard方程,其可用一个分析函数的形式来表达平衡态时自由配体的浓度与配体总浓度的关系。式(2)中K是结合常 数,n表 示 结 合 位 点 数;而 [1,3,5-Trihydroxybenzene]和[BSA]分别代表配体总浓度与蛋白质总浓度。以Lg((F0-F)/F)和lg(1/([1,3,5-Trihydroxybenzene]-[BSA](F0-F)/F0))分别为纵、横坐标,根据方程式(2)得到的拟合曲线如图3;由拟合曲线的斜率和截距计算得到的相关结合参数列于表1。由结果可知,室温下n约为0.6,表明室温时1个BSA分子结合了0.6个1,3,5-三羟基苯分子;温度升高,n值则将减小。当温度在小范围内变化时,可以认为ΔHΘ是一常数,通过已得到的猝灭常数K,再由下列方程式可计算得到表1中的热力学参数。

图3 由方程式(2)得到用于确定结合参数的拟合曲线图([BSA]=1×10-5 mol/L,λex=286nm,λem=346nm)
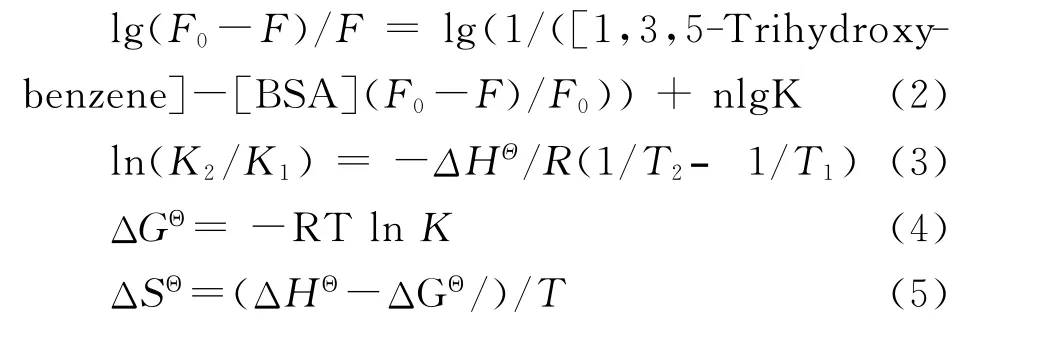

表1 修正的Stern-Volmer缔合常数(K)和1,3,5-三羟基苯-BSA体系的相关热力学参数
由表1可知,ΔGΘ均为负值,表明1,3,5-三羟基苯与BSA的结合是自发性的。室温下,热力学参数ΔHΘ=69.20kJ·mol-1,ΔGΘ= -35.35kJ·mol-1,ΔSΘ= 344.8J·mol-1·K-1。ΔGΘ为负值,说明二者之间的相互作用过程是自发的;而ΔHΘ和ΔSΘ均为正值,则表明BSA与1,3,5-三羟基苯相互作用过程中疏水作用力起了主要作用[12],而氢键是次要作用力。
2.3 同步荧光光谱
同步荧光光谱法是常见的用于评价蛋白质构象变化的一种方法,它能给出发色团如色氨酸和酪氨酸等附近有关分子环境的一些信息。最大发射峰的转移反映了发色团分子附近极性的变化[10]。当介于激发和发射波长之间的Δλ等于60 nm时,同步荧光光谱能测得色氨酸残基的特征信息;当Δλ设定为15nm时,能得到酪氨酸残基的光谱特征[11,12]。在两种不同波段下得到的同步荧光光谱分别见图4和图5。
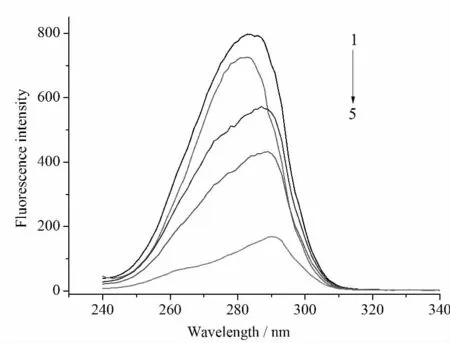
图4 1,3,5-三羟基苯对BSA同步荧光发射的影响(Δλ=60nm,303K)
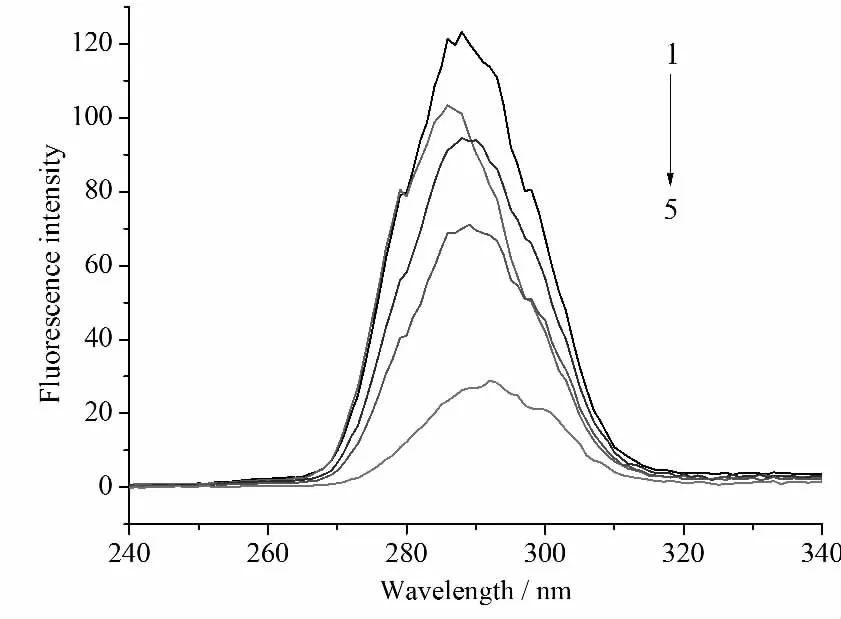
图5 1,3,5-三羟基苯对BSA同步荧光发射的影响(Δλ=15nm,303K)
由图4和图5可以看出,BSA中色氨酸和酪氨酸残基的最大发射波长发生了红移,表明在1,3,5-三羟基苯作用下,胰蛋白酶的构象发生了变化,色氨酸和酪氨酸残基附近的极性增大了,而疏水性则有所降低。
3 结 论
在模拟生理条件下,采用稳态荧光光谱、同步荧光光谱等对1,3,5-三羟基苯与BSA之间的结合作用进行了研究。结果表明,二者之间具有明显的结合作用,其相互作用导致的荧光猝灭为动态猝灭。从实验得到BSA中色氨酸和酪氨酸残基的荧光猝灭过程可知,1,3,5-三羟基苯和BSA之间的显著结合作用确实改变了这些残基上的微环境。此外,同步荧光光谱中发生的红移现象也表明了二者结合作用后氨基酸微环境极性的增加。
[1] Royer C A.Probing protein folding and conformational transitions with fluorescence[J].ChemicalReviews,2006,106:1769-1784.
[2] Wang Y Q,Zhang H M,Zhang G C,et al.Fluorescence spectroscopic investigation of the interaction between benzidine and bovine hemoglobin[J].J.Mol.Struct.,2008,886(1-3):77-84.
[3] Qin C,Xie M X,Liu Y.Characterization of the myricetinhuman serum albumin complex by spectroscopic and molecular modeling approaches[J].Biomacromolecules,2007,8(7):2182-2189.
[4] Sulkowska A.Interaction of drugs with bovine serum albumin[J].J.Mol.Struct.,2002,614(1-3):227-232.
[5] Shen X C,Liou X Y,Ye L P,et al.Spectroscopic studies on the interaction between human hemoglobin and US quantum dots[J].J.Colloid.Interf.Sci.,2007,311(2):400-406.
[6] Dockal M,Carter D C,Ruker F.Conformational transitions of the three recombinant domains of human serum albumin depending on pH [J].J.Biol.Chem.,2000,275:3042-3050.
[7] Sutkowska J A,Rownicka J,Bojko B,et al.Interaction of anticancer drugs with human and bovine serum albumin[J].J.Mol.Struct.,2003,651-653:133-140.
[8] 张霞,倪永年.光谱法研究吡嗪酰胺与牛血清白蛋白的相互作用[J].化学研究与应用,2007,19(11):1211-1214.
[9] Lu J Q,Jin F,Sun T Q,et al.Multi-spectroscopic study on interaction of bovine serum albumin with lomefloxacin-copper(II)complex[J].Int.J.Biol.Macromol.,2007,40(4):299–304.
[10] 李满秀,郭琴.速灭威与牛血清白蛋白作用的研究[J].化学研究与应用,2010,22(9):1112-1116.
[11] Zsila F,Bikadi Z,Simonyi M.Probing the binding of the flavonoid quercetin to human serum albumin by circular dichroism,electronic absorption spectroscopy and molecular modelling methods[J].Biochem.Pharmacol.,2003,65(3):447-456.
[12] Wang Y Q,Zhang H M,Zhang G C,et al.Studies of the interaction between paraquat and bovine hemoglobin[J].Int.J.Biol.Macromol.,2007,41(3):243-250.

