水系锂电池电极材料进展
王 淼,刁玉琦,张海昌
(中国电子科技集团公司第十八研究所,天津300384)
水系锂电池电极材料进展
王 淼,刁玉琦,张海昌
(中国电子科技集团公司第十八研究所,天津300384)
水系锂离子电池的优势在于:电解质的离子电导率比有机电解质高了2个数量级,电池的比功率可望得到较大提高;避免了苛刻的制造条件,价格低廉;安全性能高,环境友好。电极材料的选用则是决定水系锂离子电池性能的决定性因素,综述了水系锂电池的正负极材料,并对发展进行了展望。
水系锂离子电池;正极材料;负极材料
到目前为止,还没有任何一种体系的储能电池能达到人们使用的所有要求,例如,有机体系锂离子电池虽然比能量高,但是其制备过程要求苛刻,且存在严重的安全隐患;铅酸电池虽然便宜,但是其质量比能量没有优势,同时,对环境不友好;高压氢镍电池循环寿命长,但是其价格昂贵,体积比能量低,自放电大,对工作温度要求苛刻。因此,现实中需要开发不同体系的储能电源以满足不同的使用需求。
传统的锂离子电池能量密度较高[1-2],能达到120~200 Wh/kg,但采用的有机电解质导电性能差、成本高、生产条件苛刻,尤其是其安全性能得不到绝对保障,使用上受到了限制。1994年,W.Li[3]等在《Science》上首次报道了一种用微碱性的Li2SO4水溶液作为电解质的锂离子电池,这种电池与传统有机电解质锂离子电池相比具有以下优点:(1)电解质的离子电导率比有机电解质高了几个数量级,电池的比功率可望得到较大提高;(2)避免了采用有机电解质所必需的严格组装条件,成本大大降低;(3)安全性能高,生产环境良好,环境友好。水系锂离子电池的这些特性极其适合大规模能源贮存系统 (ESSs)的应用[4]。
有机电解质的稳定电化学窗口大于3 V,而水系电解质稳定电化学窗口一般在1.23 V左右,因此在充放电过程中易发生析氢或析氧反应,而且金属锂及一般的锂离子电池电极材料在水溶液中易溶解或发生化学负反应。W.Li等在理论上分析了嵌锂化合物在碱性水溶液中的稳定性,证明只要Li能紧紧地束缚在嵌锂基质中[约(3.3±0.2)V.Li],就不会与水反应生成LiOH和H2。因此水溶液锂离子电池的关键在于选用合适的电极材料。
本文针对水系锂电池体系,主要从正极材料、负极材料等方面总结了近些年的一些优秀的研究成果,加以整理和综述,并对其发展加以展望。
1 概述
水系锂离子电池与有机电解液锂离子电池的电化学反应一样,均是通过电解液传输锂离子,通过两极之间的外电路传输电子。
但是,水系锂离子电池电压窗口要比有机电解液电池电压窗口窄,稳定电压窗口约为1.23 V,超过这个值,水就会分解生成氢气和氧气,因此,水系锂离子电池的能量密度要低于有机电解液体系电池,因为,后者的操作电压要高于3 V。
适合水系锂离子电池材料的工作电压要介于氢气和氧气的分解电压之间,此外,材料的选择要考虑pH值的影响,因为,这与水体系中氢气和氧气的分解电压有很大关系[5]。
水系锂电池电极材料种类繁多,与用于有机电解液体系电极材料不同,水电解液中电极材料的氧化还原电压必须小于或接近水的电化学反应电位。图1中红色点线显示了在中性pH值下产生氢气和氧气的电化学电位值,超出此电位范围的材料会与水持续反应而不能用于电极材料,水系锂离子电池电极材料一般分为:氧化物、多阴离子化合物和其它化合物等。
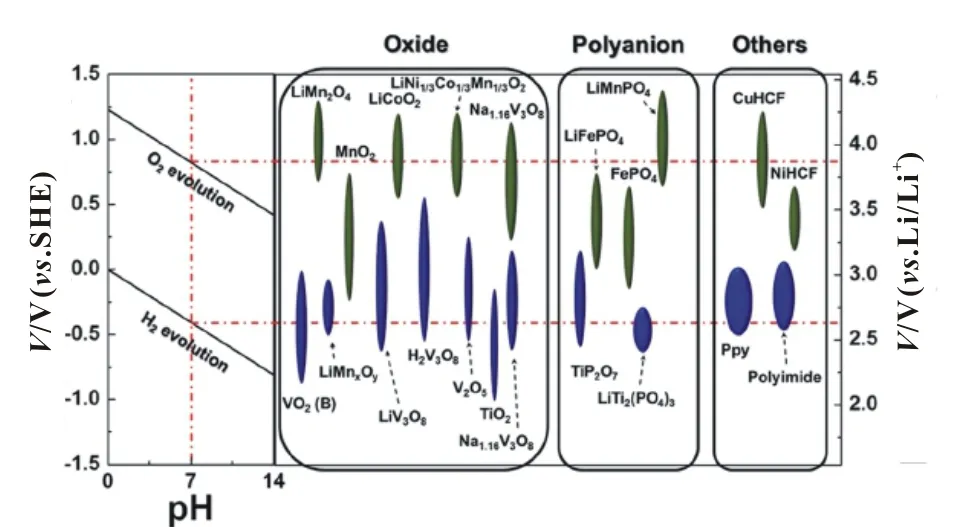
图1 锂离子电池电极材料相对水的电化学稳定范围和氧化还原电压
2 正极材料
水系可充锂离子电池的正极材料必须要能反复地进行脱出和插入锂,并且,脱锂和嵌锂电压要低于氧气析出电压,以确保水系电解液的稳定,另外,要最大化能量密度,增加锂的脱出和嵌入电压同样重要。
早期研究的正极材料放电容量有限,且循环性能差。放电容量有限主要由以下原因造成:H+同时插入进结构中;Li+/H+在电池循环过程中互换;水进入结构中;活性材料在水电解液中溶解[6-7]。一些研究通过掺杂和添加添加剂的方法修饰正极,并通过包覆的方法或改变电解液[8-9]来控制电极/电解液界面,以改善正极材料的性能。
2.1 氧化物2.1.1尖晶石LiMn2O4
Li等使用LiMn2O4作为正极,制备了第一个水系可充锂电池,其平均电压为1.5 V,能量密度为75 Wh/kg,与铅酸电池和镉镍电池相当。Pei等[10]进一步研究了pH值对LiMn2O4正极材料电化学反应的影响,结果显示,在低pH值下,氧化峰与水氧化略有重合,但在高pH值下,还原峰消失,水的氧化峰明显增加。这显示,适合的pH值对于LiMn2O4在水系可充锂电池中的使用是很重要的。
Jayalakshmi及其工作组证明了Li+在中性电解液(LiCl水溶液)中能够进行脱嵌,而不是H+[11]。Tian和Yuan通过修饰电解液成份[8]进一步改善了LiMn2O4的电化学性能,发现电极的倍率性能随着电解液浓度的增加而改善,这主要是高浓度电解液的离子电导率更高的原因。
Yuan等合成了系列Al掺杂的LiAl Mn2-O4[9],Al掺杂的材料循环性能更稳定,当以1 000 mA/g电流进行测量时,Al掺杂的样品循环超过 4 000次。Cvjeticanin等合成的 Li-Cr0.15Mn1.85O4循环性能也更稳定,这主要是通过Al和Cr的掺杂抑制了Jahn-Teller混乱和稳定了八面体位置。
材料纳米化可以改性LiMn2O4性能[12-13],Qu等合成了有孔的LiMn2O4。在100 mA/g电流密度下,LiMn2O4可以放出250 mAh/g的容量,在1 000 mA/g电流密度下,经10 000次循环后,可以保持其初始容量的93%(图2)。纳米结构LiMn2O4的高能量和长寿命主要归因于:(1)纳米结构减小了Li+的扩散距离并增加了电极/电解液面积;(2)纳米粒子补偿了由Jahn-Teller混乱引起的张力;(3)抑制了Mn扩散进电解液中[14];(4)水系电解液的高离子电导率具有高倍率性能的能力。
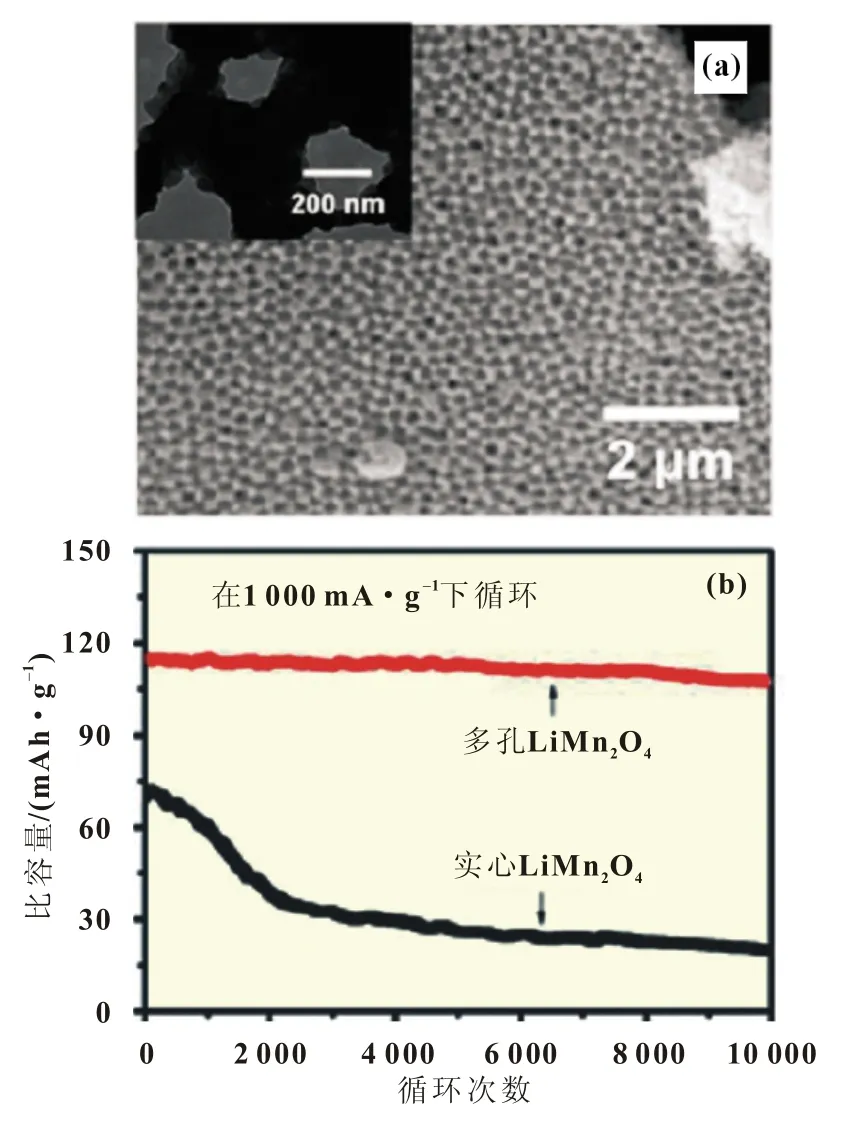
图2 (a)孔状LiMn2O4的SEM图和TEM图(内嵌);(b)实心和多孔LiMn2O4正极循环性能
2.1.2 二氧化锰(MnO2)
在二氧化锰的多种形态中,只有γ-、δ-和λ-MnO2能在水体系中嵌Li+。Deutsher等[15]研究了λ-MnO2相,λ-MnO2首次可放电~160 mAh/g,但是循环衰降较快。Yuan等测试了γ-MnO2电极,电池放电为35 mAh/g,1 500次循环后,保持初始容量的78%。Qu[16]等研究了δ-MnO2,显示Li+可以插入到δ-MnO2中,但是其没有提供循环数据。Minakshi等向电极中添加TiS2、TiB2、Bi2O3、CaO和CeO2等,改善了MnO2的电化学性能,这些添加剂的作用主要是抑制相的形变,减小电池中的负反应。
2.1.3 层状LiCoO2
层状LiCoO2是有机体系锂离子电池中最常用的正极材料,Li+也能可逆地在层状LiCoO2中脱嵌。Ruffo等[17]研究了不同LiNO3浓度下LiCoO2的电化学性能,结果显示,额定电压随着电解液浓度的增加而增加,这显示是Li+可逆地插入和脱出,而不是H+。LiCoO2在电压窗口0.55~1.15 V(.SHE)内,循环的极化作用较小,循环可稳定保持超过90次。在电压窗口0.55~1.2 V(.SHE)内,比容量近似达到115 mAh/g。另外Li-CoO2的库仑效率明显随着结止电压的升高而降低(图3)。
Tang等[18]使用溶液凝胶方法合成纳米 LiCoO2,纳米LiCoO2在1 000 mA/g电流密度下可放电143 mAh/g,在5 000和10 000 mA/g电流密度下,放电比容量分别为135和133 mAh/g,出色的倍率性能可能与小粒径的材料在水系电解液中的离子扩散更快有关(图4)。
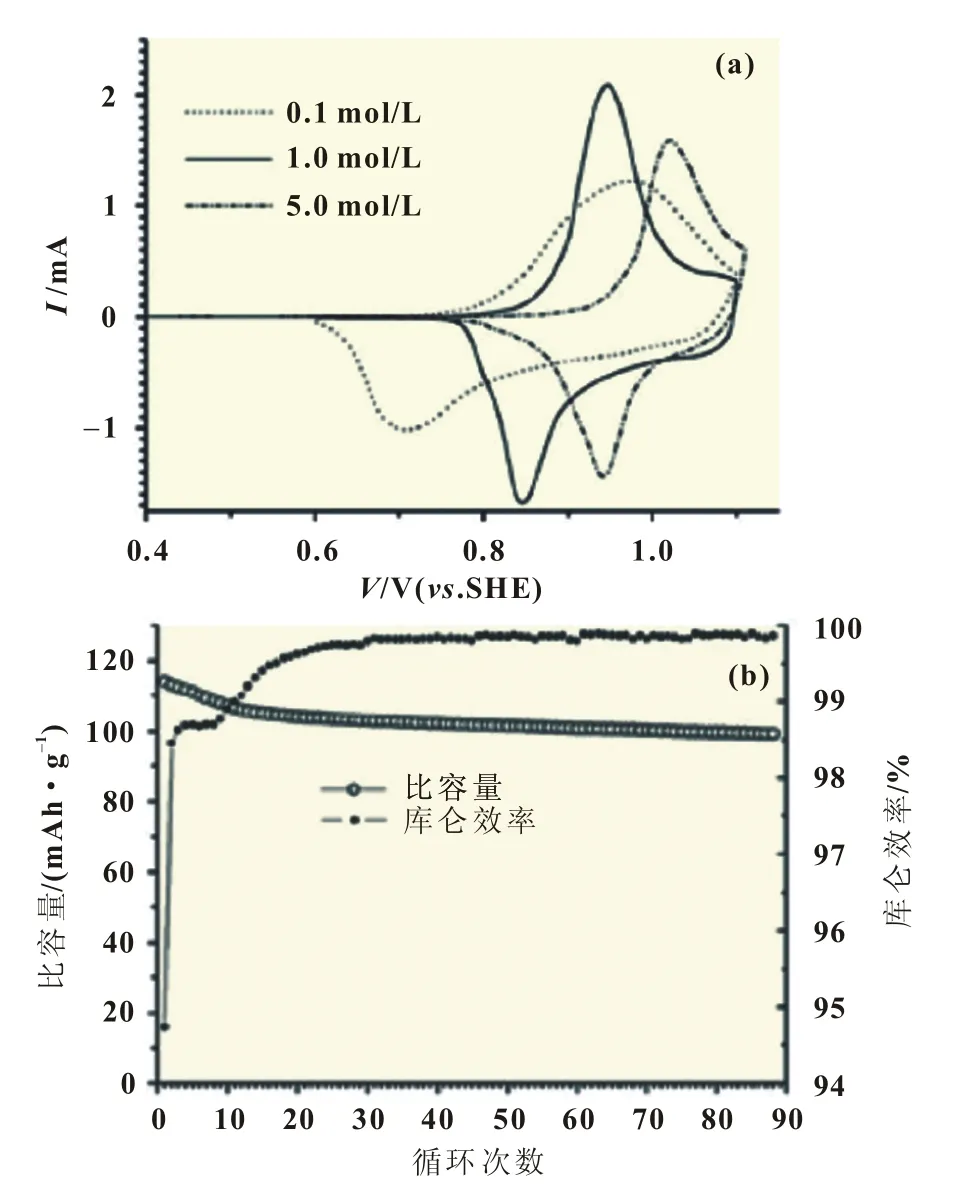
图3 (a)LiCoO2CV分析;(b)LiCoO2的循环性能和库仑效率
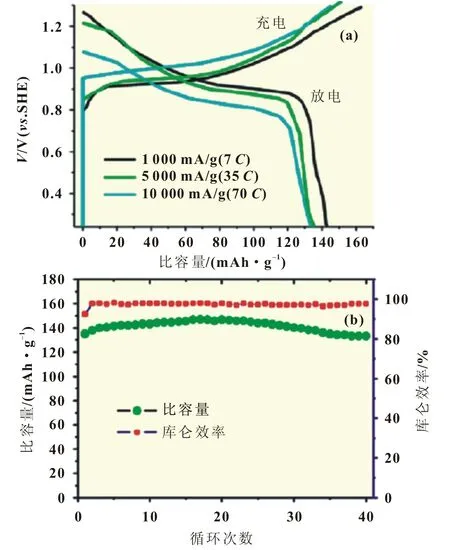
图4 (a)纳米LiCoO2不同电流倍率下的充放电曲线;(b)纳米LiCoO2循环性能
2.1.4 层状LiNi1/3Co1/3Mn1/3(NCM)
Wang[7]等研究了pH对LiNi1/3Co1/3Mn1/3电化学性能的影响,发现当pH值在7和9时,有负反应发生;当pH值为11时,NCM在电池中的稳定得到改善,当pH值为13时,NCM电极进一步稳定。Shivashankaraiah等制备了聚吡咯(PPy)包覆NCM材料。PPy包覆NCM首次放电比容量70 mAh/g,50次循环后保持比容量为55 mAh/g。Liu等使用较低pH值(4.9)的饱和 LiNO3作为电解液,第一次循环放电比容量103.9 mAh/g,50次循环后保持比容量为67.5 mAh/g。而Wang等合成了纳米孔状NCM材料,此纳米孔的NCM电极在1.5率下放电比容量155 mAh/g,在45率下可逆比容量为108 mAh/g。
2.1.5 Na1.16V3O8
Nair等研究了钒基(Na1.16V3O8,NVO)正极材料,NVO的充放电曲线呈线性,在5 A/g的电流密度下,首次放电比容量约为150 mAh/g,100次循环后,容量保持率为75%。他相信,层状结构的NVO更有利于锂离子的插入和脱出,钠离子的存在可以保持层状结构的稳定,因此,能保持出色的放电容量和循环性能。
2.2 多阴离子化合物2.2.1橄榄石LiFePO4
Manickam等研究了橄榄石LiFePO4正极材料,结果显示其容量存在明显衰降。He等发现,水溶液中的O2和OH-是导致LiFePO4衰降的主要原因,认为是O2和OH-引起了负反应所致。而通过碳包覆能有效阻止电解液中O2和OH-的溶解侵蚀,改善 LiFePO4的循环性能。Liu等合成掺杂的LiMn0.05Ni0.05Fe0.9PO4LiFePO4正极,具有优秀的循环稳定性和倍率性能。而使用CeO2等作为添加剂,同样可以改善LiFePO4的循环稳定性。
2.2.2 三角形FePO4
三角形FePO4与橄榄石LiFePO4类似,因而可以作为水系锂电池的正极材料。FePO4电极的初始放电比容量为 65 mAh/g,平均电压为0.5 V(.Zn电极),未见有循环数据报道。
2.2.3 橄榄石LiMnPO4
Minakshi等研究了橄榄石LiMnPO4的电化学性能,LiMn-PO4首次放电比容量可达70 mAh/g,但循环稳定性差,20次循环后,容量只有初始容量的20%。Manjunatha等通过电解液改善了循环稳定性。在5 mol/L LiNO3电解液中,LiMnPO4放电比容量为85 mAh/g,经过前5个循环的容量衰降后,电池可稳定循环50次。而其它通过掺杂和添加添加剂的方式来试图改善LiMnPO4性能的效果微弱。
2.2.4 其它的聚阴离子化合物
Zhao等研究了LiFeMn1-PO4(=0.5、0.4、0.3、0.2)的电化学性能,电极在0.1率下放电比容量分别为110.22、112.66、111.08和90.05 mAh/g。Minakshi等报道了LiMPO4(M=Co、Ni)的电化学性能,LiCoPO4循环25周的可逆放电比容量为80 mAh/g,LiNiPO4首次放电比容量约为90 mAh/g,但是可逆循环容量小于50%,容量衰降主要是由于在脱锂过程中形成了无定形NiPO4和少量氢氧化镍(β-NiOOH)。
2.3 普鲁士蓝类似物
Wessells等[19]使用共沉淀的方法制备了铜六氰基金属化物(CuHCF)和镍六氰基金属化物(NiHCF),CuHCF和NiHCF在0.83率下放电比容量约为58 mAh/g,在41.7下,放电比容量高于0.83率的60%,但容量衰降迅速。循环性能较差的主要原因是由于活性材料的溶解所致。
3 阳极材料
水系锂离子电池后的阳极材料包括氧化物[3,5,20]、聚阴离子化合物[21]和有机聚合物[22]。
大部分阳极材料容量衰降明显,主要原因是:(1)活性物质的溶解;(2)中子的插入可能导致了不可逆的结构变化;(3)嵌锂化合物的脱锂反应通常伴随着水的分解。研究显示,可以通过精确控制电解液中的pH值、电解液的类型、锂盐的浓度、含氧量和对活性材料表面包覆防护层来进行改善阳极的性能。
3.1 氧化物3.1.1单斜晶体VO2(B)
VO2(B)的循环性能通常较差。Zhang等(B)的研究显示,循环性能与电解液pH值紧密相关,pH值过低,氢的析出较大,pH值过高,VO2(B)溶解较大,导致容量衰降迅速。因此,VO2(B)电极在中等pH值下(pH=8.2)容量保持率相对较好。
VO2(B)的电化学性能可以通过形态上的优化而得到改善,Zhang等和Ni等分别合成了纳米VO2(B),结果显示,纳米VO2(B)具有较高的表面积,因此具有更高的容量和循环稳定性。此外,Wang等使用碳包覆在VO2(B)的表面,进一步改善了它的循环稳定性。
3.1.2 斜方晶次铁矿VO2(P-VO2)和黑铁钒矿VOOH
Wu和Xu分别通过化学反应合成了P-VO2[20]。P-VO2/ LiMn2O4电池的氧化还原电位为-500~200 mV(.SHE),略高于氢的析出电压。P-VO2在10 mA/g电流密度下放电比容量为65 mAh/g,50次循环后,容量保持率为74%[20]。
3.1.3 层状γ-LiV3O8
Kohler等研究了γ-LiV3O8负极材料,其比容量约45~90 mAh/g,100次循环后只能达到初始容量的25%~40%。Wang等使用了不同材料的正极测试了LiV3O8材料,在中性的pH值下,放电比容量为70 mAh/g,100次循环后容量低于初始容量的50%。研究显示,γ-LiV3O8阳极材料容量保持率差的原因,主要是晶体结构衰降造成的,循环过程伴随新化合物的生成。
γ-LiV3O8的性能可以通过电极修饰和电解液改进来改善,Ceng等制备了一种类似通心粉结构的γ-LiV3O8,0.1率放电比容量为189 mAh/g。Zhao等的研究显示电解液中氧气的消除和高浓度的锂盐 (9 mol/L LiNO3)明显增加了容量保持率。γ-LiV3O8在水系锂离子电池中的循环稳定性差与钒溶解导致的活性材料成分的变化有变。因此,当γ-LiV3O8溶解问题被解决后,可以作为水系锂离子电池可靠的阳极材料。
3.1.4 H2V3O8和Na1+V3O8
H2V3O8和Na1+V3O8结构接近γ-LiV3O8,因此可作为水系锂离子电池阳极材料,Li等通过水热法合成的H2V3O8纳米纤维能放出234 mAh/g的容量,50次循环后容量保持72%。
Nair等和Zhou等分别报道了H2V3O8和Na2V3O8·0.14 H2O的性能,Na1.6V3O8比容量高达150 mAh/g,100次循环后,容量保持率为75%,Na2V3O8·0.14 H2O循环性能较好,100次循环后,容量保持率为80.1%,200次循环后为77%。
3.1.5 V2O5
Wang等早期的研究显示,V2O5阳极循环性能较差 (40次循环后容量保持15%)。容量的迅速衰降主要是由于钒离子的溶解和晶体结构变化造成的。Wang等通过聚吡咯(PPy)和聚苯胺(PAn)包覆提高了V2O5的循环性能。而Tang等制备了V2O5纳米线和多壁碳纳米管(MWXNTs)的混合物,并通过PPy进行了包覆,此混合物循环500次后,容量几乎无衰降(图5)。
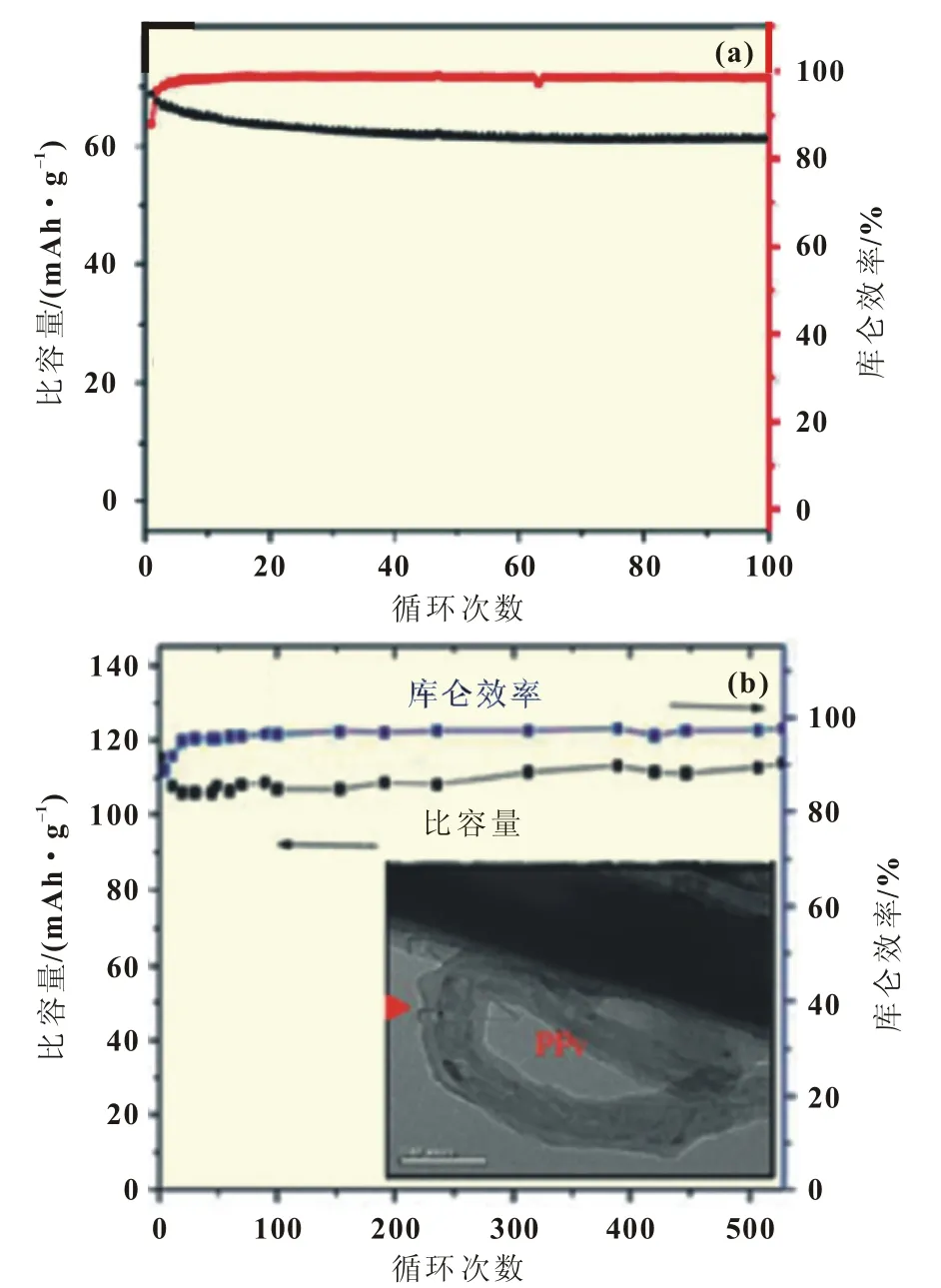
图5 (a)V2O5的库仑效率和循环寿命;(b)PPy包覆V2O5-MWCNTs混合物的循环性能和库仑效率
3.1.6 锐钛矿TiO2
Wu等通过电化学沉积方法合成了纳米结构TiO2,同时Liu等通过阳极化方法合成了纳米管陈列,纳米结构TiO2在循环过程中容量能保持稳定 (100次循环容量保持94.6%),且没有中子插入反应。纳米结构TiO2能避免中子的插入和不可逆相的转变的机理尚不清楚,需要更多的研究。
3.1.7 锂锰氧LiMn2O4
Li等和Pei等将尖晶石LiMn2O4用于水系锂离子电池的阳极,结果显示其放电容量有限,循环可逆性差。另一方面,Wang等使用LiMn2O4构建的水系锂离子电池,放电比容量100 mAh/g。
锂锰氧阳极的应用并不成功,主要原因在于:(1) Jahn-Teller活性Mn3+较大地扰乱了本体框架;(2)Mn2+溶解进电解液中;(3)理论比容量相对较低 (小于200 mAh/g),Mn4+/ Mn3+氧化还原电位过高。
3.2 聚阴离子化合物
Wang等将TiP2O7和LiTi2(PO4)3用作水系锂离子电池阳极材料。TiP2O7首次和第二次的放电比容量分别为100和90 mAh/g,而TiP2O7首次和第二次的放电比容量分别为115和100 mAh/g,但容量衰降迅速。原因是,循环过程中TiP2O7晶体分解并有新化合物生成,电极循环后结构发生了严重的损坏。
Luo等通过化学蒸汽沉积法合成了碳层包覆 (~25 nm)的LiTi2(PO4)3,200次循环后容量保持率为80%。此外,Wessells等证明保持电解液中性和消除水的分解对于改善循环稳定性是很重要的。
3.3 有机化合物
电子活性的有机基分子和聚合物能在它们共轭化学键中储存锂离子,因此,可被用于锂离子电池电极材料。Wang等研究了PPy阳极性能,但其放电容量仅为有机体系中的40%,容量可以稳定地保持120次循环。
Qin等将基于半1,4,5,8萘四甲酸酐(NTCDA)用于水系锂离子电池的阳极材料,其可逆比容量高达160 mAh/g,且高倍率放电循环性能较好。稳定的循环性能主要是由于:(1)化学键机理储存锂的固有特性能够最小化材料原始结构的损坏和膨胀;(2)柔软的聚合物框架可以经受阴离子的插入反应;(3)高的化学电阻率可以在碱性或酸性电解液中氧化或还原。在自然界中有大量多种多样的氧化还原功能中心可用,不仅仅局限于C=O活性功能团[23-24]。电活性有机化合物的柔软性和多样性使其可用于水系锂离子电池的电极材料。
4 总结与展望
水系锂电池的正极材料中,LiCoO2、LiMn2O4和NCM以其工作电压高而最有前途,但循环性能差,通过包覆可以缓解上述问题,但还需要进一步的改善;LiFePO4虽然环境友好和价格低廉,但电压过低,且循环性能差,不适合大规模应用;聚阴离子化合物循环性能较好,但充放电过程存在延迟问题,且反应机理也不清楚,需要进一步的研究;结构中不含Li材料(MnO2、FePO4和普鲁士蓝)具有出色的电化学性能,但阳极部分要预先嵌锂,否则这些材料不适合实际应用。
水系锂离子的阳极材料中,大部分循环性能较差,但通过消除了溶解氧气并增加电解液中的锂盐浓度、将活性材料与碳纳米管混合并包覆聚合物层、经碳包覆并控制了电解液的pH值等手段可明显改善阳极材料的循环性能。但是,大部分阳极材料在水体系中的利用率过低,需要进一步的研究。同时,阳极材料的数量和种类有限,需要发现更多的可用阳极材料。
[1]ARMAND M,TARACON J M.Building better batteries[J].Nature, 2008,451:652-657.
[2]TARACON J M,ARMAND M.Issues and challenges facing rechargeable lithium batteries[J].Nature,2001,414:359-367.
[3]LI W,DAHN J R,WAINWRIGHT D S.Rechargeable lithium batteries with aqueous electrolytes[J].Science,1994,264:1115-1118.
[4]DUNN B,KAMATH H,TARASCON J M.Electrical energy storage for the grid:a battery of choice[J].Science,2011,334:928-935.
[5]LI W,MCKINNON W R,DAHN J R.Lithium intercalation from aqueous solutions[J].Journal of the Electrochemical Society,1994, 141:2310-2316.
[6]WANG Y G,XIA Y Y.Hybrid aqueous energy storage cells using activated carbon and lithium-intercalated compoundsⅠ .The C/ LiMn2O4system[J].Journal of the Electrochemical Society,2006, 153:A450-A454.
[7]WANG Y G,LUO J Y,WANG C X,et al.Hybrid aqueous energy storage cells using activated carbon and lithium-ion intercalated compounds[J].Journal of the Electrochemical Society,2006,153, A1425-A1431.
[8]TIAN L,YUAN A B.Electrochemical performance of nanostructured spinel LiMn2O4in different aqueous electrolytes[J].Journal of Power Sources,2009,192:693-697.
[9]YUAN A B,TIAN L,XU W M,et al.Al-doped spinel LiAl0.1Mn0.9O4with improved high-rate cyclability in aqueous electrolyte[J].Journal of Power Sources,2010,195:5032-5038.
[10]WANG P,YANG H,YANG H Q.Electrochemical behavior of Li-Mn spinel electrode material in aqueous solution[J].Journal of Power Sources,1996,63:275-278.
[11]JAYALAKSHMI M,MOHAN RAO M,SCHOLZ F.Electrochemical behavior of solid lithium manganate(LiMn2O4)in aqueous neutral electrolyte solutions[J].Langmuir,2003,19:8403-8408.
[12]TANG W,HOU Y Y,WANG F X,et al.LiMn2O4nanotube as cathode material of second-level charge capability for aqueous rechargeable batteries[J].Nano Letters,2013,13:2036-2040.
[13]QU Q,FU L,ZHAN X Y,et al.Porous LiMn2O4as cathode material with high power and excellent cycling for aqueous rechargeable lithium batteries[J].Energy&Environmental Science,2011,4: 3985-3990.
[14]HOSONO E,KUDO T,HONMA I,et al.Synthesis of single crystalline spinel LiMn2O4nanowires for a lithium ion battery with high power density[J].Nano Letters,2009,9:1045-1051.
[15]DEUTSCHER R L,FLORENCE T M,WOODS R.Investigations on an aqueous lithium secondary cell[J].Journal of Power Sources, 1995,55:41-46.
[16]QU Q,ZHANG P,WANG B,et al.Electrochemical performance of MnO2nanorods in neutral aqueous electrolytes as a cathode for asymmetric supercapacitors[J].The Journal of Physical Chemistry C,2009,113:14020-14207.
[17]RUFFO R,WESSELLS C,HUGGINS R A,et al.Electrochemical behaviors of LiCoO2as aqueous lithium-ion battery electrodes[J]. Electrochemistry Communications,2009,11:247-249.
[18]TANG W,LIU L L,TIAN S,et al.Nano-LiCoO2as cathode material of large capacity and high rate capability for aqueous rechargeable lithium batteries[J].Electrochemistry Communications,2010, 12:1524-1526.
[19]WESSELLS C D,PEDDADA S V,MCDOWELL M T,et al.The effect of insertion species on nanostructured open framework hexacyanoferrate battery electrodes[J]Journal of the Electrochemical Society,2012,159:A98-A103.
[20]WU C Z,HU Z P,WANG W,et al.Synthetic paramontroseite VO2with good aqueous lithium-ion battery performance[J].Chemical Communications,2008,33:3891-3893.
[21]WESSELLS C,HUGGINS C,CUI Y.Recent results on aqueous electrolyte cells[J].Journal of Power Sources,2011,196:2884-2888.
[22]WANG G,QU Q,WANG B,et al.An aqueous electrochemical energy storage system based on doping and intercalation:PPy/Li-Mn2O4[J].A European Journal of Chemical Physics and Physical Chemistry,2008,9:2299-2301.
[23]LIANG Y,TAO Z,CHEN J.Organic electrode materials for rechargeable lithium batteries[J].Advanced Energy Materails,2012,2: 742-769.
[24]LEE M,HONG J,SEO D H,et al.Redox cofactor from biological energy transduction as molecularly tunable energy-storage compound[J].Angewandte Chemie International Edition,2013,52: 8322-8328.
Review on electrode materials of aqueous lithium batteries
Aqueous rechargeable lithium batteries(ARLBs)were of great potential since they had many advantages: ionic conductivity was about 2 orders of magnitude greater than organic electrolytes,since they would have higher rate capability and power density; the rigorous manufacturing conditions were avoided, and the prices of the electrolyte solvent and salts were relatively low,better safety and environmental benignness.Electrode material could be a critical factor for electrochemical behaviors of Aqueous rechargeable lithium batteries(ARLBs).The progress of ARLBs with a focus on the development of active materials were reviewed.
aqueous lithium batteries;cathode materials;anode materials
TM 912.9
A
1002-087 X(2015)10-2303-05

2015-05-20
王淼(1988—),男,天津市人,学士,主要研究方向为化学储能电源。

