两种方法检测LGC盲样及效果探讨
韩毅 彭浩
两种方法检测LGC盲样及效果探讨
韩毅 彭浩
目的 检测LGC盲样中的小肠结肠炎耶尔森氏菌并对过程和结果进行探讨。方法 ①分离培养法。②实时荧光PCR法。结果 两者均检出小肠结肠炎耶尔森氏菌。结论 两种方法的有效结合对目标菌检出有更重要的意义。
盲样;小肠结肠炎耶尔森氏菌;分离培养法;实时荧光PCR法
小肠结肠炎耶尔森氏菌是一种人兽共患的肠道病原菌,20世纪80年代才受到人们的重视,不少地区耶氏菌引起的胃肠炎和严重腹泻,比痢疾还多。1981年我国才发现此病,通过全国性调查和研究,发现其在我国的分布非常广泛,80年代中期证实过曾有两次大流行[1]。本菌是一种嗜冷菌,在0~4℃仍能继续繁殖并产生毒素。在冰箱内存放的污染该细菌的食品对人仍具有感染性[2]。鉴于小肠结肠炎耶尔森氏菌的危害性,很多国家都已将该菌列为食品的常规检测项目。本检测中心为了提高中心实验室的小肠结肠炎耶尔森氏菌检测能力,向英国LGC申请该菌的国际盲样考核,并通过常规鉴定法和PCR法对该盲样进行了实验。
1 材料与方法
1.1 标本来源 英国LGC(Laboratory of the Government Chemist政府化学家实验室)提供的冻干粉25 g。
1.2 培养基、试剂及仪器
1.2.1 分离培养法的培养基、试剂及仪器 改良磷酸盐缓冲液(PSB)、CIN-1培养基、改良Y培养基、改良克氏双糖培养基、尿素酶、动力半固体、糖发酵管由北京陆桥试剂有限公司提供;API鉴定系统、API-20E生化试剂条及其配套试剂,VITEK2全自动细菌鉴定仪及VITEK2-GN鉴定卡购自法国梅里埃公司。
1.2.2 实时荧光PCR法试剂及仪器 小肠结肠炎耶尔森氏菌核酸测定试剂盒 (实时荧光PCR法)购自上海之江生物科技有限公司;AB 7500 FAST型Real-Time PCR仪购自美国杜邦公司。
1.3 方法
1.3.1 分离培养 无菌操作称取25 g冻干粉放入装有225 mL改良磷酸盐缓冲液的无菌均质袋中,26℃增菌72 h,参照食品卫生微生物学检验小肠结肠炎耶尔森菌检验方法(GB/T4789.8-2008)[3]进行。取增菌液作碱处理,分别接种到CIN-1平板、改良Y平板上,26℃培养48 h。挑取可疑菌落接种改良克氏双糖,并做初筛的生化鉴定(尿素酶、鼠李糖、26℃和37℃培养下动力),符合以上反应者用API-20E生化试剂条和VITEK2全自动细菌鉴定仪做进一步的生化鉴定。
1.3.2 实时荧光PCR法 从上述分离培养的26℃增菌72 h的改良磷酸盐缓冲液中取出2 mL,用离心管13 000 rpm离心2 min,去尽上清;在沉淀中加入100 μL DNA提取液充分混匀,沸水浴10 min;13 000 rpm离心5 min,取上清4 μL与小肠结肠炎耶尔森氏菌核酸荧光PCR检测混合液35 μL、内部对照品1 μL、酶(Taq+UNG)0.4 μL,振荡混匀数秒,3 000 rpm离心数秒,立即进行PCR扩增反应。设置循环参数:37℃×2 min;94℃×2 min;再按93℃×15 sec→60℃×60 sec,循环40次,单点荧光检测在60℃。同时进行阳性对照品、阴性对照品试验。循环结束后,观察荧光曲线。
2 结果
2.1 分离培养结果 在CIN-1琼脂平板上多为红色、周围带较小透明环的菌落或红色无透明环的菌落。所有菌落均较为圆整,但大小不一,虽都为红色,但略有色差。在改良Y琼脂平板上多为无色透明、不黏稠的菌落,大小不一,也是略有色差。根据经验推断,该盲样中混入了除目标菌外的其他杂菌。因此,对CIN-1平板、改良Y平板上的多个不同菌落均进行分离纯化,挑取形态最接近目标菌的菌株进行镜检和生化初筛。初筛的生化鉴定中,改良克氏双糖接种管产酸不产气、尿素酶阳性、鼠李糖阴性、26℃培养下有动力,37℃培养下无动力。将该疑似菌落用API-20E生化试剂条和VITEK2全自动细菌鉴定仪进行鉴定。两者鉴定结果均为小肠结肠炎耶尔森氏菌,API-20E可靠性为95%(表1),VITEK2可靠性为99%(表2)。

表1 小肠结肠炎耶尔森氏菌API-20E生化试剂条鉴定结果

表2 小肠结肠炎耶尔森氏菌VITEK2全自动细菌鉴定仪鉴定结果
2.2 实时荧光PCR结果 (图1) 盲样的荧光曲线在21个循环处呈光滑的上升抛物线,峰值出现在在Delta Rn 1.0e+006左右处。阳性对照品的荧光曲线在10个循环处呈光滑的上升抛物线,峰值同样出现在在Delta Rn 1.0e+006左右处。阴性对照品则呈不规则的折线图。比较阳性对照品的荧光曲线和盲样的荧光曲线可以判断盲样为小肠结肠炎耶尔森氏菌检出。
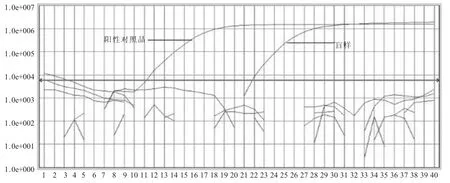
图1 实时荧光PCR结果
3 结论
我国现阶段食品中小肠结肠炎耶尔森氏菌的检测主要以传统分离培养为主,它是所有检测方法的金标准。但是按照国标上的方法进行培养时间较长,检测完成周期也较长。而且从CIN-1平板、改良Y平板上的菌落形态来看,有些非目标菌同国标上小肠结肠炎耶尔森氏菌的描述也很吻合。在此次的盲样考核中,作者就受到了很大的干扰。在CIN-1平板上分离出与小肠结肠炎耶尔森氏菌菌落形态很相似的一种菌,通过染色镜检,初步生化,最终生化,才确定其是一种大肠埃希氏菌。由于此类杂菌和目标菌的竞争,导致目标菌在选择性平板上生长的很少,这就给分离检出带来了困难。实时荧光PCR方法由于具有实时监测反应进程、快速、特异性强以及灵敏性高等优点而成为国外目前检验该菌的主要方法。但由于食品体系较复杂且杂菌率较高以致检出率较低,所以在使用实时荧光PCR方法检测小肠结肠炎耶尔森氏菌之前增菌是十分必要的[4]。在经过PSB的增菌以后,使用实时荧光PCR进行扩增,从荧光曲线结果来看,单位容积内的DNA数量有明显的呈指数级的扩增现象,而将未经增菌的PSB冻干粉溶液扩增后结果显示基本为阴性。将这两者直接转种至CIN-1平板上时,前者跟后者一样都很难直接分离出目标菌,原因可能是PSB在增菌的过程中选择性并不是很强,目标菌和杂菌都在大量的生长,而杂菌在CIN-1平板上的生长又优于目标菌,导致平板上的目标菌菌落过于稀少,这就给分离检出带来了困难。而将PSB增菌液进行碱处理后的效果就好的多,在CIN-1平板上也较容易分离出目标菌。因为耶尔森氏菌对弱碱具有较高的抵抗力,用弱碱液迅速处理15 s,可以杀死大部分不耐碱的其他细菌,能提高小肠结肠炎耶尔森氏菌的检出率[5]。
综上所述,实时荧光PCR法检测小肠结肠炎耶尔森氏菌速度快,周期短,但是普遍共知的是PCR法虽然灵敏度高,但是易出现结果的假阳性和假阴性。传统分离培养虽然周期长,操作繁琐且要求检测人员有丰富的经验,但是其检测的稳定性和把握性也更高。目前的有利条件是引进了全自动生化鉴定仪,这就给后期的确证带来了极大的方便和保证。两种方法均有自己的优势与不足,如何将两种方法有机的结合,创造出一套切实有效的操作模式,为我们的检测工作服务,这还有待于我们的进一步思考和研究。
[1]于恩庶.中国小肠结肠炎耶尔森氏菌病研究进展[J].中华流行病学杂志,2000,21(6):453-455.
[2]龚霄,陈盼.肉中革兰氏阴性食源性致病菌[J].肉类研究,2008,22(5):32-46.
[3]中华人民共和国卫生部.食品卫生微生物学检验小肠结肠炎耶尔森氏菌检验[S].北京:中国标准出版社,2008.
[4]牛蕾,祝长青,周光宏,等.小肠结肠炎耶尔森菌前增菌方式的选择[J].食品科学,2011,32(5):168-171.
[5]张昕,张惠媛,汪琦,等.小肠结肠炎耶尔森氏菌的检测[J].检验检疫科学,2008,18(6):23-26
Objective To detect Yersinia enterocolitica in LGC blind sample and probe into the process and results.Methods ①Isolated culture method.②Real-time fluorescence PCR method.Results Yersinia enterocolitica was detected by both methods.Conclusion The effective combination of the two methods has more important significance to detect Yersinia enterocolitica.
Blind sample;Yersinia enterocolitica;Isolated culture;Real-time fluorescence PCR method
2014-05-06)
1005-619X(2015)01-0087-03
10.13517/j.cnki.ccm.2015.01.046
214023无锡市疾病预防控制中心

