腺病毒介导的AIF及其突变体对K562细胞凋亡的影响
代安亚,王 方,冯文莉
(重庆医科大学 检验医学院 临床血液学教研室 临床检验诊断学教育部重点实验室, 重庆 400016)
研究论文
腺病毒介导的AIF及其突变体对K562细胞凋亡的影响
代安亚,王 方,冯文莉*
(重庆医科大学 检验医学院 临床血液学教研室 临床检验诊断学教育部重点实验室, 重庆 400016)
目的构建凋亡诱导因子(Ad-AIF)及其突变体的重组腺病毒(Ad-DMLS-AIF和Ad-DHBD-AIF),观察其对白血病K562细胞凋亡的影响。方法扩增AIF、DMLS-AIF和DHBD-AIF片段,分别克隆至pAd-Track-CMV-HA质粒中,经过PCR、双酶切和测序鉴定后,分别与pAd-Easy1质粒重组得到腺病毒质粒,经包装和扩增后得到腺病毒,以无外源序列的腺病毒作为空载腺病毒。Western blot验证重组腺病毒在K562细胞中的表达,免疫共沉淀检测AIF、DMLS-AIF和DHBD-AIF是否与HSP70相结合,Hoechst33258染色和流式细胞术检测AIF、DMLS-AIF和DHBD-AIF对K562细胞凋亡的影响。 结果重组腺病毒构建成功,能够在K562 细胞中表达;AIF和DMLS-AIF与HSP70相结合,DHBD-AIF不结合HSP70; Ad-DHBD-AIF引起K562细胞染色质凝集,而Ad-AIF和Ad-DMLS-AIF处理的K562细胞染色质分布均匀; Ad-DHBD-AIF引起K562细胞凋亡数明显高于Ad-AIF和Ad-DMLS-AIF(P<0.05)。 结论成功构建了腺病毒Ad-AIF、 Ad-DMLS-AIF和Ad-DHBD-AIF,其中Ad-DHBD-AIF对K562细胞的凋亡影响明显高于Ad-AIF和Ad-DMLS-AIF,为K562细胞凋亡受阻的进一步研究奠定了基础。
凋亡诱导因子;细胞凋亡;腺病毒载体;K562细胞
慢性粒细胞白血病(chronic myeloid leukemia, CML)是以9号染色体和22号染色体易位形成BCR-ABL融合蛋白为特点的造血功能紊乱的疾病,其通过激活多条信号传导通路引起细胞凋亡受阻[1]。凋亡诱导因子(apoptotic inducing factor, AIF)是参与细胞非依赖caspase凋亡途径的重要因子之一,其基因存在于X染色体上[2- 3]。在细胞处于正常状态时,AIF在线粒体内借助其NADH和FAD结合区域参与氧化还原过程,起传递电子的作用;当细胞受到凋亡刺激时,AIF从线粒体中释放,进入细胞核中,与DNA结合,引起染色质聚集并将DNA切割成约50 kb的大片段,最终导致细胞死亡[2- 5]。在Cos和Rat- 1细胞中上调靶向线粒体膜的Bcl- 2蛋白,可延缓AIF异位和核凋亡[6];AIF进入细胞浆后, HSP70等蛋白与其结合,使其失去进入细胞核的能力,最终细胞凋亡受阻[6- 7],而AIF在凋亡异常的CML细胞中的作用目前仍不明确,其参与的凋亡过程是否与HSP70有关也不清楚,因此构建含野生型凋亡诱导因子(Ad-apoptosis-inducing factor,Ad-AIF)、缺线粒体定位信号结构域的凋亡诱导因子突变体(Ad-apoptosis-inducing factor-defected mitochondria localization sign, Ad-DMLS-AIF)和在DMLS-AIF基础上缺HSP70结合位点的凋亡诱导因子突变体(Ad-apoptosis-inducing factor-defected HSP70 banding domain, Ad-DHBD-AIF)的重组腺病毒,观察三者对K562细胞凋亡的影响,为研究慢性粒细胞白血病凋亡异常提供依据。
1 材料与方法
1.1 材料
1.1.1 质粒、菌株和细胞系:腺病毒穿梭质粒pAd-Track-cmv-HA及骨架质粒pAd-Easy1,E.coliDH5α及E.coliBJ5183,AD293细胞及K562细胞均为本实验室保存。
1.1.2 主要试剂:RNA提取试剂盒、PrimeScript RT reagent kit、PrimeSTART® HS DNA聚合酶、T4 DNA连接酶和限制性内切酶 (SalⅠ、NotⅠ)(Takara公司);限制性内切酶PmeⅠ和PacⅠ(NEB公司);质粒提取及纯化试剂盒[天根生化科技(北京)有限公司];琼脂糖胶(Gene公司);lipofectamineTM2000和Opti-MEM(Invitrogen公司);鼠抗HA单克隆抗体、兔抗β-actin单克隆抗体和辣根过氧化酶-羊抗鼠或羊抗兔IgG抗体(Santa Cruz公司);基因转染增强剂Polybrene和Hoechst33258试剂(Sigma公司);免疫共沉淀试剂盒(Thermo公司);RIPA细胞裂解液(Cell Signaling公司);DMEM和RPMI-1640培养液(Gibco公司);胎牛血清(四季青公司)。
1.2 方法
1.2.1 细胞培养:含10% FBS的DMEM培养基培养AD293细胞,含10% FBS的RPMI1640培养基培养K562细胞,均在37 ℃、5% CO2的环境中培养。
1.2.2 目的基因的扩增:根据GenBank中人AIF cDNA序列(AF100928)设计引物, 由华大基因合成。 AIF上游:5′-ACGCGTCGACATGTTCCGGTGTGG AGGCCTGGCGGCGGGTGC-3′,DMLS-AIF上游:5′-A CGCGTCGACGAGGAAGTTCCTCAAGACAAGGCGC-3′,DHBD-AIF上游:5′-ACGCGTCGACACTGGGAAGAA GGTAGTACAGCTGG-3′,以上三者的共同下游: 5′-ATAAGAATGCGGCCGCTCAGTCTTCATGAATGTTGA ATAG-3′(下划线加粗部位为SalⅠ酶切位点,下划线部分为NotⅠ酶切位点)。提取K562细胞总mRNA,反转录成cDNA,以此为模板,利用PCR扩增获得AIF片段。PCR反应体系为:5×PCR Primer STAR缓冲液10 μL,dNTP混合物4 μL,模板1 μL,引物各1 μL,DNA聚合酶0.5 μL,补水至50 μL。PCR反应条件为:98 ℃预变性1 min;98 ℃变性10 s,55 ℃退火15 s,72 ℃延伸80 s,共32个循环,72 ℃再延伸10 min。DMLS-AIF及DHBD-AIF基因的扩增同AIF基因。PCR产物经2%琼脂糖凝胶电泳鉴定并进行回收纯化。
1.2.3 重组腺病毒穿梭质粒的构建:将AIF、DMLS-AIF和DHBD-AIF基因分别连接到pAd-Track-CMV-HA质粒中,转化至DH5α,増菌扩增后提取质粒,经SalⅠ和NotⅠ双酶切、PCR鉴定正确后送英潍捷基(上海)贸易有限公司测序。
1.2.4 重组腺病毒质粒的构建、包装和扩增:将重组穿梭质粒与 pAd-Easy1质粒重组,转化至DH5α中,提取质粒,PacⅠ酶切鉴定正确后进行腺病毒包装。
取对数生长期的AD293细胞,按照每孔1×105个/L细胞接种于6孔板中。将被PacⅠ酶切线性化的腺病毒质粒同转染试剂lipofectamineTM2000(腺病毒质粒∶lipofectamineTM2000=1∶3)混合,转染AD293细胞,37 ℃、5% CO2培养箱中培养。在12~13 d时,在荧光显微镜下可见大量带有GFP绿色荧光的细胞,离心收集细胞,在-80 ℃与37 ℃之间,经5次冷冻-融化-剧烈振荡后,离心收集上清液,获得第一代重组腺病毒,命名为Ad-AIF、Ad-DMLS-AIF和Ad-DHBD-AIF,经3轮扩增后,收集上清液,-80 ℃保存。
1.2.5 Western blot检测目的蛋白在白血病K562细胞中的表达:提取空载腺病毒、Ad-AIF、 Ad-DMLS-AIF和Ad-DHBD-AIF感染24 h后的K562细胞蛋白和未处理K562细胞蛋白,进行8% SDS-PAGE,4 ℃,含5%脱脂奶粉的TBST封闭过夜,加入鼠抗HA单克隆抗体和兔抗β-actin单克隆抗体(1∶1000稀释)4 ℃孵育8 h,TBST洗3次,5 min/次,辣根过氧化物酶-羊抗鼠IgG抗体或辣根过氧化物酶-羊抗兔IgG抗体(1∶1 000稀释)室温孵育1 h,TBST洗3次,5 min/次,电化学发光仪检测蛋白的表达。 1.2.6 免疫共沉淀分析HSP70与AIF、DMLS-AIF和DHBD-AIF之间的关系:在Ad-AIF感染K562细胞48 h时,离心收集细胞,PBS洗3次,提取蛋白,考马斯亮蓝测其浓度,1 mg蛋白加入HSP70抗体20 μL,裂解/清洗缓冲液补充至300 μL(将此混合液命名为A液),4 ℃,混匀6 h后,吸取20 μL Pierce A/G Agarose至收集管中,1 000×g离心1 min,100 μL裂解/清洗缓冲液清洗收集管2次,将A液加入至收集管中,4 ℃,混匀1 h后,1 000×g离心1 min,清洗收集管两次,100 μL 1×条件缓冲液清洗1次,加入50 μL洗脱液,100 ℃煮5 min,4 ℃,13 000×g离心10 min,-80 ℃保存,Ad-DMLS-AIF、Ad-DHBD-AIF及未处理组同Ad-AIF处理,Western blot分析。
1.2.7 Hoechst33258染色和流式细胞术观察重组腺病毒对白血病K562细胞凋亡的影响:将空载腺病毒、Ad-AIF、 Ad-DMLS-AIF和Ad-DHBD-AIF分别感染K562细胞,在37 ℃、5% CO2条件下培养,分别在48 h时收集细胞,采用Hoechst33258染色检测K562细胞凋亡;将空载腺病毒、Ad-AIF、 Ad-DMLS-AIF和Ad-DHBD-AIF分别感染K562细胞48 h,同时将K562细胞使用泛caspase抑制剂Z-VAD-FMK预处理后再感染Ad-DHBD-AIF 48 h,分别收集细胞,采用流式细胞术(送于重庆医科大学生命科学研究院进行检测,该单位采用7-ADD和Annexin-PE进行标记)进行K562细胞的凋亡检测。
1.3 统计学分析
2 结果
2.1 目的基因扩增和鉴定
PCR扩增获得了1 842 bp的AIF片段、1 482 bp的DMLS-AIF片段和1 158 bp的DHBD-AIF片段 (图1)。
2.2 重组腺病毒的包装和扩增
包装重组腺病毒的第8天进行GFP荧光采集(图2),包装的原代腺病毒在12天左右收获。
2.3 目的蛋白在白血病K562细胞中的表达验证
在空载腺病毒、Ad-AIF、Ad-DMLS-AIF和Ad-DHBD-AIF分别感染K562细胞24 h后,可检测到各自相应蛋白的表达(图3)。
2.4 免疫共沉淀分析AIF、DMLS-AIF和DHBD-AIF是否与HSP70结合
AIF和DMLS-AIF与HSP70结合,而DHBD-AIF不与HSP70结合(图4)。
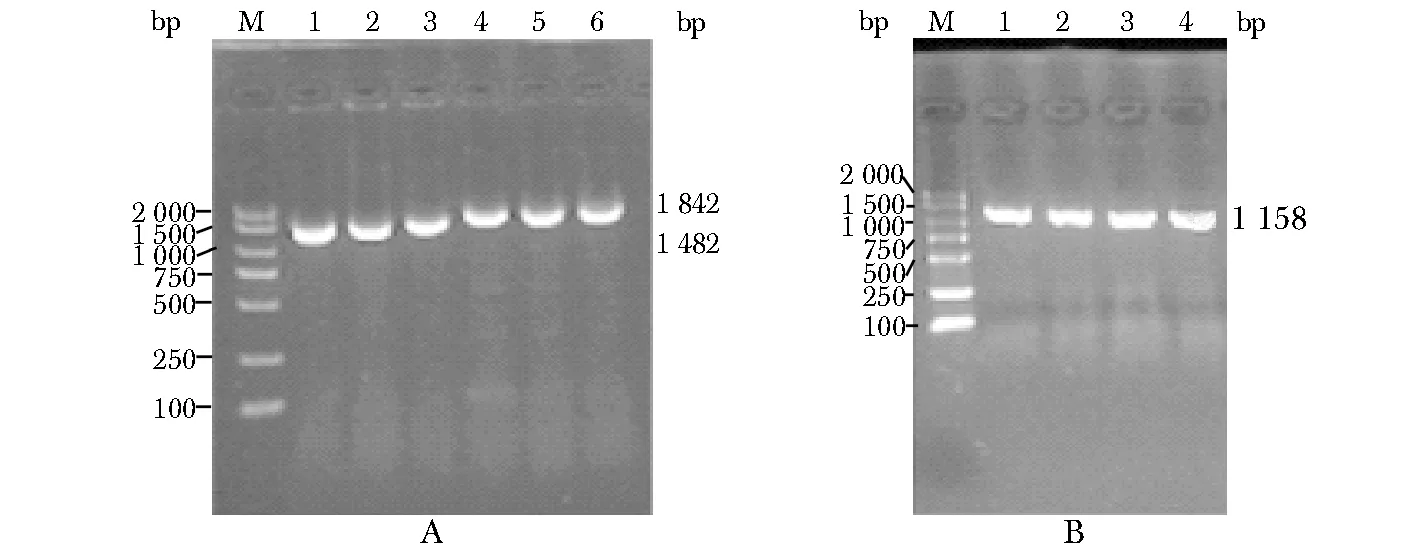
A:amplification products of AIF and DMLS-AIF, M.DL2000(+1 500 bp) DNA marker, 1~3.amplification products of DMLS-AIF, 4~6.amplification products of AIF; B.amplification products of DHBD-AIF; 7~10.amplification products of DHBD-AIF; M.DL2000C+1 500 bp DNA marker
图1 PCR扩增AIF、 DMLS-AIF和DHBD-AIF产物
Fig 1 Amplification products of AIF,DMLS-AIF and DHBD-AIF by PCR

图2 荧光显微镜检测在重组腺病毒质粒转化AD293细胞第8天时GFP荧光蛋白的表达Fig 2 The expression of GFP protein in AD293 cellsat 8th day transformed with recombinant adeno-virus plasmid was detected through fluore-scence microscope(×100)
2.5 重组腺病毒对白血病K562细胞凋亡的影响
Ad-DHBD-AIF处理组的K562细胞呈凋亡形态改变,细胞核变亮,核内染色质浓缩呈环状或团状或串珠状,Ad-AIF和Ad-DMLS-AIF处理组,K562细胞核染色均匀(图5);Ad-DHBD-AIF引起K562细胞凋亡数目明显高于其他处理组, caspase失活可促进Ad-DHBD-AIF引起的细胞凋亡(图6)。

图3 Western blot验证AIF、DMLS-AIF和DHBD-AIF在白血病K562细胞中的表达Fig 3 Identification of AIF, DMLS-AIF and DHBD-AIFexpressing in leukemia K562 cells throughWestern blot

图4 CO-IP检测HSP70与AIF、DMLS-AIF或DHBD-AIF的关系Fig 4 The relationship between HSP70 and AIF, DMLS-AIF or DHBD-AIF was detected by CO-IP

图5 Hoechst33258染色评价重组腺病毒对白血病K562细胞凋亡的影响Fig 5 Apoptotic effect of recombinant adenovirus on leukemia K562 cells analyzed by Hoechst33258 staining(×400)
3 讨论
慢性粒细胞白血病是一种细胞凋亡受阻的恶性血液性肿瘤,对新发的慢性期患者,伊马替尼治疗效果较好,但是随着治疗的进行,对伊马替尼耐药和复发现象也随即出现[8- 9],因此对慢性粒细胞白血病细胞凋亡异常的研究尤为重要。由于肿瘤的发生原因之一是细胞凋亡受阻,因此再次激活细胞凋亡成了消除肿瘤的主要目标,也是多种血液性肿瘤包括急慢性T淋巴细胞白血病放化疗的目标[10]。凋亡诱导因子(apoptosis-inducing factor,AIF)参与非依赖caspase的凋亡途径,首先在线粒体中被剪切成为成熟的AIF,当线粒体膜通透性增加时,被释放进入胞质,再进入细胞核中发挥促凋亡作用。有研究者发现在Jurkat细胞中,联合维甲酰酚胺和吲哚美辛可诱导AIF入核,使约90%的细胞发生凋亡[11];在Jurkat细胞和急性淋巴细胞白血病病人的细胞中,锌螯合剂TPEN通过诱导产生过氧化氢而引起线粒体膜通透性增加,AIF释放入核,引起细胞凋亡[12]。
AIF是细胞内源性蛋白,在caspase失活或者未被激活的情况下才发挥作用[7],然而有研究发现当使用泛caspase抑制剂后,AIF释放过程受到影响,不能入核发挥作用[13],即使释放之后,在一些肿瘤细胞中AIF也被HSP70阻滞在细胞浆中[14],不能入核发挥促凋亡作用。然而CML细胞凋亡受阻是否与AIF有关还尚不清楚,因此该研究利用腺病毒具有感染率高, 不受细胞种类及增殖状态限制, 无遗传毒性, 携带外源基因量大以及操作方便等优点[15],构建了含野生型凋亡诱导因子、缺线粒体定位信号结构域的凋亡诱导因子突变体和在缺线粒体定位信号的基础上再缺HSP70结合位点的凋亡诱导因子突变体的重组腺病毒,观察3者对K562细胞凋亡的影响。结果显示:成功构建了重组腺病毒Ad-AIF、Ad-DMLS-AIF和Ad-DHBD-AIF,其中Ad-DHBD-AIF可引起K562细胞发生凋亡,并且caspase失活可增强其促凋亡作用,而与HSP70结合的Ad-AIF和Ad-DMLS-AIF对 K562细胞凋亡的影响与空载腺病毒组类似, 因此K562细胞凋亡异常与AIF结合HSP70有密切关系,这为慢性粒细胞白血病细胞凋亡异常的机制研究奠定了基础。
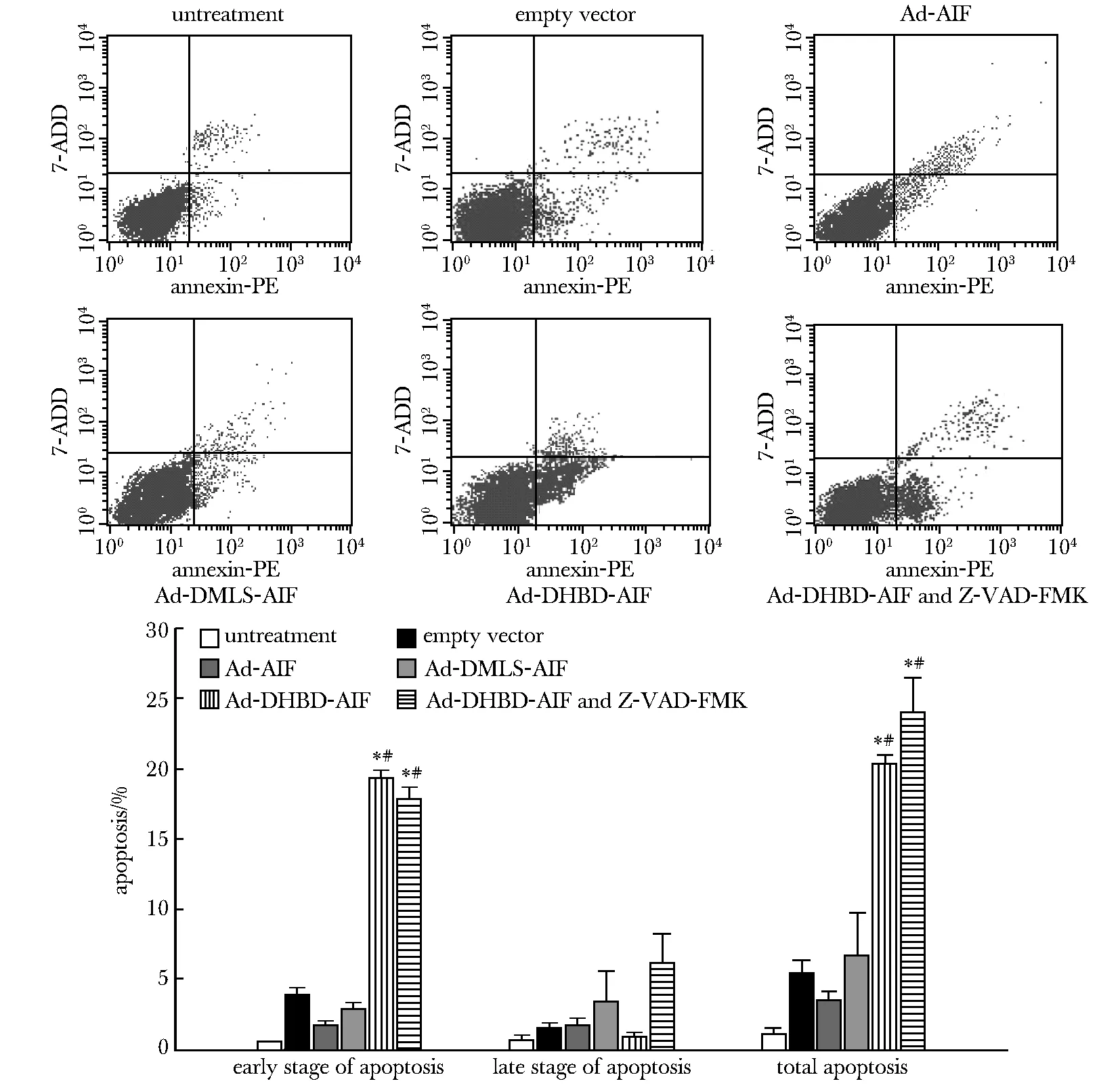
*P<0.05 compared with empty vector; #P<0.05 compared with Ad-AIF and Ad-DMLS-AIF图6 流式细胞术检测重组腺病毒对K562细胞凋亡的影响Fig 6 Effect of recombinant adenovirus on the apoptosis of K562 cells analyzed by flow cytometry
[1] Chen X, Shi XP, Zhao C,etal. Anti-rheumatic agent auranofin induced apoptosis in chronic myeloid leukemia cells resistant to imatinib through both Bcr/ Abl-dependent and -independent mechanisms [J]. Oncotarget,2014, 5: 9118- 9132.
[2] Sevrioukova IF. Apoptosis-Inducing Factor: Structure, Function, and Redox Regulation[J]. Antioxid Redox Signal,2011,14:2545- 2579.
[3] Modjtahedi N, Giordanetto F, Madeo F,etal. Apoptosis-inducing factor: vital and lethal[J]. Trends Cell Biol,2006,16:264- 272.
[4] Delavalle L, Cabon L, Galan-Malo P,etal.AIF-mediated Caspase-independent Necroptosis: A New Chance for Targeted Therapeutics[J].IUBMB Life,2011,63: 221- 232.
[5] Ding ZJ, Chen X, Tang XX,etal. Calpain inhibitor PD150606 attenuates glutamate induced spiral ganglion neuron apoptosis through apoptosis inducing factor pathwayinvitro[J]. PLoS One,2015,10:e0123130-e0123140.doi: 10.1371/journal.pone.0123130.
[6] Loeffler M, Daugas E,Susin SA,etal. Dominant cell death induction by extramitochondrially targeted apoptosis-inducing factor[J]. FASEB J,2001,15:758- 767.
[7] Han B, Wang TD, Shen SM,etal. Annonaceous acetogenin mimic AA005 induces cancer cell death via apoptosis inducing factor through a caspase- 3-independent mechanism [J]. BMC Cancer,2015,15:139- 150.
[8] Chen X, Shi XP, Wang XJ,etal. Novel use of old drug: Anti-rheumatic agent auranofin overcomes imatinib-resistance of chronic myeloid leukemia cells[J]. Cancer Cell Microenviron,2014, 1:e415- 422.doi: 10.14800/ccm.415.
[9] Reavie L,Buckley SM, Loizou E,etal. Regulation of c-Myc Ubiquitination Controls Chronic Myelogenous Leukemia Initiation and Progression[J].Cancer Cell,2013,23:362- 375.
[10] Mendivil-Perez M, Jimenez-Del-Rio M, Velez-Pardo C. Glucose starvation induces apoptosis in a model of acute T leukemia dependent on caspase- 3 and apoptosis-inducing factor: a therapeutic strategy[J]. Nutr Cancer,2013,65: 99- 109.
[11] Hojka-Osinska A, Ziolo E, Rapak A. Combined treatment with fenretinide and indomethacin induces AIF-mediated, non-classical cell death in human acute T-cell leukemia Jurkat cells[J]. Biochem Biophys Res Commun,2012,419: 590- 595.
[12] Mendivil-Perez M, elez-Pardo C, Jimenez-Del-Rio M. TPEN induces apoptosis nindependently of zinc chelator activity in a model of acute lymphoblastic leukemia and ex vivo acute leukemia cells through oxidative stress and mitochondria caspase- 3-and AIF-dependent pathways[J]. Oxid Med Cell Longev,2012: 313275- 313289.
[13] Arnoult D, Parone P, Martinou JC,etal. Mitochondrial release of apoptosis-inducing factor occurs downstream of cytochrome c release in response to several proapoptotic stimuli[J].J Cell Biol, 2002,159:923- 929.
[14] Zhu Q, Xu YM, Wang LF,etal.Heat shock protein 70 silencing enhances apoptosis inducing factor-mediated cell death in hepatocellular carcinoma HepG2 cells[J].Cancer Biol Ther,2009,8: 792- 798.
[15] 李千音,黄峥兰,高淼,等.重组腺病毒Ad5 / F35-HF2S 的构建及其鉴定[J].中国生物制品学杂志,2012,25:1434- 1438.
Effect of adenovirus-mediatedAIF and its mutants on the apoptosis of K562 cells
DAI An-ya, WANG Fang, FENG Wen-li*
(Dept. of Clinical Hematology,Key Laboratory of Medical Diagnostics,Ministry of Education,Chongqing Medical University,Chongqing 400016,China)
Objective To construct the recombinant adenovirus Ad-AIF, Ad-DMLS-AIF and Ad-DHBD-AIF and to detect their apoptotic effect on leukemia K562 cells. Methods AIF gene and its mutants(DMLS-AIF gene and DHBD-AIF gene)were amplified and cloned into the shuttle plasmid pAd-Track-CMV-HA, after identification by PCR, double-enzyme digestion and sequencing, recombined homology with pAdEasy1 to obtain recombinant adenovirus plasmid and then were packaged and amplified, adenovirus without exogenous sequence as empty vector. Western blot was used to analyze expression of the recombinant adenovirus in K562 cells; Co-immunoprecipitation assay (CO-IP) was applied to detect the relationship between HSP70 and AIF or DMLS-AIF or DHBD-AIF; Hoechst33258 dye and FCM were applied to detect the apoptotic effect of the recombinant adenovirus on K562 cells. Results The recombinant adenovirus was successfully constructed and expressed in K562 cells; AIF and DMLS-AIF were connected to HSP70 except DHBD-AIF; the chromatin was agglutinated in K562 cells infected with Ad-DHBD-AIF, that were uniformity in K562 cells infected with Ad-AIF or Ad-DMLS-AIF; the apoptotic efficacy of Ad-DHBD-AIF on K562 cells was better than that of Ad-AIF and Ad-DMLS-AIF. Conclusions Ad-AIF, Ad-DMLS-AIF and Ad-DHBD-AIF were constructed successfully, the apoptotic effect of Ad-DHBD-AIF on K562 cells was higher significantly comparing with that of Ad-AIF and Ad-DMLS-AIF, which may support to explore the anti-apoptosis mechanisms in K562 cells.
apoptosis-inducing factor;cell apoptosis;recombinant adenovirus;K562 cells
2015- 05- 18
2015- 07- 03
国家自然科学基金(81070421)
1001-6325(2015)11-1453-07
R733.3
A
*通信作者(corresponding author):fengwlcqmu@sina.com

