钯催化卤代芳烃氨解反应的研究进展
梅苏宁,杨建明,李亚妮,余秦伟,王为强,张前,袁俊,吕剑
(西安近代化学研究所,陕西 西安 710065)
氨解反应是指氨或胺与有机化合物发生复分解生成胺的反应,利用氨解反应可以制备各种脂肪胺和芳香胺等。其中,芳香胺大多是重要的生物活性物质和有机合成中间体[1-3]。铜、镍和铂系等金属[4]催化硝基化合物的连续加氢还原法是生产芳香胺类化合物最重要的工艺。一种更新的、并且越来越 重要的芳香胺类化合物的合成工艺是过渡金属催化芳香族卤代烃的氨解反应,其中钯催化的该氨解 反应是非常确定和重要的合成芳香胺类化合物的 方法[5-6]。
在过去的三十多年里,钯催化卤代芳烃与含氮化合物的氨解反应已经获得了广泛应用[7-9]。早在1983年,Migita 等[10]就发现N,N-二乙氨基-三丁基锡与溴苯可以在邻甲苯基膦[P(o-tolyl)3]的Pd(Ⅱ)配合物催化下生成芳香胺,首次实现了钯催化的溴苯氨解。1994年,Hartwig 等[11]进一步实现了含有溴代芳烃与仲胺的氨解反应。同年,Buchwald 等[12]则发现在Migita 催化体系下,可以利用一锅法同时完成锡化物的制备和溴苯的氨解。1995年,Buchwald 等[13]和Hartwig 等[14]同时发现在碱性条件下,用其他胺化物代替有毒的且不稳定的锡胺,钯催化溴代芳烃氨解也能得到芳香胺。在随后几年里,Buchwald、Hartwig 及其他团队通过不同配体与Pd形成的催化体系,对钯催化卤代芳烃与氨或胺在不同条件下的氨解反应进行了系统研究,取得了一系列成果。本文将根据含氮亲核试剂的不同,对这类构建C—N 键的方法进行综述。
1 布赫瓦尔德-哈特维希交叉偶联反应
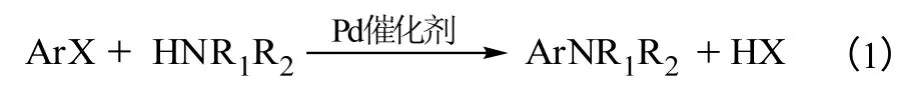
钯配合物催化的卤代芳烃与氨/胺之间的C—N交叉偶联反应统称为布赫瓦尔德-哈特维希交叉偶联反应(Buchwald-Hartwig cross coupling reaction)[15],其实质为钯催化的氨解反应,可以用通式(1)来表示。
该偶联反应是合成芳香胺的有效途径,Hartwig等[16-18]进行的一系列机理实验使得合理推测该反应的机理成为可能。其推测机理如图1 所示。首先,零价钯活性催化剂LnPd(0)从催化剂前体中释放出来,并与卤代芳烃氧化加成,形成二价钯的过渡态化合物A;接着,A 与氨配合,形成催化剂-卤代芳烃-氨的配合物过渡态化合物;继而该过渡态化合物 在碱作用下通过去质子化作用脱去质子,形成钯-氨基配合物B,B 再经还原消除反应得到芳香胺。
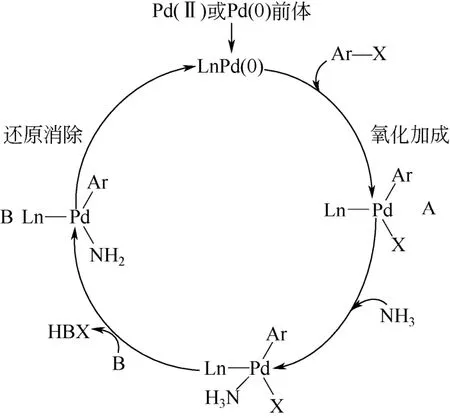
图1 钯催化卤代芳烃与氨偶联反应的推测机理
一个完整的Buchwald-Hartwig 偶联反应包含催化体系、亲电试剂和亲核试剂等3 个主要部分,这些因素相互协同完成催化历程。值得注意的是,氨作为广泛存在且极其廉价的氮源,是用于该偶联反应的最理想亲核试剂。尽管可以提供更直接和更经济的合成含氮化合物的路线,但是在该偶联反应中使用氨,直到最近才被意识到[19]。
2 卤代芳烃与氨的氨解反应
2006年,Hartwig 的研究团队[16]首次报道了钯催化卤代芳烃与氨水进行氨解反应的例子。他们以Pd(CH3CN)2Cl2和二茂铁双膦配体 CyPF-t- Bu(Josiphos 配体)为原料,制备了一种具有辅助配体且对氨取代稳定的催化剂(CyPF-t-Bu)PdCl2。该催化剂对于各种卤代芳烃的氨解反应都具有很高的反应活性和伯胺选择性,如式(2)所示。反应物的浓度和氨的压力对于保证高转化率和伯胺(P)相对于仲胺(S)的选择性(P/S)具有决定性作用。氯代芳烃也能以较好的收率合成目标产物,但是伯胺选择性却显著降低。

2007年,Buchwald 的团队[20]以Pd2dba3为Pd源,t-BuONa 为碱研究了卤代芳烃的氨解反应,如式(3)所示。当使用联苯膦配体L1 时,氨解反应选择性较高,而当使用X-膦配体L2 时,伯胺的选择性却显著下降。L2 合成伯胺的选择性较低,却可以方便地用于二/三芳胺的高效合成。Buchwald 团队制备的催化剂在Hartwig 描述的体系中[16]完全不起作用,这表明了实验条件和Pd 源的重要性。与Hartwig 的研究结果一致,反应物浓度也是选择性转化的一个关键因素。

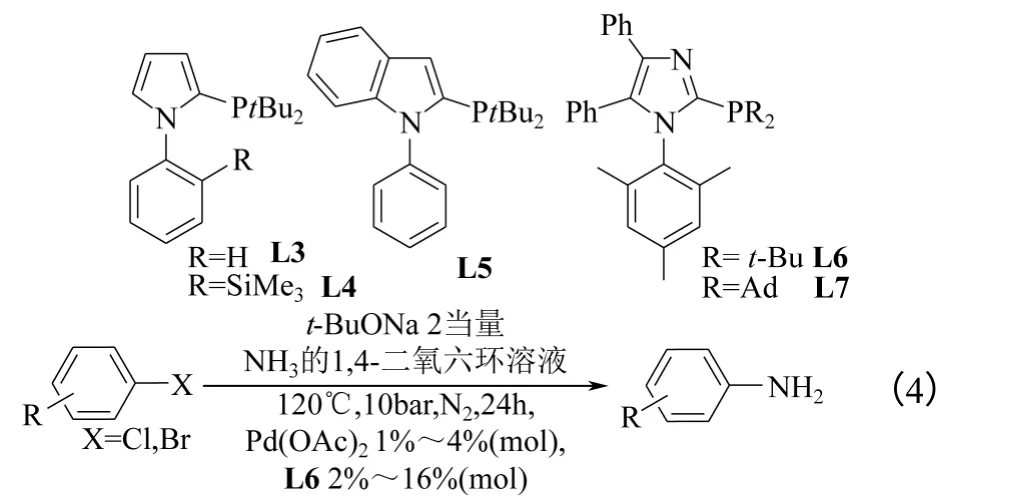
2009年,Beller 等[21]制备了几个用于钯催化卤代芳烃氨解的膦配体(L3~L7),如式(4)所示。研究结果揭示了一些Hartwig 和Buchwald 已经提到过的规律,特别是以t-BuONa 作碱时,反应结果最好。不同氯代芳烃的氨解效率与相应溴代芳烃类似,一些惰性溴代芳烃和杂环芳香族化合物也能以较高收率转化成相应的胺;Pd 源对反应结果几乎没有影响;反应压力也是一个重要的参数,当压力为10bar时,结果最好。
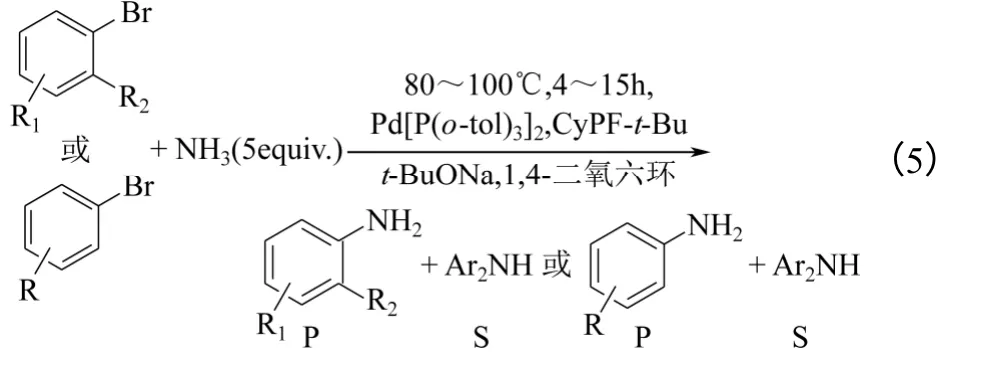
2009年,Hartwig 等[22]将在室温下进行芳基甲苯磺酸酯氨解反应的催化剂用于卤代芳烃与氨的氨解反应。试验结果表明:以Pd(0)配合物制备的催化剂体系优于 Pd(II)配合物体系。事实上,使用Josiphos 配体时,Pd([(P(o-toly)3]2是最好的钯源。
有两组试验条件被分别用于含有邻位取代基和含有间、对位取代基的卤代芳烃,如式(5)所示。在这两种条件下,底物浓度仍然是一个关键参数,使用 Pd([(P(o-toly)3]2催化剂比使用(CyPF-t- Bu)PdCl2为催化剂[16]时获得了更高的伯胺选择性。
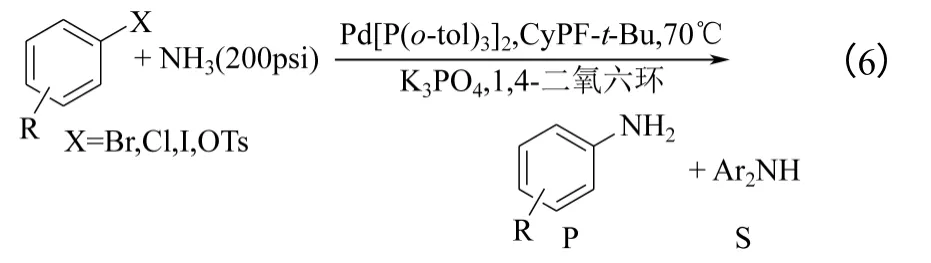
该Pd 催化剂被进一步用于含有对碱敏感官能团的溴代芳烃的氨解反应。以K3PO4为碱,原料4-溴苯甲酸乙酯完全转化,但是却只能获得二苯胺产物。此时,若将NH3的1,4-二氧六环溶液换成氨气(约200psi,1psi=6.895kPa)便解决了这一问题,如式(6)所示。在新的条件下,一些含有对碱敏感官能团的溴代芳烃、氯代芳烃和芳基磺酸盐可以与 氨在70℃和较少催化剂使用量的条件下高效氨解。
尽管上述报道都很成功,但是,钯催化卤代芳烃与氨的氨解反应对富电子的和无空间位阻的卤代芳烃的偶联,以及其他功能性胺存在时的选择性偶联仍然存在不足。此外,对于即使很简单的氯代芳烃底物,为了获得合理的反应活性,大部分已知的催化体系都要求较大的催化剂使用量(0.5%~5%,摩尔分数)和较高的反应温度(70~120℃)。
为了解决这一问题,2010年,Lundgren 等[23]以配体L8(Me-DalPhos)为基础,制备了一系列P,N-配体(L9~L15),如图2 所示。这些配体解决了上述在氨解反应中存在的不足,并且首次报道了[Pd(cinnamyl)Cl]2/L14 催化的氯代芳烃与氨在室温下进行的氨解反应,如式(7)所示。

图2 用于钯催化卤代芳烃氨解反应的P,N-配体

3 卤代芳烃与伯胺的氨解反应
尽管氨是化学合成方面最常见和最广泛的氮源,但是钯催化卤代芳烃与有机胺的氨解反应仍然是合成芳香胺类化合物不可替代的方法。近几年来研究的主要是伯胺、仲胺以及其他一些含氮化合物与卤代芳烃的氨解反应,所研究的配体主要是膦配体。由于叔胺很难与卤代芳烃发生亲核取代反应,目前几乎没有文献报道。
2006年,Hill 等[24]报道了以t-BuONa 为碱,以Pd2(dba)3与二(叔丁基)新戊基膦(DTBNpP)的HBF4盐为催化体系,室温条件下溴代芳烃与苯胺及其衍生物的氨解反应,如式(8)所示。在该催化体系中,不论是富电子的底物,还是缺电子的底物,反应收率均较为接近。
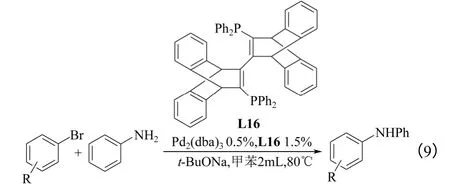
2008年,Doherty 等[25]制备了一种新型配体L16,并将其应用到卤代芳烃与苯胺的氨解反应中,如式(9)所示。反应结果表明:缺电子的底物很快反应完全,而富电子的底物却需要更长的时间才能完成反应。

2008年,Hartwig 的团队[26]报道了使用不同的配体CyPF-t-Bu、Xphos(L2)与Pd 形成的配合物以及配合物L17 催化4-氯甲苯与伯胺的反应,如式(10)所示。对比实验表明:Pd-CyPF-t-Bu 体系通常都具有很长的催化周期,并且对生成单芳香胺具有很高的选择性;Pd(OAc)2-Xphos 体系随着加入量的增加,转化率相应增加,但其生成单芳香胺的选择性却未必提高;Pd(dba)2-Xphos 体系随着加入量的增加,转化率虽然也增加,但其生成单芳香胺的选择性却降低;对于催化体系L17,随着其加入量的增加,反应转化率降低,而且更有利于多芳香胺的生成。

Hartwig 的团队还报道了 Pd(OAc)2和CyPF-t-Bu 形成的体系催化卤代芳烃和伯胺的反应,如式(11)所示。结果表明:直链伯胺反应均较快,而且在催化剂用量很少时也有很高的收率;含有α 位支链伯胺的反应比直链伯胺慢,并且需要使用更多的催化剂。

该体系对氯代芳烃具有较高的催化活性,而对溴代芳烃选择性更高。一般而言,尽管在很多氨解反应中,碘代芳烃的活性比溴代芳烃强,但是碘代芳烃的氨解反应却比溴代芳烃的氨解反应慢,并且收率也要低很多[27]。但是该体系下,碘代芳烃的活性及选择性却高于溴代芳烃,并且碘代芳烃的存在还抑制了溴代芳烃的反应。
4 卤代芳烃与仲胺的氨解反应
2006年,Hill 等[24]报道了以t-BuONa 为碱,以配体DTBNpP 与Pd 形成的配合物催化氯代芳烃、溴代芳烃与仲胺在甲苯中进行的氨解反应,如式(12)所示。
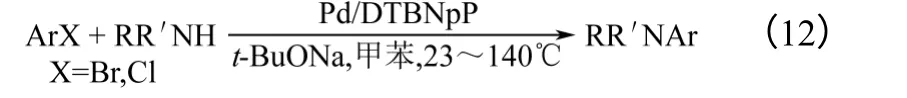
研究表明:DTBNpP 能有效促进卤代芳烃与仲胺的氨解反应,而且能够活化溴代芳烃的氨解。在室温下,DTBNpP 的HBF4盐与Pd2(dba)3作为催化体系时,溴代芳烃和芳香仲胺衍生物的氨解反应,如式(13)所示。

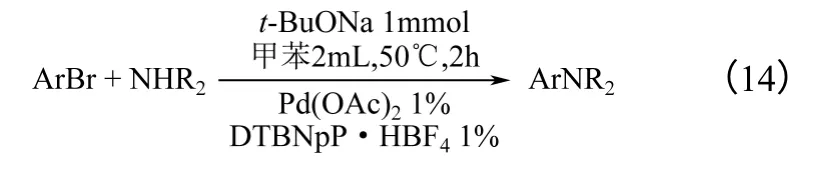
50℃,DTBNpP·HBF4/Pd(OAc)2催化溴代芳烃和仲胺的氨解反应,如式(14)所示。
50~140℃,Pd/ DTBNpP·HBF4催化氯代芳烃和仲胺的氨解反应,如式(15)所示。

结果表明:DTBNpP 与Pd 形成的体系在室温下对溴代芳烃与仲胺的氨解反应具有很高的催化活性,但对氯代芳烃与仲胺的氨解反应则需提高温度才能增大催化活性。
2008年,Hartwig 的团队[26]报道了以Pd(OAc)2和CyPF-t-Bu 形成的体系催化氯或溴代芳烃与仲胺的氨解反应,如式(16)所示。

结果表明:氯代芳烃与仲胺反应较慢,且收率低,而溴代芳烃的反应速率和收率都要高些,这与Hill 等[24]的研究结论一致。
同年,Hartwig[6]还报道了以六甲基二硅胺锂盐(LiHMDS)为碱,用CyPF-t-Bu 配体与Pd(OAc)2催化氯代芳烃与仲胺的反应。该方法对含有各种取代基的底物均具有较高的收率,如式(17)所示。

2009年,Porzelle 等[28]报道了运用配体5-二叔丁基膦-1′,5′-二苯基-1′H-[1,4′]-二吡唑(L18)与Pd 形成的配合物催化卤代芳烃与仲胺的反应,如式(18)所示。

结果表明,氯、溴和碘代芳烃都能发生氨解反应;含有邻位取代基的底物的氨解反应比较困难,但是只要升温至100℃,也能够得到目标产物。
5 卤代芳烃与其他含氮化合物的氨解反应
钯催化卤代芳烃的氨解反应使用的氨解剂除了上述无机氨和有机胺以外,还可以是其他含氮化 合物。
2001年 Hartwig 的团队[29]报道了一种以Pd(dba)2/P(t-Bu)3为催化剂,以LiN(SiMe3)2为氨替代物合成芳香伯胺的方法。同年,Buchwald 的团 队[30]也报道了一种类似的反应。但是,当LiN(SiMe3)2用于一系列卤代芳烃的氨解反应时,反应试剂较强的碱性却阻止了含有对碱敏感官能团或烯醇化氢的卤代芳烃的氨解。
为了解决这一问题,2005年,Hartwig 的团队[8]制备了一种温和的、用于钯催化卤代芳烃氨解的氨代替物Zn[N(SiMe3)2]2(六甲基硅胺基锌),如式(19)。

该条件下,在LiN(SiMe3)2体系中不反应的含有氰基和硝基的溴代芳烃的氨解反应也能发生。但该体系一般要求更高的催化剂浓度或更长的反应时间。幸运的是,室温时LiN(SiMe3)2/ZnCl2体系中进行的氨解反应比只使用Zn[N(SiMe3)2]2催化剂用量少,如式(20)所示。LiN(SiMe3)2/ZnCl2体系中一系列含对碱敏感官能团的卤代芳烃也能转化成相应的胺。因为该体系的THF 溶液很容易在市场上买到,所以这类反应很容易实现。

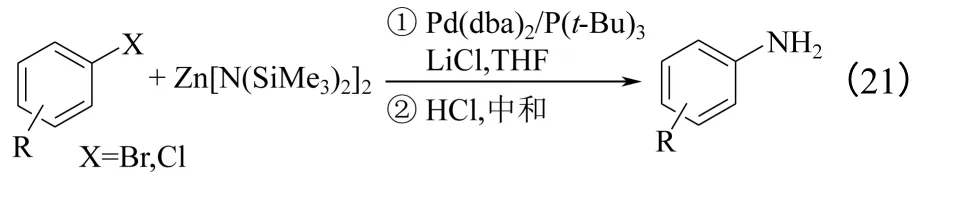
溴代芳烃与Zn[N(SiMe3)2]2/LiCl 的反应如式(21)所示。以Pd(dba)2/P(t-Bu)3为催化剂,反应收率较高,而且与LiN(SiMe3)2相比,该体系用于含有对碱敏感官能团的卤代芳烃底物的氨解也可以获得较高的收率。
6 结 语
在过去的几十年里,钯催化卤代芳烃的氨解反应已经广泛应用于芳香胺的生产。经过化学工作者多年的探索与研究,这类反应已经日臻完善,不仅反应所需的催化剂量更少、反应条件更温和、应用范围更广、操作更简单,而且这类反应作为一类通用方法,还是绿色和可持续发展的关键技术之一。
尽管近年来该领域研究已经取得了显著的进展,但是高活性和高选择性的催化剂依然有限,氨作为氨解剂和低廉的氯代芳烃作为氨解底物的使用都还不够广泛。寻找新的配体、设计新的催化体系、提高反应选择性和改善反应对敏感官能团的容忍性是其可能的改善途径。另外,仔细研究反应机理将会加深对反应的理解。
[1] Schlummer B,Scholz U. Palladium-catalyzed C—N and C—O coupling:A practical guide from an industrial vantage point[J]. Adv. Synth. Catal.,2004,346:1599.
[2] 刘蒲,李三华,李利民,等. 钯催化卤代芳烃的胺化反应研究[J]. 化工进展,2005,24(2):286-292.
[3] 郭跃平,应向贤,赵冉冉,等. 酶法制备手性芳香胺化合物的研究进展[J]. 化工进展,2010,29(4):728-732.
[4] Downing R S,Kunkeler P J,Bekkum H V. Catalytic syntheses ofaromatic amines[J]. Catal.Today,1997,37:121-136.
[5] Surry D S , Buchwald S L. Biaryl phosphane ligands in palladium-catalyzed amination[J]. Angew. Chem. Int. Ed.,2008,47:6338-6361.
[6] Hartwig J F. Evolution of a fourth generation catalyst for the amination and thioetherification of aryl halides[J]. Acc. Chem. Res.,2008,41:1534-1544.
[7] Charles M D,Schultz P,Buchwald S L. Efficient Pd-catalyzed amination of heteroaryl halides[J]. Org. Lett.,2005,7(18):3965-3968.
[8] Lee D Y,Hartwig J F. Zinc trimethylsilylamide as a mild ammonia equivalent and base for the amination of aryl halides and triflates[J]. Org. Lett.,2005,7(6):1169-1172.
[9] Lundgren R J,Peters B D,Alsabeh P G,et al. A P,N-ligand for palladium-catalyzed ammonia arylation:Coupling of deactivated aryl chlorides , chemoselective arylations , and room temperature reactions[J]. Angew. Chem. Int. Ed.,2010,49:4071-4074.
[10] Kosugi M,Kameyama M,Migita T. Palladium-catalyzed aromatic amination of aryl bromides with N,N-diethylamin-otributyltin[J]. Chem. Lett.,1983(6):927-928.
[11] Paul F,Patt J,Hartwig J F. Palladium-catalyzed formation of carbon-nitrogen bonds : Reaction intermediates and catalyst improvements in the hetero cross-coupling of aryl halides and tin amides[J]. J. Am.Chem. Soc.,1994,116:5969-5970.
[12] Guram A S,Buchwald S L. Palladium-catalyzed aromatic aminations with in situ generated aminostannanes[J]. J. Am. Chem. Soc.,1994,116:7901-7902.
[13] Guram A S,Rennels R A,Buchwald S L. A simple catalytic method for the conversion of aryl bromides to arylamines[J]. Angew. Chem. Int. Ed.,1995,34:1348-1350.
[14] Louie J,Hartwig J F. Palladium-catalyzed synthesis of arylamines from aryl halides. Mechanistic studies lead to coupling in the absence of tin reagents[J]. Tetrahedron Lett.,1995,36:3609-3612.
[15] 胡跃飞,林国强. 现代有机反应:金属催化反应[M]. 北京:化学工业出版社,2008.
[16] Shen Q,Hartwig J F. Palladium-catalyzed coupling of ammonia and lithium amide with aryl halides[J]. J. Am. Chem. Soc.,2006,128:10028-10029.
[17] Shekhar S,Ryberg P,Hartwig J F,et al. Reevaluation of the mechanism of the amination of aryl halides catalyzed by binap-ligated palladium complexes[J]. J. Am. Chem. Soc.,2006,128: 3584-3591.
[18] Alvaro E,Hartwig J F. Resting state and elementary steps of the coupling of aryl halides with thiols catalyzed by alkylbisphosphine complexes of palladium[J]. J. Am. Chem. Soc.,2009,131:7858-7868.
[19] Pouy M J,Stanley L M,Hartwig J F. Enantioselective,iridium-catalyzed monoallylation of ammonia[J]. J. Am. Chem. Soc.,2009,131:11312-11313.
[20] Surry D S,Buchwald S L. Selective palladium-catalyzed arylation of ammonia:Synthesis of anilines as well as symmetrical and unsymmetrical di- and triarylamines[J]. J. Am. Chem. Soc.,2007,129:10354-10355.
[21] Schulz T,Torborg C,Enthaler S,et al. A general palladium-catalyzed amination of aryl halides with ammonia[J]. Chem. Eur. J.,2009,15(18):4528-4533.
[22] Vo G D,Hartwig J F. Palladium-catalyzed coupling of ammonia with aryl chlorides,bromides,iodides,and sulfonates:A general method for the preparation of primary arylamines[J]. J. Am. Chem. Soc.,2009,131:11049-11061.
[23] Lundgren R J,Peters B D,Alsabeh P G,et al. A P,N-ligand for palladium-catalyzed ammonia arylation:Coupling of deactivated aryl chlorides , chemoselective arylations , and room temperature reactions[J]. Angew. Chem. Int. Ed.,2010,49:4071-4074.
[24] Hill L L,Moore L R,Huang R,et al. Bulky alkylphosphines with neopentyl substituents as ligands in the amination of aryl bromides and chlorides[J]. J. Org. Chem.,2006,71:5117-5125.
[25] Doherty S,Knight J G,Smyth C H,et al. Biaryl-like catphos diphosphines via double Diels-Alder cycloaddition between 1,4-bis(diphenylphosphinoyl)buta-1,3-diyne and anthracenes :Efficient ligands for the palladium-catalyzed amination of aromatic bromides and α-arylation of ketones[J]. Organometallics,2008,27(8):1679-1682.
[26] Shen Q,Ogata T,Hartwig J F. Highly reactive,general and long-lived catalysts for palladium-catalyzed amination of heteroaryl and aryl chlorides,bromides,and iodides:Scope and structure-activity relationships[J]. J. Am. Chem. Soc.,2008,130:6586-6596.
[27] Urgaonkar S,Nagarajan M,Verkade J G. P(i-BuNCH2CH2)3N:An effective ligand in the palladium-catalyzed amination of aryl bromides and iodides[J]. J. Org. Chem.,2003,68:452-459.
[28] Porzelle A,Woodrow M D,Tomkinson N C O. Palladium-catalyzed coupling of hydroxylamines with aryl bromides,chlorides,and iodides[J]. Org. Lett.,2009,11(1) :233-236.
[29] Lee S,Jørgensen M,Hartwig J F. Palladium-catalyzed synthesis of arylamines from aryl halides and lithium bis(trimethylsilyl)amide as an ammonia equivalent[J]. Org. Lett.,2001,3(17) :2729-2732.
[30] Huang X,Buchwald S L. New ammonia equivalents for the pd-catalyzed amination of aryl halides[J]. Org. Lett.,2001,3(21):3417-3419.

