CNTF、LIF在腺样囊性癌的表达及临床意义
李雷激 向兰 覃纲 祝琳 张迪
CNTF、LIF在腺样囊性癌的表达及临床意义
李雷激 向兰 覃纲 祝琳 张迪
目的 检测睫状神经营养因子(ciliary neurotrophic factors,CNTF),白血病抑制因子(leukemia inhibitor factor,LIF)在腺样囊性癌(adenoid cystic carcinoma,ACC)组织中的表达,探讨CNTF、LIF在ACC发生发展及嗜神经侵袭(perineural invasion,PNI)转移等临床病理特征间的关系。方法 采用免疫组化Envision法对CNTF、LIF在60例ACC组织及20例癌旁正常组织中的表达进行检测,结合患者临床病理资料,分析它们的表达与患者临床病理参数间的关系。结果 CNTF、LIF在癌旁正常组织中低表达,在ACC组织中呈高表达,CNTF在不同病理类型及T分期,是否有嗜神经侵袭、转移复发间差异有统计学意义(P<0.05),LIF在是否有嗜神经侵袭、转移复发间差异有统计学意义(P<0.05),CNTF、LIF在ACC中的表达呈显著正相关(P<0.05)。结论 CNTF、LIF与ACC的发生相关,并且与ACC的恶性进展关系密切,可作为判断ACC预后的生物学指标。
睫状神经营养因子;白血病抑制因子;腺样囊性癌
腺样囊性癌(adenoid cystic carcinoma,ACC)是好发于口腔颌面部大小涎腺的恶性程度较高的肿瘤,约占头颈肿瘤的2%~4%,涎腺恶性肿瘤的15%~25%[1]。该肿瘤起病隐匿,生长缓慢,常无麻木疼痛等自觉症状,瘤体无包膜,它有神经侵犯、易复发、远处转移倾向较强、对放化疗均不敏感的生物学特性,给临床治疗和判断预后带来了较大困难。ACC的发生发展及特殊的生物学特性与多因素有关,其形成机制还不十分明确。本研究采用免疫组化Envision法对CNTF、LIF在60例ACC组织及20例癌旁正常组织中的表达进行检测,并对这些患者的临床病理资料进行统计学分析,探讨CNTF、LIF在ACC中的表达及与其他侵袭转移相关因素之间的联系。
1 资料与方法
1.1 一般资料 选择2004年1月~2009年1月泸州医学院附属医院收治的病理诊断明确、临床资料完整的头颈部ACC患者肿瘤组织标本60例,男23例,女37例,年龄23~73岁,中位年龄55岁。按2005年WHO涎腺肿瘤组织病理学分类标准,对60例ACC进行病理分类,其中腺管型47例,实体型13例。根据术中所见以及术后病理检查所示的肿瘤的浸润程度,按照UICC(2002)头颈部肿瘤TNM分期标准对60例标本进行T分期,其中T119例、T215例、T313例、T413例,将T1、T2期列为早期组,T3、T4期列为晚期组。依据患者临床表现有无疼痛、麻木、面瘫等神经症状及镜下观察到的肿瘤细胞包绕神经或有神经束浸润划分为有、无神经侵袭症状组,有嗜神经侵袭组19例,无嗜神经侵袭组41例。依据患者术后情况,划分为术后有、无复发及转移组,有复发组13例,无复发47例,有转移12例,无转移48例。
1.2 主要试剂 CNTF、LIF多克隆抗体购自博奥森生物试剂公司,Envision二抗购自丹麦DAKO公司,DAB显色试剂盒购自北京中杉生物技术有限公司。
1.3 实验方法 以20例癌旁正常组织作正常对照,用已知阳性切片作阳性对照,PBS液代替一抗作阴性对照与实验组切片在同条件下进行免疫组化染色。具体步骤严格按照说明书进行。
1.4 结果判断 采用德国莱卡病理图像采集系统进行图像采集,CNTF、LIF的阳性反应定位以胞质或胞膜着色呈棕黄色颗粒者为阳性细胞,使用Image Pro Plus 6.0图像分析软件对CNTF、LIF表达情况进行半定量分析,测定每个视野下阳性反应面积(Sum Area)、累积光密度(Sum IOD),计算每张照片中阳性反应区域的平均光密度(MOD=Sum IOD/Sum Area),取5张照片MOD的平均值作为该例标本CNTF、LIF表达的相对量,切片阳性区表达的强弱与光密度值呈正相关,光密度值大则阳性表达强,反之亦然。
1.5 统计学方法 运用SPSS17.0 for windows进行统计学分析,各组MOD值用“x±s”表示,经正态性检验确定符合正态分布后分别对不同组间CNTF、LIF表达MOD值比较应用两独立样本的t检验(方差齐),t’检验(方差不齐);两指标间的相关性分析应用Pearson相关性分析法进行分析;以α=0.05为检验水准,当P<0.05为差异存在统计学意义。
2 结果
2.1 CNTF在ACC组织中的表达 CNTF蛋白主要定位于肿瘤细胞胞浆及部分胞膜,极少胞核上也可见阳性表达,在正常涎腺组织中腺泡细胞无阳性表达,阳性染色颗粒相对低表达于导管上皮细胞。见图1、图2。ACC组织中CNTF表达的MOD值为(0.0740±0.0398);正常组织组中的值为(0.0139±0.0064),差异有统计学意义(t=6.700,P=0.000),CNTF在ACC的表达明显强于癌旁正常组织。实体型组织表达的MOD值为(0.1052±0.0404),腺管型表达的MOD值为
(0.0654±0.0357),实性型染色强度高于腺管型者(P<0.05)。有PNI的ACC组织中CNTF表达MOD值(0.0932±0.0423),无PNI的ACC组织中表达值为(0.0651±0.0357),差异有统计学意义(t=2.668,P=0.01)。见图3、图4。CNTF在有PNI组织的表达强于无PNI组织。有无转移ACC组织CNTF表达的MOD值分别为(0.0962±0.0344)、(0.0685±0.0394),差异有统计学意义(t=2.231,P=0.030);CNTF在有转移的组织中的表达较无转移组织强。见图5、图6。T1-2、T3-4的MOD值分别为(0.0625±0.0389)、(0.0890±0.0364),有无复发的ACC组织MOD值分别为(0.0944±0.0398)、(0.0684±0.0383),差异有统计学意义(P<0.05)。见表1。

图1 癌旁正常组织中CNTF仅在腺管上皮胞浆着色(400×)Fig.1 Expression of CNTF in normal tissue near the ACC,the gland epithelium staining only

图2 ACC中CNTF弥漫性阳性表达(400×)Fig.2 CNTF expression were prevalent in ACC tissues

图3 PNI 组织中CNTF强阳性表达(400×)Fig.3 Higher expression of CNTF in ACC with PNI

图4 无PNI组织中CNTF弱阳性表达,(400×)Fig.4 Lower expression of CNTF in ACC without PNI
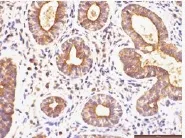
图5 转移ACC组织中CNTF阳性表达(400×)Fig.5 Higher expression of CNTF in ACC with metastasis
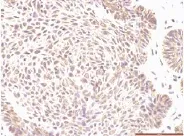
图6 无转移ACC组织中CNTF弱阳性表达(400×)Fig.6 Lower expression of CNTF in ACC without metastasis
2.2 LIF在ACC组织中的表达 LIF在癌旁正常组织中的表达呈阴性或者弱阳性,在ACC组织中LIF弥散分布在肿瘤细胞胞质及部分胞膜。见图7、图8。ACC组织中LIF表达的MOD值为(0.0415±0.0202);正常组织组中的MOD值为(0.0102±0.0053),差异有统计学意义(t'=10.935,P=0.000),LIF在ACC组织中表达强于正常组织,实体型和腺管型中MOD值为(0.0431±0.0216)、(0.0411±0.0200),有PNI的组织中LIF表达MOD值为(0.0512±0.0198),无PNI的ACC组织中LIF表达MOD值为(0.0370±0.0190),差异有统计学意义(t=2.654,P=0.01)。见图9、图10。LIF在有PNI组织中的表达强于无PNI组织,转移与否的LIF表达也存在显著差异。见图11、图12。在转移和无转移的ACC组织中MOD值分别为(0.0533±0.0181)、(0.0386±0.0198),差异有统计学意义(t=2.350,P=0.022),LIF在有转移的组织的表达强于无转移组织,T1-2、T3-4的MOD值为(0.0399±0.0201)、(0.0436±0.0206),差异无统计学意义,有无复发的MOD值为(0.0581±0.0182)、(0.0369±0.0184),差异有统计学意义(P<0.05)。见表2。

表1 CNTF的表达的MOD值及统计情况(x±s)
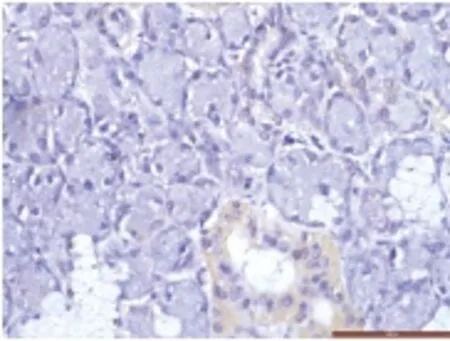
图7 癌旁正常组织中LIF几乎不表达或仅在腺管上皮轻度着色(400×)Fig.7 LIF is rarely expressed in normal tissue near the ACC or only be expressed in the gland epithelium softly

图8 ACC中LIF弥漫性阳性表达于癌细胞胞浆(400×)Fig.8 LIF expression were prevalent in ACC tissues,cytoplasm and staining
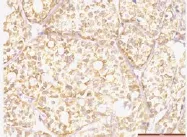
图9 PNI组织中LIF阳性表达(400×)Fig.9 Higher expression of LIF inACC with PNI
图10 无PNI组织中LIF弱阳性表达(400×)Fig.10 Lower expression of LIF in ACC without PNI
2.3 CNTF、LIF在ACC表达的相关性分析 对CNTF与LIF的表达值作Pearson相关分析(r=0.703,P=0.000),CNTF与LIF在ACC表达的MOD值呈显著正相关关系。

图11 转移ACC组织中LIF阳性表达(400×)Fig.11 Higher expression of LIF in ACC with metastasis

图12 无转移ACC组织中LIF弱阳性表达(400×)Fig.12 Lower expression of LIF in ACC without metastasis
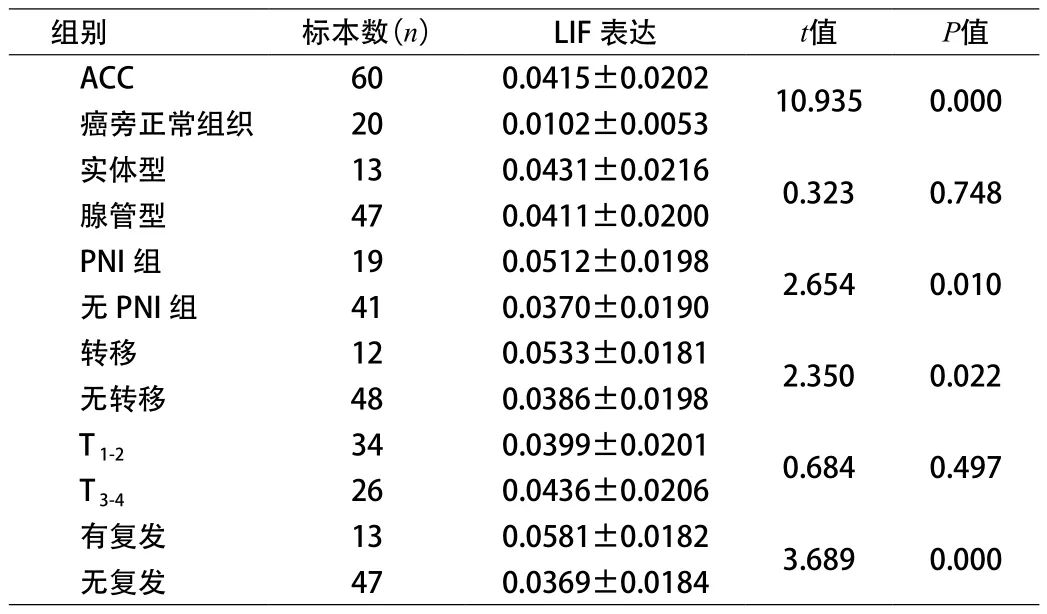
表2 LIF的表达的MOD值及统计情况
3 讨论
ACC是一类恶性程度较高的肿瘤,早期多以无痛性光滑的圆形或结节状包块为表现,边界不清,活动差,患者可长时间带瘤生存,可数月、数年甚至数十年,当出现骨转移或者PNI时可出现疼痛麻木等表现[2]。它的发生与恶性进展与相关的细胞产生神经营养因子、细胞因子等多因素有关。
在ACC及其PNI的发生过程中,神经组织和肿瘤细胞之间的相互影响、相互吸引具有重要意义,它们的相互作用需要作为非神经源性肿瘤和神经组织之间的桥梁[3]——神经营养因子家族(neurotrophic factors,NTFs)的作用。CNTF是NTFs的一员,最初是从鸡胚眼球脉络膜、睫状体和虹膜,随后自成年大鼠及兔坐骨神经中分离提取的分子量为20~40kD的酸性蛋白质[4-5],具有多种生物活性,不仅能促进多种神经元的存活,在神经系统发育、分化和损伤修复中具有重要意义[6],还参与肿瘤生长和分化的调控[7-9]。
胡欣等研究CNTF以及CNTFR系统对于肝癌细胞增殖方面的影响,并通过实验发现CNTF能够在细胞周期方面发挥作用,能够帮助细胞从细胞周期的G2/M期阻滞中恢复过来,对肝癌细胞的增殖起到正向促进作用。有学者指出当神经组织结构受到破坏、神经元被激活时,可刺激大量存在于外周神经雪旺细胞中的CNTF释放进入细胞间隙,经轴突逆向转运到胞体单独起作用或与组织中存在的可溶性CNTF受体形成复合物等多种方式而发挥促进神经损伤修复的作用[10]。本实验观察到CNTF在ACC癌细胞中呈阳性表达,在分化程度较低的实体型、有PNI、转移组的表达显著高于分化程度相对较高的腺管型、无PNI及转移组,有复发、T分期晚期的组织中CNTF表达显著高于无复发及T分期早期的组织,即ACC恶性程度越高CNTF表达越高,由此可以初步推测通过检测CNTF的表达对ACC患者的恶性程度进行评估,进一步制定合理的治疗方案。
LIF是一种能使M1白血病细胞系向正常细胞分化的细胞因子,是一种分泌性蛋白,由细胞在胞浆内合成并分泌至细胞外而发挥其生物学作用。作为IL-6细胞因子超家族中的一种多效性细胞因子,可在多种组织和细胞表达且作用于不同细胞而发挥多种生物学作用,广泛调节细胞的生长、增殖和分化[11]。研究发现,LIF可通过触发Jak/Stat3信号通路中Stat3活化,调节适当的基因改变引起典型的肿瘤干细胞行为,经mTORC1/ p70S6K信号途径抑制基因凋亡,促进癌细胞增值等方式促进绒毛膜上皮癌、黑色素瘤,鼻咽癌的增殖生长[12-14],却通过LIF/ JAK/STAT途径使细胞周期被抑止在G0/G1期,从而有效抑制细胞分化增殖,抑制宫颈癌病毒原癌基因的表达在甲状腺髓样癌、宫颈癌的增殖生长显示出抑制作用[15-16],而有关LIF在ACC发生发展中的作用却少有研究。本研究通过免疫组化法检测了LIF在头颈部ACC中的表达,发现LIF在ACC中的表达增高,在有PNI、转移、复发的ACC组织中的表达显著高于无PNI、转移、复发的组织,因而推测LIF在头颈ACC发生发展、侵袭转移过程中发挥促进作用,如果研究出抑制LIF的表达的方法,便可能对阻止ACC的恶性进展及侵袭转移起重要作用。另外,本研究还表明,在ACC组织中CNTF与LIF表达呈正相关,提示二者在ACC的发生发展中具有协同作用,具体机制有待进一步研究。
[1] Ellington CL,Goodman M,Kono SA,et al.Adenoid cystic carcinoma of the head and neck:Incidence and survival trends based on 1973-2007 Surveillance,Epidemiology,and End Results data[J]. Cancer,2012,118(18):4444-4451.
[2] Zhao C,Liu JZ,Wang SB,et al.Adenoid cystic carcinoma in the maxillary gingiva:a case report and immunohistochemical study[J].Cancer Biol Med,2013,10(1):52-54.
[3] Nakagawara A.Trk receptor tymsine kinases:a bridge between CanCer and neural development[J].Cancer Lett,2001,169(2):107-114.
[4] Adler R,Varon S.Neuronal survival in intact ciliary ganglia in vivo and in vitro:ciliary neuronotrophic factor as a target surrogate[J].Dev Biol,1982,92(2):470-475.
[5] Barbin G,Manthorpe M,Varon S.Purification of the chick eye ciliary neuronotrophic factor[J].J Neurochem,1984,43(5):1468-1478.
[6] Febbraio MA.gp130 receptor ligands as potential therapeutic targets for obesity[J].J Clin Invest,2007,117(4):841-849.
[7] Rao MS,Symes A,Malik N,et al.Oncostatin M regulates VIP expression in a human neuroblastoma cell line[J].Neuroreport,1992,3(10):865-868.
[8] Schwarzschild MA,Dauer WT,Lewis SE,et al.Leukemia inhibitory factor and ciliary neurotrophic factor increase activated Ras in a neuroblastoma cell line and in sympathetic neuron cultures[J].J Neurochem,1994,63(4):1246-1254.
[9] Louis JC,Magal E,Takayama S,et al.CNTF protection of oligodendrocytes against natural and tumor necrosis factor-induced death[J]. Science,1993,259(5095):689-692.
[10] Davis S,Aldrich TH,Ip NY,et al.Released form of CNTF receptor alpha component as a soluble mediator of CNTF responses[J].Scien ce,1993,259(5102):1736-1739.
[11] Metcalf D.The leukemia inhibitory factor (LIF)[J].Int J Cell Cloning,1991,9(2):95-108.
[12] Fitzgerald JS,Tsareva SA,Poehlmann TG,et al.Leukemia inhibitory factor triggers activation of signal transducer and activator of transcription3,p roliferation,invasiveness,and altered protease expression in choriocarcinomacells[J].Int J Biochem Cell Biol,2005,37(11):2284-2296.
[13] Kuphal S,Wallner S,Bosserhoff AK.Impact of LIF (leukemia inhibitory factor) expression in malignant melanoma[J].Exp Mol Pathol,2013,95(2):156-165.
[14] Liu SC,Tsang NM,Chiang WC,et al.Leukemia inhibitory factor promotes nasopharyngeal carcinoma progression and radioresistance[J].J Clin Invest,2013,123(12):5269-5283.
[15] Arthan D,Hong SK,Park JI.Leukemia inhibitory factor can mediate Ras/ Raf/MEK/ERK-induced growth inhibitory signaling in medullary thyroid cancer cells[J].Cancer Lett,2010,297(1):31-41.
[16] Bay JM,Patterson BK,Teng NN.Leukemia inhibitory factor downregulates human papillomavirus-16 oncogene expression and inhibits the proliferation of cervical carcinoma cells[J].Infect Dis Obstet Gynecol,2011,2011:463081.
Objective To detect the expression of Ciliary neurotrophic factors(CNTF)and leukemia inhibitor factor(LIF) in adenoid cystic carcinoma (ACC) tissues and normal tissues near the ACC, then investigate their relevance with oncogenesis and development of the ACC and with its clinical pathological features such as perineural invasion(PNI) and metastasis. Methods Immunohistochemistry Envision method was employed to detected the expression of CNTF and LIF in the 60 ACC tissues and 20 normal tissues near the ACC. Combined with patients’ clinical information, the relationship between the CNTF and LIF expression and clinicopathological parameter was analyzed. Results CNTF and LIF were lower expressed in normal tissues while over expressed in ACC tissues.There were significant difference of CNTF expression in different pathological classification, T stage, and in the cases whether they had PNI, recurrence and metastasis or not, while there were significant difference of LIF expression in specimens whether in PNI, recurrence and metastasis or not .The expression of CNTF and LIF in the tissues of ACC was positive related. Conclusion CNTF and LIF expression are related with ACC oncogenesis and development, and they were closely associated with ACC’s malignant progress. We expect that they may provide effective biological evidence for diagnosing and treating ACC.
Ciliary neurotrophic factors; Leukemia inhibitor factor; Adenoid cystic carcinoma
10.3969/j.issn.1009-4393.2015.23.001
四川 646000 泸州医学院附属医院耳鼻咽喉头颈外科 (李雷激向兰 覃纲 祝琳 张迪)
李雷激 E-mail:lileiji0301@163.com

