ICU多重耐药鲍曼不动杆菌的同源性分析
林云万 梁颖茹 贺 征 李 燕 张 旭 魏跃红
由于广谱抗菌药物的广泛使用及侵入性治疗技术的不断开展,鲍曼不动杆菌近年来成为我国引起院内感染的重要多重耐药菌,被称为革兰氏阴性杆菌中的“MRSA”,尤其在重症监护室(ICU)的检出率呈现逐年升高的趋势。本实验通过PFGE方法对某院ICU分离的11株MDRAB进行同源性分析,旨在了解MDRAB医院内感染的分子机制,明确感染源头及感染途径,为尽早发现及控制医院感染和临床防治提供依据。
1 材料与方法
1.1 材料
1.1.1 菌株来源 分离自某院ICU 5床和8床感染患者痰标本2株,同期ICU环境中的床栏、记录台、仪器按钮、电脑键盘、门把手和医务人员手样本分离出9株。
1.1.2 主要试剂 VITEK2-COMPACT全自动微生物生化分析系统细菌鉴定卡及AST-GN09药敏卡,药敏卡包括氨苄西林、氨苄西林/舒巴坦、哌拉西林等19种临床常用抗生素;PFGE使用胶为BIO-RAD公司的琼脂糖胶;Tris、EDTA等生化试剂为上海生工生物工程技术服务有限公司产品。
1.1.3 主要仪器 VITEK2-COMPACT全自动微生物分析系统;Bio-rad CHEF Map-perTM脉冲场凝胶电泳仪、Bio-rad紫外线投射凝胶成像系统。
1.2 方法
1.2.1 细菌鉴定和药敏试验 使用VITEK2-COMPACT全自动微生物生化分析系统进行细菌鉴定及抗菌药物敏感试验(MIC法),以大肠埃希菌ATCC25922、铜绿假单胞菌ATCC27853为标准进行质量控制,药物敏感试验结果按CLSL2012标准判定[1]。
1.2.2 脉冲场凝胶电泳(PFGE) 将培养过夜的纯菌落配制成细菌悬浮液,用低熔点琼脂胶进行包被,蛋白酶K消化24 h。限制性内切酶ApaI37℃酶切24 h。用0.5×TBE缓冲液配制1%SeaKem Gold琼脂糖胶,加热溶解后冷却至55℃,缓缓倒入模具中,放置30 min。电泳条件设置:电压6V/cm,脉冲参数5~20 s,温度14℃,夹角120°,电泳时间20 h。电流结束,EB染色后成像。PFGE结果判读按美国疾病控制和预防中心TENOVER等[2]推荐的方法判读,酶切后图谱完全一致定为同一型,有1~3个条带不同者为同一型的不同亚型,差异3个条带以上者为另一型。
2 结果
2.1 药敏试验结果
11株MDRAB对临床常用抗菌药物的耐药性严重,对左氟沙星的耐药率最低(54.5%),其次为哌拉西林/他唑巴坦(81.8%),对其他17种抗菌药物的耐药率均很高(90.9% ~100%),见表1。
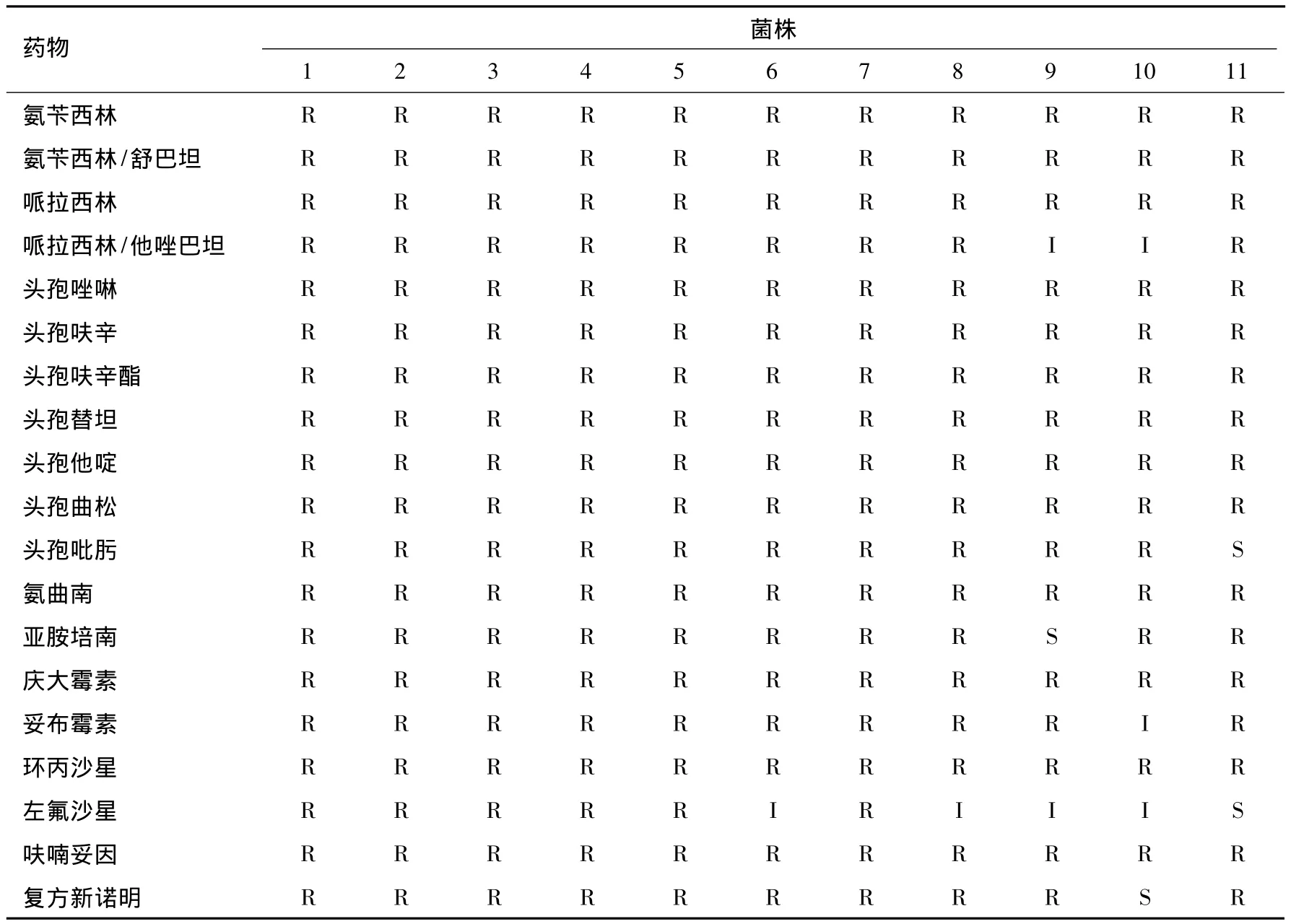
表1 多重耐药鲍曼不动杆菌对19种抗菌药物的耐药情况
数字1~10分别代表5床患者、5床床栏、5床仪器按钮、8床患者、8床床栏、12床记录台、移动推车、某护士手、公用电脑鼠标、门把手、10床记录台分离的MDRAB。
2.2 PFGE同源性分析
采用PFGE对11株MDRAB进行同源性分析的结果显示,共分4个PFGE型,分别命名为A~D。其中A型包括5床感染患者、5床床栏、5床仪器按钮、8床感染患者、8床床栏、12床记录台、移动推车和某护士手分离株;公用电脑鼠标分离株为B型;门把手分离株为C型;10床记录台分离株为D型。见图1。

图1 多重耐药鲍曼不动杆菌PFGE分型图谱
3 讨论
鲍曼不动杆菌由BEIJERINCK于1911年发现后,直到上世纪70年代,对绝大多数抗菌药物都敏感,随着临床上广谱抗生素的滥用和抗生素选择性压力的不断增加,鲍曼不动杆菌耐药情况日趋严重。11株MDRAB对临床常用抗菌药物的耐药性严重,对青霉素类、头孢菌素类、碳青霉烯类、氨基糖苷类、呋喃类耐药率很高,绝大部分达到100%,达到一个很高的水平。鲍曼不动杆菌耐药谱非常广泛,具有多种耐药机制:①产生多种β-内酰胺酶,使β-内酰胺药物失去活性而耐药。②细胞膜孔蛋白缺失、主动外排系统编码基因缺失,导致鲍曼不动杆菌细胞内药物浓度不足而耐药。③可同时产生多种耐药质粒,导致对多种类型的抗菌药物表现交叉耐药和多药耐药的特点。④整合子的基因传播能力、主动外排机制介导以及细菌生物膜对抗菌药物的阻挡也是MDRAB多药耐药性的重要原因[3-6]。正是由于鲍曼不动杆菌具有上列耐药机制,使其形成多重耐药且耐药性快速上升的原因所在,同时,也由于耐药株更适应于在抗生素广泛使用环境下的选择性生存,多重耐药甚至泛耐药菌株分离率不断上升,容易导致医院感染的暴发和流行。
MDRAB因其对抗菌药物的高度耐药常常导致临床抗感染治疗的失败,MDRAB的水平传播给医院的感染控制工作带来挑战[7]。2009~2010 年中国 CHINET 细菌耐药监测资料[8-9]显示:鲍曼不动杆菌院内感染已列第4位,成为仅次于铜绿假单胞菌的重要非发酵菌。因此,分析MDRAB的分子流行特征,检测不同菌株间的同源相关性,对了解感染的源头,探寻MDRAB在医院内的水平传播途径以及控制多重耐药菌株的播散具有重要意义。PFGE以其重复性好,分辨力强而被誉为细菌分子生物学分型技术的“金标准”。本研究采用PFGE技术对11株MDRAB进行基因分型,共分4个型,命名为A~D型。其中A型有8株菌,包括5床患者及床单元内的床栏和仪器按钮、8床患者及床栏、12床记录台、移动推车、某护士手。从PFGE结果可知,5床患者与8床患者为同一基因型,结合临床资料,8床患者为ICU长期住院病人,并感染有MDRAB,5床患者后入院并于一段时间后发生MDRAB院内感染,同时,两株菌对19种常用抗生素的耐药表型完全一致,皆为耐药,依此可判断,5床患者与8床患者为同一株MDRAB引起的交叉感染,该院ICU存在A型克隆株的播散流行;ICU环境存在A型MDRAB的广泛定值,特别是感染患者的床单元内物品,诸如床栏、仪器按钮等定值情况最为严重,同时ICU也存在B型、C型和D型菌株的定值;某护士手中分离出A型菌株,环境中MDRAB定值最广泛的地方皆为手接触频繁的物品,说明手的接触传播在该菌的流行中起着不可忽视的作用,正因为手的传播作用,克隆株进一步在环境中扩散定值,并引起院内感染的发生,8床患者的MDRAB感染,极可能是受污染的医务人员手接触传播所致。
综上所述,该院ICU存在A型MDRAB克隆株的院内感染,耐药菌在环境物品表面的定值情况比较严重,需引起医务工作者的高度重视。切断耐药株的传播,ICU医务人员应迫切做好病房的消毒隔离,同时加强感染控制措施,如勤洗手、规范无菌操作、合理使用抗菌药物等[10]。此外,院内必须重视和开展细菌耐药性监测工作,进行同源性分析,追踪感染源,及时切断耐药克隆株的传播,以避免院内感染的大规模暴发。
[1]CLINICAL AND LABORATORY STANDARDS INSTITUTE.Performance standards for anti- microbial susceptibility testing.Twentysecond informational supplement[S].CLSI,M100 - S22,2012,32(3):1 -80.
[2]TENOVER FC,ARBEIT RD,GOERING RV,et al.Interpreting chromosomal DNA restriction patterns produced by pulsed-field gel electrophoresis:criteria for bacterial strain typing[J].J Clin Microbiol,1995,33(9):2233 -2239.
[3]王卫华,陈 洁,李春仙,等.泛耐药鲍氏不动杆菌β-内酰胺酶、膜孔蛋白、外排泵编码基因研究[J].中华医院感染学杂志,2012,22(10):2001 -2004.
[4]鲁海强,刘达恩.鲍氏不动杆菌生物膜的研究进展[J].中华医院感染学杂志,2012,22(23):5428 -5430.
[5]丁 慧.鲍曼不动杆菌耐药性分析及其主动外排基因adeB的分子检测[J].实用预防医学,2013,20(6):746 -748.
[6]黄育波,张天托,朱家馨,等.医院获得性肺炎患者醋酸钙-鲍曼不动杆菌复合体的鉴定和耐药基因研究[J].实用医学杂志,2015,31(3):476 -481.
[7]KEMPF M,ROLAIN JM.Emergence of resistance to carbapenems in Acinetobacter baumannii in Europe:clinical impact and therapeutic options[J].Int J Antimicrob Agents,2012,39(2):105-114.
[8]张小江,徐英春,俞云松,等.2009年中国CHINET鲍曼不动杆菌细菌耐药性监测[J].中国感染与化疗杂志,2010,10(6):441-446.
[9]朱德妹,汪 复,胡付品,等.2010年中国CHINET细菌耐药性监测[J].中国感染与化疗杂志,2011,11(5):321 -329.
[10]余 琳,苏丹虹,江凤茹,等.多重耐药鲍曼不动杆菌耐药基因分析与同源性分析[J].实用医学杂志,2013,29(12):2018-2021.

