基于金/银纳米三明治结构SERS特性的超灵敏前列腺特异性抗原检测
封 昭,周 骏*,陈 栋,王少敏,王小军,谢树森
(1.宁波大学理学院微电子科学与工程系,浙江宁波 315211; 2.宁波大学医学院附属医院,浙江宁波 315020; 3.福建师范大学医学光电科学与技术教育部重点实验室,福建省光子技术重点实验室,福建福州 350007)
基于金/银纳米三明治结构SERS特性的超灵敏前列腺特异性抗原检测
封 昭1,周 骏1*,陈 栋1,王少敏2,王小军2,谢树森3
(1.宁波大学理学院微电子科学与工程系,浙江宁波 315211; 2.宁波大学医学院附属医院,浙江宁波 315020; 3.福建师范大学医学光电科学与技术教育部重点实验室,福建省光子技术重点实验室,福建福州 350007)
基于金/银纳米三明治结构的表面增强拉曼散射(SERS)特性,实现了前列腺特异性抗原(PSA)高灵敏度免疫检测,检测结果具有特异性。采用化学还原法制备金、银纳米粒子,用4-巯基苯甲酸(4-MBA)及前列腺特异性抗体(Anti-PSA)链接金、银纳米粒子制备免疫探针,在硅片表面原位生长金、银纳米粒子并链接Anti-PSA制备得到免疫基底。将免疫探针、免疫基底以及PSA组成三明治结构,进行基于SERS特性的免疫检测。实验结果表明,纳米银免疫探针与纳米银免疫基底组成的三明治结构具有最佳的检测效果,PSA的检测灵敏度低至1.8 fg/mL(3.490×10-18mol/L),可应用于前列腺癌症的早期检测与诊断。
表面增强拉曼散射;纳米免疫探针;纳米免疫基底;免疫检测
1 引 言
目前,癌症已经严重威胁人类的健康,并成为主要死因之一。世界卫生组织(WHO)发布的《世界癌症报告2014》估计,2030年全世界癌症死亡人数将达到1 300万人[1]。同时,世界卫生组织提供的数据也显示,1/3癌症患者通过早期发现和早期治疗,可以得到根治,如1期的乳腺癌、鼻咽癌和喉癌等5年存活率接近100%[1]。而现在临床检测发现的患者往往己经处于癌症中晚期而无法痊愈,甚至存活期不到1年。因此,开展癌症的早期诊断技术研究,对于人民健康、社会和谐和经济持续发展,具有重大意义。
近年来,随着分子生物学的发展,人们对癌症病因和病理的认识不断深化,特别是肿瘤标志物(Tumormarker)的发现,对癌症的早期诊断、预后和疗效评价以及高危人群随访等都具有极大的实用价值。另一方面,基于贵金属纳米粒子表面增强拉曼散射(SERS)特性的生物传感技术,因其具有更高的空间分辨率和灵敏度,可以达到单分子检测水平,显示出良好的应用前景[2-6]。基于贵金属纳米粒子SERS特性的肿瘤标志物免疫检测技术已成为当前的研究热点[7-10]。
本文应用化学还原法合成出均匀性良好的金、银纳米粒子,然后与拉曼标记分子4-巯基苯甲酸(4-MBA)和前列腺特异性抗体(Anti-PSA)修饰链接制备金、银纳米免疫探针,并在硅片表面原位生长金、银纳米粒子层后链接Anti-PSA制备纳米金或纳米银免疫基底,与前列腺特异性抗原(PSA)组合成为三明治结构,进行基于SERS特性的免疫检测实验。结果表明,银纳米免疫探针-PSA-纳米银免疫基底组成的三明治结构对PSA的检测浓度低至1.8 fg/mL(3.49×10-18mol/ L),且具有很好的特异性。
2 实 验
首先由化学还原方法分别合成金、银纳米粒子,然后依次将拉曼标记分子4MBA和Anti-PSA链接到纳米粒子表面,再用牛血清白蛋白(BSA)包裹裸露的纳米粒子表面,即制备得到金、银纳米免疫探针。接下来,将经HF处理过的硅片浸入HAuCl4或AgNO3溶液,待金或银离子在硅表面还原生成岛状纳米膜后,滴加Anti-PSA溶液,即制备得到链接Anti-PSA分子的免疫基底。
在免疫检测过程中,首先将20μL的PSA滴加在制备的免疫基底上,在37℃下置放3 h后,分别用0.05%Tween 20的TPS缓冲液、三羟甲基氨基甲烷(TBS)缓冲液和去离子水清洗去除未结合的抗原。然后,再滴加20μL免疫探针溶液到基底表面,在4℃下放置2 h后,分别用0.05%Tween 20的TBS缓冲液、TBS缓冲液和去离子水清洗,经氮气吹干,即形成由免疫基底、抗原和4-MBA标记的免疫探针组成的三明治结构,如图1所示。
最后,将制备的纳米金免疫基底、纳米银免疫基底、PSA和4-MBA标记的金、银免疫探针分别组合成4种免疫三明治结构用于拉曼光谱测量。

图1 由金免疫基底、银纳米粒子免疫探针和前列腺特异性抗原组成的免疫三明治结构。Fig.1 Sketch map of the standard sandwich protocol of SERS-based immunoassay
3 结果与讨论
3.1 金、银纳米粒子免疫探针的特性
图2为所合成的金、银纳米粒子的扫描电子显微镜(SEM)照片。从图2可以看出,金纳米粒子的平均直径为(20±5)nm,银纳米粒子的平均直径为(80±15)nm。金、银纳米粒子和4-MBA标记的金纳米免疫探针的紫外-可见吸收光谱如图3所示,其中曲线1和曲线2以水作为参比溶液,曲线3以磷酸盐缓冲液作为参比溶液。从图3(a)可见,所制备的金纳米粒子的吸收峰位于520 nm处,其狭窄的半高宽反映出良好的分散性。加入4-MBA后,吸收峰从520 nm红移到527 nm,说明4-MBA分子成功地键合在金纳米粒子表面形成S—Au键[11];同时,由于金纳米粒子的团聚,在673 nm处出现了一个新吸收峰[12-13]。加入anti-PSA后,金纳米粒子的吸收峰又分别从527 nm和673 nm红移至536 nm和684 nm,说明Anti-PSA成功吸附到4-MBA标记的金纳米粒子表面。在图3(b)中,银纳米粒子的最大吸收峰位于409 nm处,狭窄的半高宽同样反映出良好的分散性。加入4-MBA后,银纳米粒子表面形成S—Ag键,吸收峰从409 nm红移到426 nm,同时峰宽增加,说明4-MBA已与银纳米粒子键合并导致银纳米粒子部分团聚。加入Anti-PSA后,吸收峰又从426 nm红移至438 nm处,表明抗体成功地吸附在4-MBA标记的银纳米粒子表面。图3(c)是实验测量中4-MBA溶液和免疫探针中PSA溶液的吸收光谱,从图中可以看出这2种试剂在可见光范围内的吸收很小,对总的吸收光谱的贡献可以忽略,进一步证明图3(a)和图3(b)中吸收峰的改变主要是分子与纳米粒子键合引起的。

图2 金纳米粒子(a)和银纳米粒子(b)的扫描电子显微镜照片Fig.2 SEM images of Au NRs(a)and Ag NRs(b)

图3 (a)金纳米粒子(曲线1)、4-MBA标记的金纳米粒子(曲线2)和4-MBA标记的金纳米免疫探针(曲线3)的吸收光谱;(b)银纳米粒子(曲线1)、4-MBA标记的银纳米粒子(曲线2)和4-MBA标记的银纳米免疫探针(曲线3)的吸收光谱;(c)4-MBA溶液和PSA溶液的吸收光谱。Fig.3 (a)Absorbance spectra of Au NPs(curve 1),4-MBA-labelled Au NPs(curve 2),and 4-MBA-labelled immune nano-Au probes(curve 3),respectively.(b)Absorbance spectra of Ag NPs(curve 1),4-MBA-labelled Ag NPs(curve 2),and 4-MBA-labelled immune nano-Ag probes(curve 3), respectively.(c)Absorbance spectra of 4-MBA solution and PSA solution.
在相同的测量条件下,4-MBA标记的金、银纳米粒子以及对应的免疫探针的SERS光谱如图4所示。可以看出,4-MBA标记的金、银纳米粒子的SERS信号明显强于4-MBA标记的金、银纳米粒子免疫探针的SERS信号。正如我们报道过的,上述现象说明抗体修饰纳米粒子后并没有使4-MBA标记的纳米粒子进一步团聚,而是增加纳米粒子之间的距离使得热点减少,从而导致拉曼信号减弱[13]。此外,金、银纳米粒子的增强因子(EF)可由公式EF=NbulkISERS/NSERSIbulk计算,式中Nbulk与Ibulk分别代表照射体积内的4-MBA分子数以及拉曼峰的积分强度,NSERS与ISERS代表照射体积内吸附在纳米粒子表面的4-MBA分子数以及表面增强拉曼峰的积分强度。由图4可得Ibulk= 6.1×103,吸附在金、银纳米粒子中4-MBA分子的ISERS分别为1.275 2×105和4.165 15×105。利用拉曼光谱仪的技术参数(激光波长为785 nm,物镜数值孔径为0.65,光斑直径为1.473 μm),以及样品中10-3mol/L的4-MBA浓度和2.471μm的穿透深度[14],计算出有效激发体积为4.209μm3和NSERS=2.532×106。实验中,4-MBA粉末的透射深度为2μm,密度为1.5 g·cm-3,摩尔质量为154.19 g·mol-1[15],则可得到Nbulk= 2×1010。经计算,金、银纳米粒子的增强因子分别为1.55×105和3.7×105。可见,银纳米粒子比金纳米粒子具有更好的拉曼增强效果。
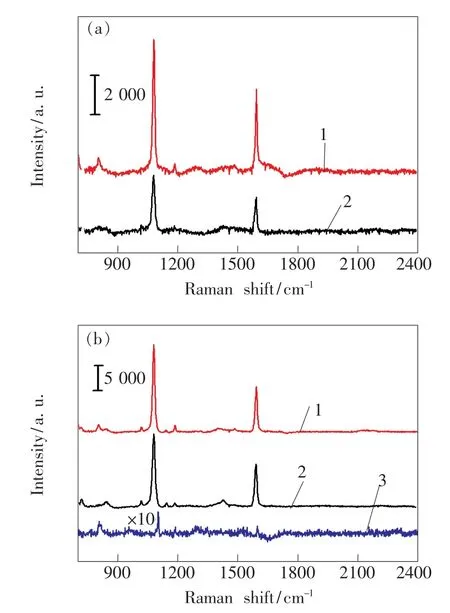
图4 (a)4-MBA标记的金纳米粒子(曲线1)和4-MBA标记的金纳米免疫探针的SERS光谱(曲线2); (b)4-MBA标记的银纳米粒子(曲线1)、4-MBA标记的银纳米免疫探针(曲线2)和干燥4-MBA粉末的SERS光谱(曲线3)。Fig.4 (a)SERSspectra of4-MBA-labelled Au NPs(curve 1),4-MBA-labelled immune nano-Au probes(curve 2).(b)SERS spectra of 4-MBA-labelled Ag NPs (curve 1),4-MBA-labelled immune nano-Ag probes (curve 2),and dry 4-MBA powder(curve 3),respectively.
3.2 纳米金基底或纳米银基底的特性
在硅片表面生长的纳米金与纳米银岛膜的SEM照片如图5所示。由图可见,所制备的纳米金岛膜呈单层结构,由许多小的类“磁畴”的颗粒组成,岛与岛之间的间隙不大,近乎连续,其“磁畴”的平均直径为(50±20)nm,孔洞率为10%;而所制备的纳米银岛膜是多层结构,其“磁畴”的平均直径为(80±20)nm,孔洞率为15%。正是因为纳米金与纳米银岛膜中的类“磁畴”结构,促进了纳米金与纳米银岛膜表面SERS热点的产生。

图5 纳米金基底(a)和纳米银基底(b)的SEM照片Fig.5 SEM images of nano-Au(a)and nano-Ag substrate(b)
为了比较纳米金基底与纳米银基底的SERS增强效果,我们将两种基底浸入10-2mol/L的4-MBA乙醇溶液中1 h后,放置在室温下使其干燥。然后,在两种基底上分别选取25个点进行4-MBA的SERS光谱测量,结果如图6所示。由图6(a)和6(b)可得,与纳米金基底与纳米银基底对应的4-MBA的SERS光谱在1 078 cm-1处的平均峰值强度分别为9 400±370(RSD 4.2%)和21 598±1 490(RSD 2.5%)。显然,纳米银基底比纳米金基底有更强的拉曼增强效果。
与前述类似,同样可以计算纳米金和纳米银基底的增强因子。此时,Ibulk=6.1×103,Nbulk= 2×1010,激光辐照光斑面积A=1.704μm2,纳米金基底的ISERS=2.04×105,纳米银基底的ISERS= 3.94×105。再根据文献[16],假设基底的粗糙因子R=1,1 mol的4-MBA分子所占的面积δ=2× 109cm2·mol-1,则由公式NSERS=RA/δ计算得到吸附分子数为5.1×106。最后,计算得到纳米金和纳米银基底的拉曼增强因子分别为1.3×105和2.5×105。显然,纳米银基底的拉曼增强效果优于纳米金基底。
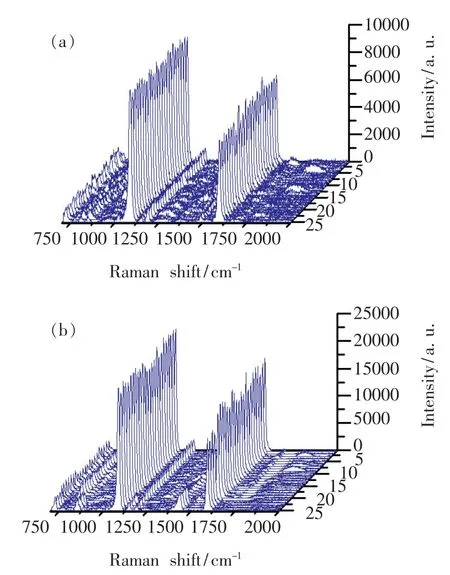
图6 纳米银基底(a)和纳米金基底(b)表面的4-MBA分子的SERS光谱Fig.6 SERS spectra of4-MBA molecules absorbed on nano-Au substrate(a)and nano-Ag substrate(b)

图7 4种免疫三明治结构下,对应两种PSA浓度的4-MBA的SERS光谱。(a)金纳米免疫探针-PSA-纳米金免疫基底; (b)金纳米免疫探针-PSA-纳米银免疫基底;(c)银纳米免疫探针-PSA-纳米金免疫基底;(d)银纳米免疫探针-PSA-纳米银免疫基底。Fig.7 SERS spectra of 4-MBA corresponding to two concentrations of PSA.(a)Nano-Au immune probes-PSA-nano-Au immune substrate.(b)Nano-Au immune probes-PSA-nano-Ag immune substrate.(c)Nano-Ag immune probes-PSA-nano-Au immune substrate.(d)Nano-Ag immune probes-PSA-nano-Ag immune substrate.
3.3 前列腺特异性抗原的免疫检测
将所制备的金、银免疫探针与纳米金免疫基底、纳米银免疫基底、PSA分别组合成4种免疫三明治结构进行拉曼光谱测量。为了比较4种三明治结构的免疫检测性能,首先检测两种浓度PSA的SERS信号,结果如图7所示。在相同的检测条件下,银纳米免疫探针-PSA-纳米银免疫基底组成的三明治结构的检测效果最佳,而金纳米免疫探针-PSA-纳米金免疫基底组成的三明治结构的检测效果较差,其他两种免疫三明治结构的检测效果介于这两者之间。因此,银纳米免疫探针-PSA-银纳米免疫活性基底形成的免疫三明治结构具有更高的检测灵敏度。
实际上,银比金有更高的活性,纳米银粒子更容易团聚,将产生较多的热点,从而导致更强电磁场增强。所以,纳米银探针的SERS信号明显高于纳米金探针的SERS信号。另一方面,根据电荷转移模型,由于金比银有更大的功函数(W金=5.1 eV,W银=4.26 eV),在适当波长激发光的照射下,银纳米粒子表面的电子易于从其费米能级共振跃迁到吸附的4MBA分子最低未占据分子能级上,分子的有效极化率变化较大,因此银纳米粒子的拉曼散射增强较大[17]。此外,根据文献[18-19],金纳米粒子的SERS增强因子先随粒径的增大而提高,在60 nm左右时达到极大后又随着粒径的增大而降低,而银纳米粒子在80~100 nm之间时SERS强度最大,这与制备探针所用的金纳米粒子(平均粒径(20±5)nm)和银纳米粒子(平均粒径(80±15)nm)的测量结果一致。同样地,就基底而言,纳米银基底的多层岛膜结构也比纳米金基底的单层岛膜结构能形成更多的热点,从而使纳米银基底可以获得更强的拉曼信号。这些不仅与对金、银纳米免疫探针、纳米金免疫基底和纳米银免疫基底的表征结果相一致,也很好地解释了银纳米免疫探针-PSA-纳米银免疫基底组成的免疫三明治结构具有高检测灵敏度的原因。
下面研究银纳米免疫探针-PSA-纳米银免疫基底组成的免疫三明治结构的检测灵敏度以及对目标抗原检测的特异性。首先,配制18 000, 1 800,180,18,1.8 fg/mL的5种抗原浓度的PSA样本,并检测对应样本的拉曼光谱,如图8(a)所示。再对图8(a)中各样本在1 078 cm-1处的峰值强度进行拟合,得到强度与浓度的关系如图8(b)所示。可以看出,SERS光谱的峰值强度与抗原浓度成正比关系,随着抗原浓度的降低而减小。考虑到检测误差和背景的影响,PSA的最低检测浓度为1.8 fg/mL。在特异性检测实验中,甲胎蛋白(AFP)被用来进行对比实验,测试结果如图9所示。由图可见,与AFP样本对应的拉曼光谱与无PSA抗原(0 fg/mL)情况下测量的背景光谱几乎相同,而且在1 078 cm-1的峰值强度远远弱于相同浓度下PSA样本对应的测量结果。因此,银纳米粒子免疫探针-PSA-纳米银免疫基底构成的三明治结构对于PSA具有显著的检测特异性。

图8 (a)对应不同PSA浓度的样品检测的4-MBA的SERS光谱;(b)1 078 cm-1处的峰值强度与PSA浓度的拟合曲线。Fig.8 (a)SERS spectra of 4-MBA corresponding to the different concentrations of PSA.(b)Dose-response curve of the peak intensity at1 078 cm-1 changed with the concentration of PSA.

图9 相同抗原浓度下,与PSA和AFP对应的4-MBA的SERS光谱。Fig.9 SERS spectra of4-MBA for PSA and AFP at the same concentrations
4 结 论
通过制备金、银纳米粒子免疫探针和纳米金与纳米银免疫基底,研究了由它们与PSA组成的4种免疫三明治结构的免疫检测特性。结果表明,以银纳米粒子免疫探针、PSA和纳米银免疫基底组成的免疫三明治结构对PSA具有很高的检测灵敏度,检测浓度低至1.8 fg/mL。在相同的测量条件下,对比实验也表明其对PSA的检测具有很强的生物特异性。因此,构建的银纳米粒子免疫探针-抗原-纳米银免疫基底的免疫三明治结构对于肿瘤标志物的检测具有很强的实用性。
[1]Stewart BW,Wild C P.World Cancer Report2014[M].Lyon:IARCNonserial Publication,2014.
[2]Qu G,Zhang G N,Su Y,etal.A label-free and separation-free detection formelamine based on surface enhanced Raman scattering[J].Chin.J.Anal.Chem.(分析化学),2014,42(7):1022-1027(in Chinese).
[3]Alvarez-Puebla R A,Dos Santos D S,Aroca R F,et al.SERS detection of environmental pollutants in humic acid-gold nanoparticle compositematerials[J].Analyst,2007,132(12):1210-1214.
[4]Patel B D,Mehta P J.An overview:Application of Raman spectroscopy in pharmaceutical field[J].Curr.Pharm. Anal.,2010,6(2):131-141.
[5]Zheng L,Zhao Y P.Identification of Pu'er teas with different fermentation time by surface-enhanced Raman scattering technology[J].Chin.J.Lumin.(发光学报),2013,34(2):230-234(in Chinese).
[6]Han X X,Zhao B,Ozaki Y.Label-free detection in biological applications of surface-enhanced Raman scattering[J]. TrAC-Trend.Anal.Chem.,2012,38(9):67-78.
[7]Yuan R H,Liu W H,Teng Y J,et al.Detection of ethoprophos using SERS coupled withmagnetic Fe3O4/Ag composite materials[J].Spectrosc.Spect.Anal.(光谱学与光谱分析),2015,35(5):1276-1280(in Chinese).
[8]Han X X,Zhao B,Ozaki Y.Label-free highly sensitive detection of proteins in aqueous solutions using surface-enhanced Raman scattering[J].Anal.Chem.,2009,81(9):3329-3333.
[9]Xu SP,Ji X H,Xu W Q,et al.Immunoassay using probe-labelling immunogold nanoparticles with silver staining enhancement viasurface-enhanced Raman scattering[J].Analyst,2004,129(1):63-68.
[10]Wu L,Wang Z Y,Zong SF,et al.A SERS-based immunoassay with highly increased sensitivity using gold/silver coreshell nanorods[J].Biosens.Bioelectron.,2012,38(1):94-99.
[11]Cui Y,Ren B,Yao JL,etal.Multianalyte immunoassay based on surface-enhanced Raman spectroscopy[J].J.Raman Spectrosc.,2007,38(7):896-902.
[12]Song C Y,Wang ZY,Zhang R H,etal.Highly sensitive immunoassay based on Raman reporter-labeled immuno-Au aggregates and SERS-active immune substrate[J].Biosens.Bioelectron.,2009,25(4):826-831.
[13]Shu L,Zhou J,Yuan X C,etal.Highly sensitive immunoassay based on SERSusing nano-Au immune probes and a nano-Ag immune substrate[J].Talanta,2014,123(9):161-168.
[14]Alvarez-Puebla R A.Effects of the excitation wavelength on the SERS spectrum[J].J.Phys.Chem.Lett.,2012,7 (3):857-866.
[15]Xia JR,Wei R,Wu Y M,et al.Synthesis of large flower-like substrates for surface-enhanced Raman scattering[J]. Chem.Eng.J.,2014,244(10):252-257.
[16]Wang A J,Lv JJ,Zhou D L,etal.Facile synthesis of ultrathin worm-like Au nanowires for highly active SERSsubstrates [J].New J.Chem.,2014,38(8):3395-3400.
[17]Adrian F J.Charge transfer effects in surface-enhanced Raman scattering[J].J.Chem.Phys.,1982,77(11):5302-5314.
[18]Zeman E J,Schatz G C.An accurate electromagnetic theory study of surface enhancement factors for silver,gold,copper, lithium,sodium,aluminum,gallium,indium,zinc,and cadmium[J].J.Phys.Chem.,1987,91(3):634-643.
[19]Emory SR,Nie S.Screening and enrichment ofmetal nanoparticles with novel optical properties[J].J.Phys.Chem. B,1998,102(3):493-497.

封昭(1990-),男,陕西咸阳人,硕士研究生,2013年于宝鸡文理学院获得学士学位,主要从事表面增强拉曼散射及其应用的研究。
E-mail:fengzhaozj@163.com

周骏(1958-),男,安徽当涂人,博士,教授,1996年于上海交通大学获得博士学位,主要从事纳米功能材料、光电子技术和生物光子学等方面的研究。
E-mail:yzhoujun@nbu.edu.cn
Hypersensitization Immunoassay of Prostate-specific Antigen Based on SERS of Sandw ich-type Au/Ag Nanostructure
FENG Zhao1,ZHOU Jun1*,CHEN Dong1,WANG Shao-min2,WANG Xiao-jun2,XIE Shu-sen3
(1.Department ofMicroelectronic Science and Engineering,Faculty of Science,Ningbo University,Ningbo 315211,China; 2.Affiliated Hospital ofSchool ofMedicine,Ningbo University,Ningbo 315020,China; 3.Key Laboratory ofOptoElectronic Science and Technology forMedicine ofMinistry of Education, Fujian Provincial Key Laboratory for Photonics Technology,Fujian Normal University,Fuzhou 350007,China) *Corresponding Author,E-mail:zhoujun@nbu.cn
Based on surface enhanced Raman scattering(SERS),a super-sensitive immunoassay of prostate specific antigen(PSA)was developed with the sandwich-type structure consisted of the nano-Ag immune probes and nano-Ag immune substrate.Experimentally,the chemical reductionmethod was used to prepare Au and Ag nanoparticles,the nano-Au/Ag immune probeswere prepared by immobilising Raman reportermolecule4-mercaptobenzoic acid(4-MBA)and anti-prostate specific antigen antibody(Anti-PSA)onto the surfaces of Au/Ag nanoparticles.The nano-Ag/Au immune substrateswere prepared by in-situ growing of Ag/Au nanoparticles on a silicon wafer and linkingwith Anti-PSA.The immunoassays of PSA were explored by the four kinds of sandwich-type structures consisted of the nano-Au/Ag immune probes and nano-Au/Ag immune substrates,respectively.It is found that the sandwich-type structure consisted of nano-Ag immune probe and nano-Ag immune substrate is the bestone to the immunoassay of PSA,and the detection limitof PSA is as low as1.8 fg/mL(3.490×10-18mol/L),which is suitable to be applied in early detection and diagnosis of prostate cancer.
surface-enhanced Raman scattering;nano-immune probe;nano-immune substrate;immunoassay
O433.1
A
10.3788/fgxb20153609.1064
1000-7032(2015)09-1064-07
2015-05-11;
2015-08-09
国家自然科学基金(61275153,61335011,61320106014);浙江省自然科学基金(LY12A04002);宁波大学王宽诚幸福基金资助项目

