过硫酸钾氧化去除水和土壤中的苯胺
吴玉婷,马福俊,谷庆宝,彭昌盛*
1.中国海洋大学环境科学与工程学院,山东 青岛 266100
2.环境基准与风险评估国家重点实验室,中国环境科学研究院,北京 100012
苯胺(ANL)是一种在染料、橡胶、军工、医药等行业中广泛使用的有机化工原料和化工产品,因其“三致”作用和半衰期长等特点,对人体和其他生物健康存在极大危害,具有一定的环境风险[1-2]。苯胺被列入美国国家环境保护局(US EPA)优先控制的129 种污染物黑名单,同时也是我国14 类优先控制污染物之一[3-4]。目前我国已进入环境污染事故高发期,尤其是重大突发性的化学污染事故,其发生频率和危害程度均有增加的趋势[5],据国家安全生产监督管理总局的资料记载,2002年8月江苏境内发生苯胺大量泄漏,污染6 条河流并危及长江水质,造成鱼类、水生植物和家禽死亡;另外,2004年8月浙江境内、2005年松花江的水污染事件,2006年2月渝涪高速公路苯胺翻车泄漏,以及同年5月兰州中石油分公司苯胺车间发生爆炸,2012年末山西长治苯胺泄漏事故更是波及河南、河北等省市,这些事故均给当地及下游地区的水体和土壤造成了极大危害,形势十分严峻。因此,针对环境污染事故引起的地表水和土壤苯胺污染,研究开发相应的应急处理技术迫在眉睫。
目前,针对苯胺污染废水处理的研究已较为广泛,主要有物理法(吸附法[6]和萃取法[7])、化学法(氧化法[8]和电化学降解法[9])以及生物法[10]。其中,化学法中的高级氧化技术得到越来越多的重视,如光催化氧化法[11]、芬顿氧化法[12]、臭氧氧化法[13]等。虽然这些方法都可以有效地进行苯胺废水的净化处理,但若应急使用于突发事故造成的苯胺污染仍有困难[14-15]。过硫酸盐作为一种新型氧化剂,以其高效、快速、稳定性强、适用范围广等特点,被国内外学者用于处理包括苯系物、多环芳烃、多氯联苯等在内的各种难处理污染物[16-18]。Yen C.H.等[19]发现过硫酸钾在处理石油烃时,氧化能力、反应持久性均优于过氧化氢和高锰酸钾;Lee Y.C.等[20-21]研究过硫酸钾对全氟辛酸、二硝基甲苯等物质的氧化去除表明,相对于现有的其他方法,基于过硫酸盐的高级氧化技术更适用于高浓度有机污染物的快速降解去除,对于苯胺污染物的氧化处理具有良好的发展前景。常影等[22]利用二价铁活化过硫酸盐研究去除水中苯胺取得了较佳的降解效果,但并未对土壤中苯胺污染物的去除展开研究,存在一定的局限性,且在实际应用中投加二价铁无疑增大了处理成本。
由于突发性化学事故造成的污染往往浓度较高,在处置时需要短时、高效完成清除和降解工作,并尽量降低处理成本,目前相关研究较少。为了探索过硫酸钾对水中和土壤中苯胺降解的适用性,通过配制一定浓度的苯胺水溶液和高浓度苯胺污染土壤,考察温度、氧化剂浓度和初始pH 等因素对苯胺溶液氧化效果的影响;选择最优参数,验证过硫酸钾对土壤中高浓度苯胺污染物降解的适用性,以期为应急处理水和土壤中的苯胺污染提供理论依据。
1 材料与方法
1.1 试剂与仪器
主要试剂:苯胺(C6H5NH2),纯度99%;氢氧化钠(NaOH),分析纯;硫酸(H2SO4),分析纯;过硫酸钾(K2S2O8),分析纯;甲基叔丁基醚(C5H12O,MTBE),色谱纯。试验过程中所有溶液均用超纯水配制。
试验仪器:样品中苯胺的残留浓度采用GC/MS(安捷伦GC7890A/5975C)测定,配备DB-5 型色谱柱,规格为30 m ×0.25 mm ×0.25 μm;溶液pH 采用pH 计(Thermo Fisher Orion 3 -Star)测定;TOC 浓度采用总有机碳分析仪(TOC - VCPH,岛津集团)测定。
苯胺水溶液的配制:准确量取100 mg 苯胺标准物于1 L 容量瓶中,加水稀释至刻度,配制成浓度为100 mg/L 的苯胺溶液。
苯胺模拟土壤的制备:供试土壤为山东潮土,采自山东禹城地区的表层土壤(0 ~20 cm)。土壤pH为8.2;有机质含量为1.3%;砂粒,粉砂粒和黏粒含量分别为66.5%,15.6%和17.9%。
将去除杂质的表层土置于阴凉处风干后研磨,过2 mm 筛,每次取筛后土壤200 g 于1 L 锥形瓶中,加入苯胺标准物,制成浓度为1 157 mg/kg 的模拟污染土。
1.2 试验方法
1.2.1 过硫酸钾氧化水中苯胺
量取50 mL 浓度为100 mg/L 的苯胺溶液于具塞锥形瓶中,加入不同质量过硫酸钾,分别配制成过硫酸钾浓度为0,10.3,51.5,103.0 和258.0 mmol/L(过硫酸钾和苯胺的质量比分别为0,10,50,100,258)的溶液,充分搅拌均匀后置于恒温箱中(避光),于20,30,40 和50 ℃条件下进行试验,考察不同温度对降解效果的影响。分别在10,30,60,90,150 和210 min 时从锥形瓶中取出1 mL 样品,用5 mL 的MTBE 进行液液萃取,用GC-MS 检测有机相中苯胺的浓度,并对各组反应前后的水溶液进行TOC 浓度的检测,计算反应前后TOC 的降解率。每个系列均进行3 组平行试验(下同)。
为了考察过硫酸钾处理苯胺废水在不同酸碱度下的适用性,利用NaOH 和H2SO4调节初始pH 分别为3,5,7,9,11,考察初始pH 对苯胺降解效果的影响。于10,30,60,90,150 和210 min 时从锥形瓶中取出1 mL 样品,测定溶液的TOC 浓度,研究溶液初始pH 对氧化效果的影响。
1.2.2 过硫酸钾氧化土壤中苯胺
基于水溶液的试验结果,进一步探索优化条件下,过硫酸钾对苯胺污染土壤修复的适用性。取20 g 模拟污染土壤于100 mL 具塞锥形瓶中,分别加入20 mL 浓度为0,0.1,1.2,3.2 mol/L(过硫酸钾和苯胺质量比分别为0,10,100,258)的过硫酸钾溶液,置于磁力搅拌器上搅拌,分别于1,5,10,30,60,240和360 min 时,取下锥形瓶,于3 000 r/min 下离心30 min,将上清液转移至50 mL 密封瓶中,加20 mL 的MTBE 进行液液萃取,用GC -MS 检测有机相中苯胺浓度;固相置于冷冻干燥机中干燥24 h,研磨,以MTBE 萃取并检测有机相中苯胺浓度。
2 结果与讨论
2.1 过硫酸钾氧化处理水中苯胺
2.1.1 反应温度对苯胺降解率的影响
不同温度下苯胺降解率随时间的变化如图1 所示。由图1(a)可知,当温度由20 ℃升至40 ℃时,反应200 min 后,降解率由55.6%增加到69.8%,继续升高温度至50 ℃,苯胺的降解率增加到74.4%,降解效果明显提高。随着反应时间的延长,溶液中苯胺的浓度逐渐降低,反应过程符合准一级动力学。20,30,40 和50 ℃下的反应速率常数分别为0.003 3(R2=0.931),0.003 2(R2=0.975),0.004 4(R2=0.971)和0.006 min-1(R2=0.986),表明提高温度可以有效提高过硫酸钾与苯胺的反应速率。由图1(b)可知,150 min 后,在20 和30 ℃下TOC 降解率较小,仅为17.5%和16.9%,当温度升高至40 ℃时,降解率明显提升,达到50%以上。TOC 降解率与苯胺降解率的变化不完全一致,说明在氧化过程中苯胺并未完全矿化,存在中间产物。胡军等[23]研究发现,苯胺经氧化作用发生聚合生成聚苯胺,随着反应的进行聚苯胺逐渐降解至完全去除;在不同的降解反应体系中,均有硝基苯和对苯醌产生,并由于硫酸自由基(·SO-4)和羟基自由基(·OH)的作用矿化为开环碳链,最终转化为CO2[24-25]。
结果表明,升高反应温度有利于提高过硫酸钾的氧化能力,这主要由于反应温度的升高使得过硫酸钾中O—O 键更容易断裂,产生更多·SO-4,因而有利于苯胺的氧化降解[16]。该试验结果与WANG Z.等[26-27]的研究结果一致。常影等[22]探索了反应温度对苯胺降解效能的影响,结果表明,苯胺的去除效率随温度的升高有所增加,但是增幅很小,可能是由于其反应系统中Fe2+对过硫酸盐的活化起主要作用,因此系统温度对于其氧化效果的影响较小。在环境温度下(20 ~40 ℃),过硫酸钾可有效氧化水中苯胺,US EPA 也推荐使用40 ℃作为活化温度,用于过硫酸钾氧化受污染的地下水和土壤。在实际应用中,升高温度增加了处理成本和技术难度,因此40 ℃是过硫酸钾氧化苯胺的适宜温度。
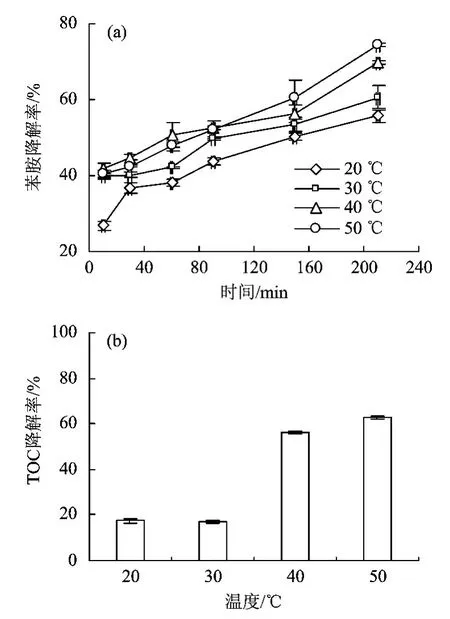
图1 温度对苯胺降解效果的影响Fig.1 Influence of temperature on degradation of aniline
2.1.2 过硫酸钾浓度对苯胺降解率的影响
过硫酸钾浓度对苯胺降解效果的影响如图2 所示。随着过硫酸钾浓度的增大,苯胺的降解率也相应提高。反应150 min,过硫酸钾浓度为103.0 时,降解率可达到94.1%,且150 min 后浓度不再发生变化,此时反应已达到平衡;而在过硫酸钾浓度为10.3 mmol/L 时降解率仅为66.8%。随氧化剂浓度的增大,反应速率明显增大。如图2(b)所示,随着过硫酸钾浓度的增加,TOC 降解率也相应增大,当浓度为103.0 和258.0 mmol/L 时,TOC 降解率达到70%以上。
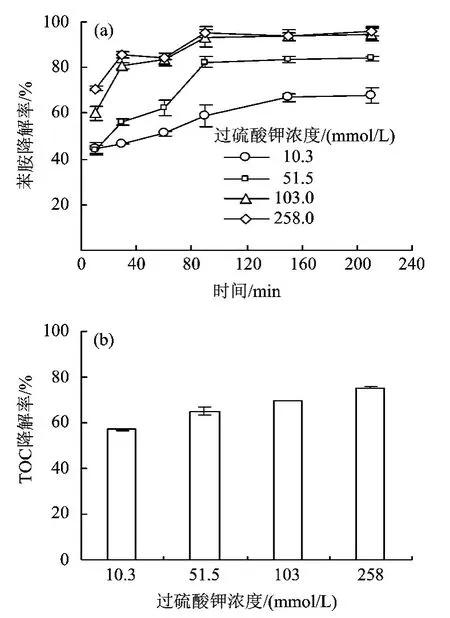
图2 过硫酸钾初始浓度对苯胺降解的影响ig.2 Influence of Na2S2O8 on degradation of aniline

图3 初始pH 对过硫酸钾氧化苯胺的影响Fig.3 Influence of initial pH on degradation of aniline
由图2 可知,增加过硫酸钾的浓度可有效提高苯胺的去除效率,这与文献[28]所得结论一致。原因主要由于过硫酸钾浓度增加后,溶液中·SO-4浓度也相应增大,从而大大提高了氧化能力。过硫酸钾的投加量越多,产生的·SO-4越多,对苯胺的降解效果也越好。GB 8978—1996《污水综合排放标准》中,对苯胺的排放限值规定为5 mg/L,在40 ℃,过硫酸钾浓度为103.0 mmo/L 时,苯胺残留浓度已符合标准,因此,在处理水中的苯胺污染物时,选择反应温度为40 ℃,过硫酸钾浓度为103.0 mmol/L为宜。
2.1.3 初始pH 对苯胺降解率的影响
溶液的初始pH 对过硫酸钾的氧化能力存在重要影响,不同初始pH 条件下过硫酸钾对苯胺的降解效果如图3 所示。由图3 可知,反应210 min 后,当初始pH 为7 时,苯胺降解率达到90%以上;当初始pH 为5,9 和11 时,降解率达到80%以上,而初始pH 为3 时,降解率仅达到68.7%。由此可见,中性环境中过硫酸钾对苯胺的处理效果最好,碱性环境下次之,强酸性环境则最不利于过硫酸钾发挥氧化作用。由图3(b)可知,在初始pH 为5 ~11 时,其对于TOC 降解的影响基本可以忽略。
结果表明,强酸条件下不利于过硫酸钾对苯胺的氧化,主要由于当溶液处于酸性条件下时,过硫酸盐在酸催化条件下产生更多的·SO-4,·SO-4的产生速率过快,导致其在溶液中浓度过大,以至于自由基之间的碰撞机率远大于自由基与有机物之间的反应,从而降低了反应速率,故强酸性条件不利于苯胺的降解[29]。当溶液初始pH 达到9 甚至11 以后,降解率较pH 为7 时有所降低,这可能是由于在碱性环境中,S2O82-能够分解产生更多·SO-4 ,从而与溶液中的OH-反应生成·OH,在碱性环境中·OH 的氧化能力低于·SO-4 ,因此苯胺的降解率有所降低[27]。
2.2 过硫酸钾氧化处理土壤中苯胺
2.1 节结果表明,在恒温(40 ℃)和定量过硫酸钾(103.0 mmol/L,过硫酸钾和苯胺的摩尔浓度比为100)的条件下,过硫酸钾可以对水中苯胺实现快速高效的降解。使用过硫酸钾进一步处理高浓度苯胺污染土壤,结果如图4 所示。由图4 可知,苯胺的降解率随过硫酸钾浓度增加而提高。当过硫酸钾初始浓度为0.1 mol/L 时,反应360 min 后,降解率仅为78%;当浓度提高至1.2 和3.2 mol/L 时,降解率分别达到98.6%和98.9%,二者降解效果基本一致,故过硫酸钾与苯胺的摩尔浓度比达到100 时,即可很好地降解土壤中的高浓度苯胺污染物,与水溶液中的结论一致。

图4 过硫酸钾初始浓度对土壤中苯胺氧化降解的影响Fig.4 Influence of Na2S2O8 on degradation of aniline in soils
研究显示[18],由于·SO-4为亲电子自由基,具有选择性氧化有机物的特点,从而可以尽量少地扰动土壤本底物。Liang C. J. 等[30]对过硫酸盐处理有机污染砂土和粉砂土的效果进行研究时发现,过硫酸盐对除目标污染物以外的土壤有机质氧化作用缓慢而温和,且氧化后的土壤颗粒SEM 分析结果显示,不同于过硫酸盐,经H2O2、MnO-4、Fenton 法氧化后的土壤颗粒结构呈现尖锐、破碎等性状。此外,经过硫酸盐处理的土壤,反应结束后土壤菌落数也有所回升。因此,相对于其他氧化剂而言,过硫酸盐对土壤性质的影响较小,且处理效果更为理想,在处理有机污染水体和土壤时具有独特的优势和良好的应用前景。
以上结果显示,在40 ℃条件下使用过硫酸钾可以有效修复受苯胺污染的水体和土壤。由于苯胺的降解率随过硫酸钾浓度的增加而相应提高,在实际的场地修复中,需要考虑药剂投加的成本问题。另外,在实际应用中,过硫酸根经过氧化反应后所生成的硫酸根浓度可能会超过相关的环境标准,如US EPA 和我国的饮用水标准中,对于硫酸根浓度的限值均为250 mg/L;但是由于自然水体的作用,可能会将较高浓度的硫酸根稀释,且硫酸根的存在可以刺激硫酸盐还原菌的生长,硫酸盐还原菌可以在pH为5 ~10、温度为5 ~50 ℃的环境中生长[31],完全适应过硫酸钾处理后的水体环境,从而进一步利用水体中残留的有机物并将硫酸根转化为硫化物[32],在此过程中,还可结合水中的重金属离子生成溶解度很低的金属硫化物而去除重金属离子[33],且其胞外聚合物具有较好的吸附作用[34],进一步净化水体,可谓一举多得。当硫酸盐的存在可以对场地的进一步生物作用产生积极影响,促进硫酸盐还原菌的代谢或为其他微生物的代谢提供充足的电子供、受体时,则无需采取措施降低硫酸盐浓度。另外,硫酸根离子可以结合钙离子、钡离子生成稳定的沉淀,因此当硫酸盐的存在不利于生物代谢作用并产生消极影响时,可向其中投加一定量生石灰以生成硫酸盐沉淀从而消除过多的硫酸根离子,或结合场地实际情况合理利用硫酸盐,以废治废,达到更好的修复效果[35]。
3 结论
(1)对于苯胺的降解,反应温度和过硫酸钾浓度至关重要,降解率随温度的升高和过硫酸钾浓度的增加而相应提高,在反应温度为40 ℃、初始pH为7、过硫酸钾浓度为103.0 mmol/L 条件下,降解率达到94.1%。
(2)在初始pH 为5 ~11 条件下,过硫酸钾均能较好地发挥氧化作用;而初始pH 为3 时,过硫酸钾对苯胺的降解效果较差;反应后的溶液呈酸性。
(3)针对苯胺污染土壤,在40 ℃条件下,过硫酸钾浓度为1.2 mol/L 时,土壤中苯胺的降解率达到98.6%。
由此可见,在水和土壤中使用过硫酸钾,可于短时间内高效降解高浓度的苯胺污染物。此外,避免了过硫酸钾的活化剂对环境造成的潜在威胁,同时降低了处理成本。因此,在突发性环境污染事故中使用过硫酸钾降解苯胺污染物是可行的。
[1] 吴光前,张鑫,惠慧,等.氧等离子体改性竹活性炭对苯胺的吸附特性[J].中国环境科学,2012,32(7):1188-1195.
[2] 谢春娟.氧化法处理废水中苯胺类有机物的研究[D]. 兰州:兰州交通大学,2007.
[3] 钱易,汤鸿霄,文湘华.水体颗粒物和难降解有机物的性质与控制技术原理(下卷):难降解有机物[M]. 北京:中国环境科学出版社,2000:1-29.
[4] 洪小燕,温裕云,林芳,等.土壤及沉积物中25 种芳香胺的固-液-液萃取及气相色谱-质谱测定方法初步研究[J]. 分析测试学报,2010,29(1):31-34.
[5] 傅金祥,王锋,李敬宝,等.应急处理苯胺污染水源水的粉末活性炭吸附工艺的研究[J].环境污染与防治,2007,29(8):689-692.
[6] 陶红,周仕林,高廷耀.13X 分子筛处理含苯胺废水的实验研究[J].环境科学学报,2002,22(3):408-411.
[7] 冯旭东,林屹,瞿福平,等. 处理苯胺类稀溶液的萃取置换技术[J].环境科学,2001,22(1):71-74.
[8] 聂永平,邓正栋,袁进.苯胺废水处理技术研究进展[J].环境污染治理技术与设备,2003,4(3):77-81.
[9] BRILLAS E,CASADO J. Aniline degradation by electro-Fenton and peroxi-coagulation processes using a flow reactor for wastewater treatment[J].Chemosphere,2002,47(3):241-248.
[10] KAHNG H Y,KUKOR J J,OH K H. Characterization of strain HY99,a novel microorganism capable of aerobic and anaerobic degradation of aniline[J].FEMS Microbiology Letters,2006,190(2):215-221.
[11] 柯强,陈英旭,何云峰,等. 一种光催化体系光催化降解苯胺的研究[J].环境污染与防治,2004,26(4):250-252.
[12] LU M C,CHANG Y F,CHEN I M,et al. Effect of chloride ions on the oxidation of aniline by Fenton’s reagent[J].Environment Management,2005,75(2):177-182.
[13] PIERPOINT A C,HAPEMAN C J,TORRENTS A. Ozone treatment of soil contaminated with aniline and trifluralin[J].Chemosphere,2003,50(8):1025-1034.
[14] AY F,CATALKAYA E C,KARGI F. A statistical experiment design approach for advanced oxidation of Direct Red azo-dye by photo-Fenton process[J]. Journal of Hazardous Materials,2009,162(1):230-236.
[15] ANOTAI J,SINGHADECH S,SU C,et al. Comparison of otoluidine degradation by Fenton,electro-Fenton and photoelectro-Fenton processes[J]. Journal of Hazardous Materials,2011,196(30):395-401.
[16] 王兵,李娟,莫正平,等. 基于硫酸自由基的高级氧化技术研究及应用进展[J].环境工程,2012,36(4):53-57.
[17] PEYTON G R.The free-radical chemistry of persulfate-based total organic carbon analyzers[J]. Marine Chemistry,1993,41(1):91-103.
[18] TSITONAKI A,PETRI B,CRIMI M,et al. In situ chemical oxidation of contaminated soil and groundwater using persulfate:a review[J].Critcal Reviews in Environmental Science and Technology,2010,40(8):55-91.
[19] YEN C H,CHEN K F,KAO C M,et al.Application of persulfate to remediate petroleum hydrocarbon-contaminated soil:feasibility and comparison with common oxidants[J]. Journal of Hazardous Materials,2011,186(8):2097-2102.
[20] LEE Y C,LO S L,KUO J,et al. Persulfate oxidation of perfluorooctanoic acid under the temperatures of 20-40 ℃[J].Chemical Engineering Journal,2012,198/199(1):27-32.
[21] CHEN W S,JHOUY C,HUANG C P. Mineralization of dinitrotoluenes in industrial wastewater by electro-activated persulfate oxidation[J].Chemical Engineering Journal,2014,252(15):166-172.
[22] 常影,姜宁,雷抗,等. 二价铁活化过硫酸盐去除水中苯胺[J].世界地质,2014,33(3):702-707.
[23] 胡军,周集体,张爱丽,等. 光催化-臭氧联用技术降解苯胺研究[J].大连理工大学学报,2005,45(1):26-31.
[24] CANLE L M,SANTABALLA J A,VULLIET E. On the mechanism of TiO2-photocatalyzed degradation of aniline derivatives[J]. Journal of Photochemistry and Photobiology A:Chemistry,2005,175(2/3):192-200.
[25] OLIVIERO L,BARBIER J,DUPREZ D. Wet air oxidation of nitrogen-containing organic compounds and ammonia in aqueous media[J]. Applied Catalysis B:Environmental,2003,40(3):163-184.
[26] WANG Z,DENG D,YANG L.Degradation of dimethyl phthalate in solutions and soil slurries by persulfate at ambient temperature[J].Journal of Hazardous Materials,2014,271(30):202-209.
[27] LIANG C,WANG Z,BRUELL C J.Influence of pH on persulfate oxidation of TCE at ambient temperatures[J]. Chemosphere,2007,66(1):106-113.
[28] LI S X,WEI D,MAK N K,et al.Degradation of diphenylamine by persulfate:performance optimization,kinetics and mechanism[J].Journal of Hazardous Materials,2009,164(1):26-31.
[29] 杜肖哲.基于热活化过硫酸盐新型高级氧化技术深度处理水中对氯苯胺的研究[D].广州:华南理工大学,2012.
[30] LIANG C J,CHIEN Y C,LIN Y L. Impacts of ISCO persulfate,peroxide and permanganate oxidants on soils:soil oxidant demand and soil properties[J]. Soil and Sediment Contamination:An International Journal,2012,21(6):701.
[31] RALF R,JOHANN H.Initial reactions of anaerobic metabolism of alkylbezenes in denitrifying and sulfate reducing bacteria [J].Archives of Microbiology,1998,170(3):377-384.
[32] SUTTON N B,GROTENHUIS J T C,LANGENHOFF A A M,et al. Efforts to improve coupled in situ chemical oxidation with bioremediation:a review of optimization strategies[J]. Soil Sediment,2011,11(1):129-14.
[33] 王清良,段晓恒,黄爱武.SRB 生物法处理废水的研究进展与现状[J].中国矿业,2005,14(2):6-8.
[34] 潘响亮,王建龙,张道勇.硫酸盐还原菌混合菌群胞外聚合物对Zn2+的吸附和机理[J]. 环境科学研究,2005,18(6):53-55.
[35] 王孙崯,汪福旺,韩进,等. 原位化学氧化技术过硫酸钠使用后残留硫酸盐的影响探讨[J]. 农业环境与发展,2013,30(4):24-28. ○

