代谢工程改造大肠杆菌生产辅酶Q10
戴冠苹,苗良田,孙涛,李清艳,肖冬光,张学礼
代谢工程改造大肠杆菌生产辅酶Q10
戴冠苹1,2,3,苗良田1,2,3,孙涛1,2,3,李清艳2,3,肖冬光1,张学礼2,3
1 天津科技大学生物工程学院,天津 300457 2 中国科学院天津工业生物技术研究所,天津 300308 3 中国科学院系统微生物工程重点实验室,天津 300308

戴冠苹, 苗良田, 孙涛, 等. 代谢工程改造大肠杆菌生产辅酶Q10. 生物工程学报, 2015, 31(2): 206–219.Dai GP, Miao LT, Sun T,et al. Production of coenzyme Q10 by metabolically engineered Escherichia coli. Chin J Biotech, 2015, 31(2): 206–219.
辅酶Q10(CoQ10) 是一种脂溶性抗氧化剂,具有提高人体免疫力、延缓衰老和增强人体活力等功能,广泛应用于制药行业和化妆品行业。微生物发酵法能可持续性生产辅酶Q10,具有越来越多的商业价值。本研究首先将来自类球红细菌的十聚异戊二烯焦磷酸合成酶基因 () 整合到大肠杆菌ATCC 8739染色体上,敲除内源的八聚异戊二烯焦磷酸合成酶基因 (),使内源的辅酶Q8合成途径被辅酶Q10合成途径取代,得到稳定生产辅酶Q10的菌株GD-14,其辅酶Q10产量达0.68 mg/L,单位细胞含量达0.54 mg/g DCW。随后用多个固定强度调控元件在染色体上对MEP途径的关键基因和基因以及基因进行组合调控,将辅酶Q10单位细胞含量提高2.46倍 (从0.54到1.87 mg/g)。进一步引入运动发酵单胞菌的Glf转运蛋白代替自身的磷酸烯醇式丙酮酸:碳水化合物磷酸转移酶系统 (PTS),使辅酶Q10产量进一步提高16%。最后,对高产菌株GD-51进行分批补料发酵,辅酶Q10产量达433 mg/L,单位细胞含量达11.7 mg/g DCW。这是目前为止文献报道的大肠杆菌产辅酶Q10最高菌株。
辅酶Q10,同源重组,基因表达调控,大肠杆菌
辅酶Q (CoQ),即2,3-二甲氧基-5-甲基-6-聚异戊二烯醌,又称泛醌 (Ubiquinone,UQ) 是一种脂溶性醌类化合物,含有一个苯醌环和不同长度异戊二烯构成的侧链[1],其中侧链的异戊二烯单位数决定着辅酶Q的种类。辅酶Q存在于众多微生物中,如流感嗜血杆菌主要合成CoQ7[2]、大肠杆菌主要合成CoQ8[3]、藤黄微球菌主要合成CoQ9[4]。人类主要合成辅酶Q10,含有10个异戊二烯单位。辅酶Q10在人体有氧呼吸电子传递链中起重要作用,也是人体重要的抗氧化剂,可以通过清除自由基和再生生育酚类,保护细胞膜和蛋白质不被氧化[5-7]。辅酶Q10也可以保护心脏[8],它是人体产生能量的要素,有助于为心肌提供充足的氧气,改进心肌的代谢,加强心脏的功能。口服辅酶Q10可以预防和治疗心血管疾病、糖尿病、神经性疾病和脑病[9-12]。辅酶Q10另一个重要应用是作为皮肤软膏的成分,可以减少皱纹[13]。这些重要的生理功能使关于辅酶Q10的研究不断增多。
大肠杆菌具有遗传背景清晰、技术操作简单、适合大规模发酵等优点,通常作为基因工程宿主菌,用于次级代谢产物生产[3];并且大肠杆菌可以合成辅酶Q8,其泛醌合成途径和基础代谢研究透彻,因此,多个研究组利用基因工程手段改造大肠杆菌生产辅酶Q10。如将根瘤农杆菌[14]、脱氮副球菌[15]和鞘氨醇单胞菌[16]等的十聚异戊二烯焦磷酸合成酶基因 (),在大肠杆菌中表达,构建产辅酶Q10的工程菌株。
对羟基苯甲酸 (pHBA) 和十聚异戊二烯焦磷酸 (DPP) 是辅酶Q10合成的两个重要前体物质。所有的类异戊二烯侧链由共同的合成单位类异戊二烯焦磷酸 (IPP) 和它的异构体二甲丙烯基焦磷酸 (DMAPP) 合成。目前已知有两种合成IPP和DMAPP的途径:一种是甲羟戊酸(Mevalonate,MVA) 途径,另一种是2-C-甲基- D-赤藓糖醇-4-磷酸 (MEP) 途径。MVA途径主要存在于古生菌、真菌和植物的胞液或内质网上。细菌和绿色藻类,主要利用MEP途径来合成IPP和DMAPP。Zhao等用多个不同强度人工调控元件对MEP途径的基因进行系统调控,发现1-脱氧-D-木酮糖-5-磷酸合酶基因 () 和异戊二烯焦磷酸异构酶基因 () 是限速基因,提高这两个基因的表达强度,β-胡萝卜素产量显著提高[17]。Kim等[18]为了提高重组大肠杆菌的辅酶Q10产量,将来自绿脓假单胞菌的基因以质粒的形式过表达,发现辅酶Q10产量提高2倍。
在大肠杆菌中,由分支酸-丙酮酸裂解酶基因 () 编码的分支酸-丙酮酸裂解酶催化分支酸转化为pHBA,为辅酶Q10的合成提供核心结构苯醌环;对羟基苯甲酸-聚异戊二烯转移酶基因 () 编码的对羟基苯甲酸-聚异戊二烯转移酶催化pHBA与聚异戊二烯焦磷酸的缩合是整个辅酶Q合成的限速酶。Zhang等[19]以质粒形式过表达基因使辅酶Q10产量提高5倍。强化表达基因可以显著提高辅酶Q10的产量。
研究表明用非磷酸烯醇式丙酮酸:碳水化合物磷酸转移酶系统 (PTS) 代替大肠杆菌自身的PTS系统,可以减少磷酸烯醇式丙酮酸 (PEP) 的消耗,从而增加丁二酸等以PEP作为前体的代谢产物的合成[20-21]。Tang等分别用半乳糖透性酶 (GalP) 和运动发酵单胞菌的Glf转运蛋白 (由基因编码) 代替大肠杆菌的PTS系统使丁二酸产量分别提高20%和41%[22]。PEP是辅酶Q合成必需的前体物质,当大肠杆菌在以葡萄糖作为唯一碳源的无机盐培养基中生长时,PTS系统会消耗50%可用的PEP。
本研究通过在大肠杆菌中引入外源基因,敲除内源八聚异戊二烯焦磷酸合成酶基因 (),初步构建稳定生产辅酶Q10的工程菌株。然后,在染色体水平用不同强度的人工调控元件对辅酶Q10合成途径的一系列关键基因进行调控 (图1),且尝试用的Glf转运蛋白代替大肠杆菌自身的PTS系统来增加辅酶Q10的产量,探索提高工程菌株中辅酶Q10产量的方法,为构建高产辅酶Q10的基因工程菌奠定基础。
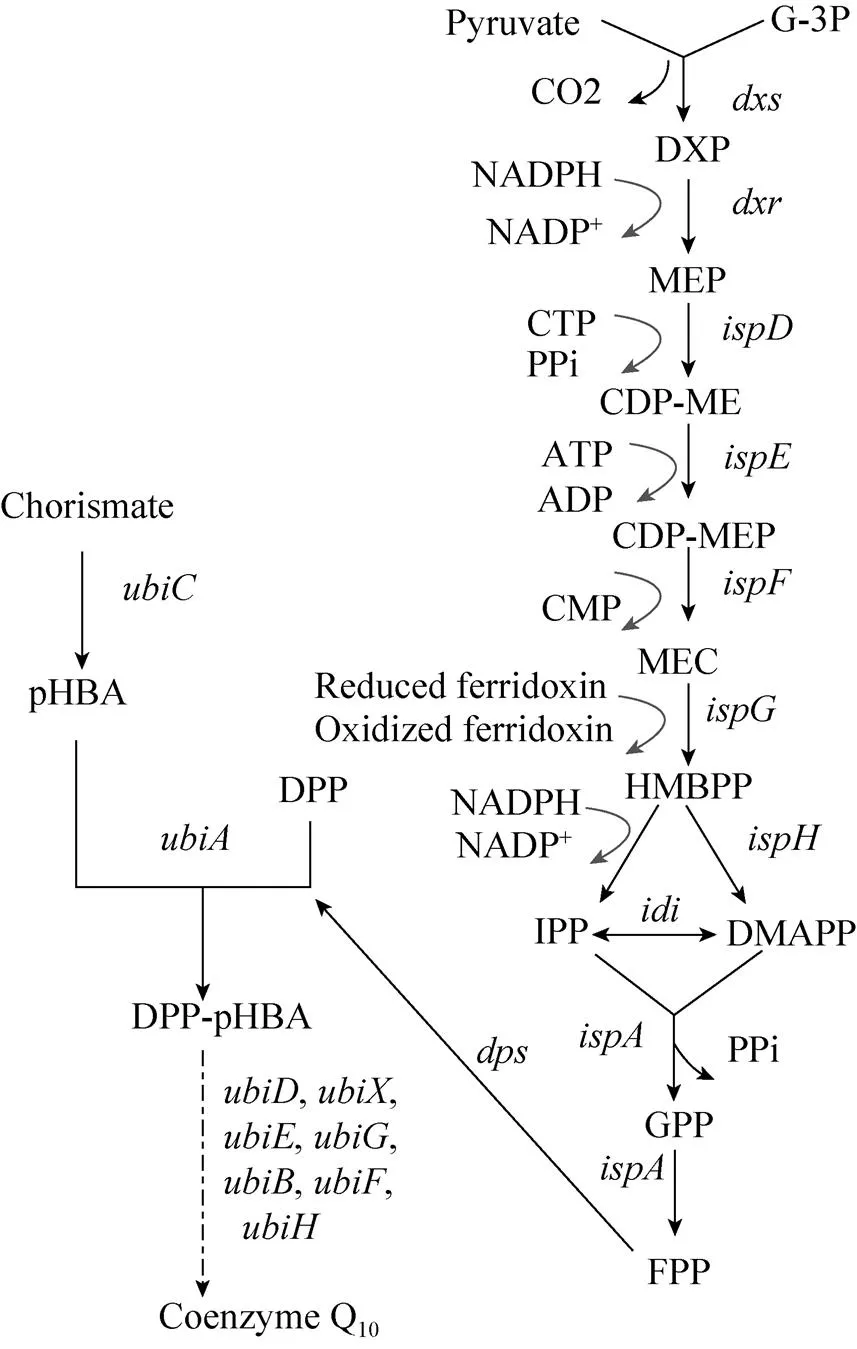
图1 通过引入外源dps基因在大肠杆菌中构建辅酶Q10的合成途径
1 材料与方法
1.1 材料
1.1.1 主要试剂
氨苄青霉素、氯霉素、硫酸卡那霉素购自上海生工生物工程有限公司;质粒小量快速提取试剂盒购自美国Axygen公司;DNA回收试剂盒购自美国Biomiga公司;PrimeSTAR HS DNA聚合酶,DNA marker trans2K plus购自大连宝生物工程公司;限制性内切酶Ⅰ、Ⅰ、Ⅰ、Ⅰ、Ⅰ、T4 DNA连接酶、快连酶、T4多聚核苷酸激酶购自NEB公司;辅酶Q10标品购自美国Sigma公司 (Cat. No. C9538);其他试剂均为分析纯。
1.1.2 仪器与设备
紫外可见分光光度计,Shimadzu UV-2550 spectrophotometer (Shimadzu,Kyoto,Japan); PCR扩增仪,Eppendorf Mastercycler gradient;全自动凝胶成像系统,AlphaImager HP;电转仪 MicroPulser;台式高速离心机,Eppendorf 5415D;高速冷冻离心机,Thermo Sorvall Evolution RC;高效液相色谱,Agilent Technologies Series 1200;离心浓缩仪,Labconco CentriVap 79840-11;7 L发酵罐,Labfors 4 (Infors Bio-technoligy Co. Ltd)。
1.1.3 菌株和质粒
本研究所用菌株见表1,本研究所用的质粒见表2。
1.2 方法
1.2.1 培养基及培养方法
LB培养基:1 L培养基包含10 g胰蛋白胨、5 g酵母提取物、5 g氯化钠;氨苄青霉素、氯霉素、硫酸卡那霉素终浓度分别为100、34、 50 μg/mL。LB固体培养基含1.5%的琼脂。
无盐蔗糖培养基:1 L培养基包含10 g胰蛋白胨、5 g酵母提取物和10%的蔗糖。无盐蔗糖固体培养基含1.5%的琼脂。
分批补料发酵培养基:1 L培养基中含10 g甘油、1.7 g柠檬酸、10.5 g KH2PO4·3H2O、 6 g (NH4)2HPO4、3.44 g MgSO4·7H2O、10 mL微量元素溶液。微量元素溶液的成分:1 L溶液中含10 g FeSO4·7H2O、5.25 g ZnSO4·7H2O、3.0 g CuSO4·5H2O、0.5 g MnSO4·4H2O、0.23 g Na2B4O7·10H2O、2.0 g CaC12、0.1 g (NH4)6Mo7O24。补料培养基:1 L培养基中含 500 g甘油、15 g蛋白胨、30 g酵母提取物、30 g MgSO4·7H2O。
好氧培养:将保存于–80 °C的菌种在LB平板上划线活化,挑取单菌落接种到15 mm× 100 mm试管 (含4 mL LB培养基) 中,37 °C、250 r/min过夜培养,1%的接种量转接到100 mL三角瓶 (10 mL LB培养基) 中,37 °C、250 r/min 培养24 h。收集菌液用于测定辅酶Q10含量。
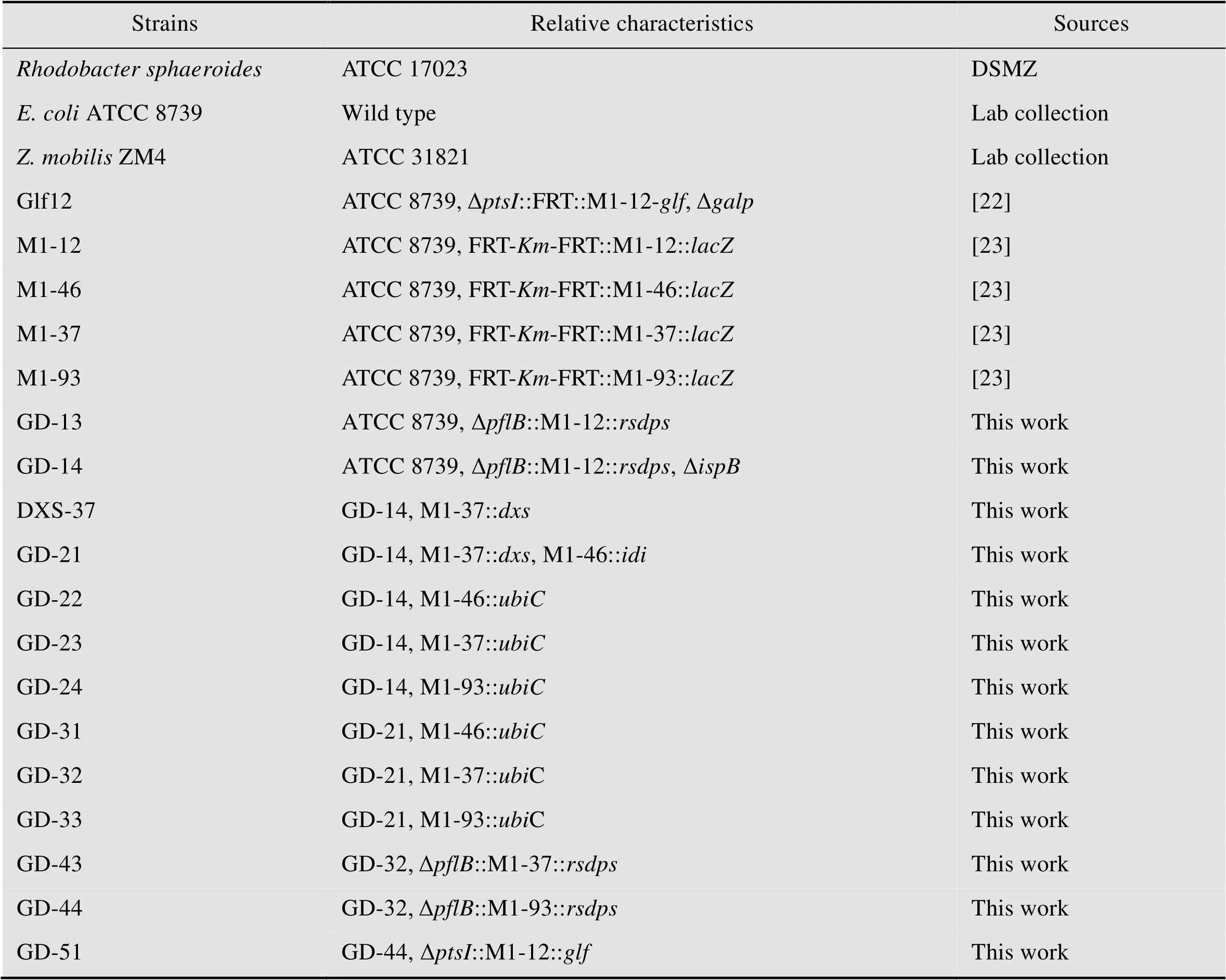
表1 本研究所用的菌株
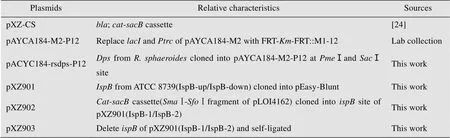
表2 本研究所用的质粒
1.2.2 表达外源基因的质粒构建
以类球红细菌的总DNA为模板,使用引物Rsdps-Ⅰ-up和Rsdps-Ⅰ- down (表3) 扩增的基因片段 ()。将纯化后的基因片段用Ⅰ和Ⅰ双酶切,质粒pACYC184-M2-P12用Ⅰ和Ⅰ双酶切,纯化后用Quick ligase DNA连接酶连接,转化trans10感受态细胞,在含有硫酸卡那霉素的LB平板上过夜培养。挑选单克隆,使用引物Km-F和Rsdps-349-r (表3) 进行PCR验证,验证正确的克隆提取质粒测序,将测序正确的质粒命名为pACYC184-rsdps-P12。
1.2.3 外源基因和基因的染色体整合
用一步同源重组法[23],将的基因整合到大杆菌ATCC 8739的位点。使用引物pflB-up-FRT和pflB-down-ter,以质粒pACYC184-rsdps-P12为模板,扩增DNA片段 (包括与插入位点同源的50 bp同源臂、基因和FRT--FRT::M1-12片段),将纯化后的片段电转入含有pKD46的ATCC 8739的感受态细胞中。在含有硫酸卡那霉素的LB平板过夜培养后,挑选单克隆,用引物Km-F和Rsdps-349-r进行PCR验证,验证正确的克隆命名为GD-13-Km。根据Datsenko描述的方法[25]去除GD-13-Km中的FRT--FRT,得到重组菌株GD-13。
来自的带有M1-12人工调控元件的基因的整合采用两步同源重组的方法。首先,使用引物ptsI-catsacB-up和ptsI-catsacB-down扩增出基因片段Ⅰ,进行第一步同源重组,将重组菌株GD-44的基因替换为基因簇。然后,以重组菌株Glf12[22]的DNA为模板,使用引物ptsI-up和ptsI-down (表3) 扩增DNA片段Ⅱ(包括插入位点同源片段和带有M1-12人工调控元件的基因) 进行第二步同源重组,将基因簇替换为带有M1-12人工调控元件的基因,得到菌株GD-51。
1.2.4 无痕基因敲除及基因调控
采用两步同源重组法,对基因进行敲除和调控,获得的重组菌株中无抗生素基因和FRT序列残留[26-27]。
采用两步同源重组的方法敲除重组菌株GD-13的基因[27],得到重组菌株GD-14。
使用不同强度的人工调控元件,采用两步同源重组的方法,对基因进行染色体水平调控。调控元件M1-12、M1-46、M1-37和M1-93的强度,分别是大肠杆菌诱导后启动子的0.1、1.7、2.5和5倍[23]。
对基因的调控,使用引物dxs-cat-up和dxs-sacB-down,以pXZ-CS[24]为模板,PCR扩增出基因片段Ⅰ,纯化后进行第一步同源重组,将菌株GD-14的基因的原始启动子替换为基因簇。使用引物dxs-up-p和dxs-RBS-down,以M1-37菌株的基因组DNA为模板[23],PCR扩增出含M1-37人工调控元件的DNA片段Ⅱ,进行第二步同源重组,将基因簇替换为人工调控元件M1-37,得到重组菌株DXS-37。
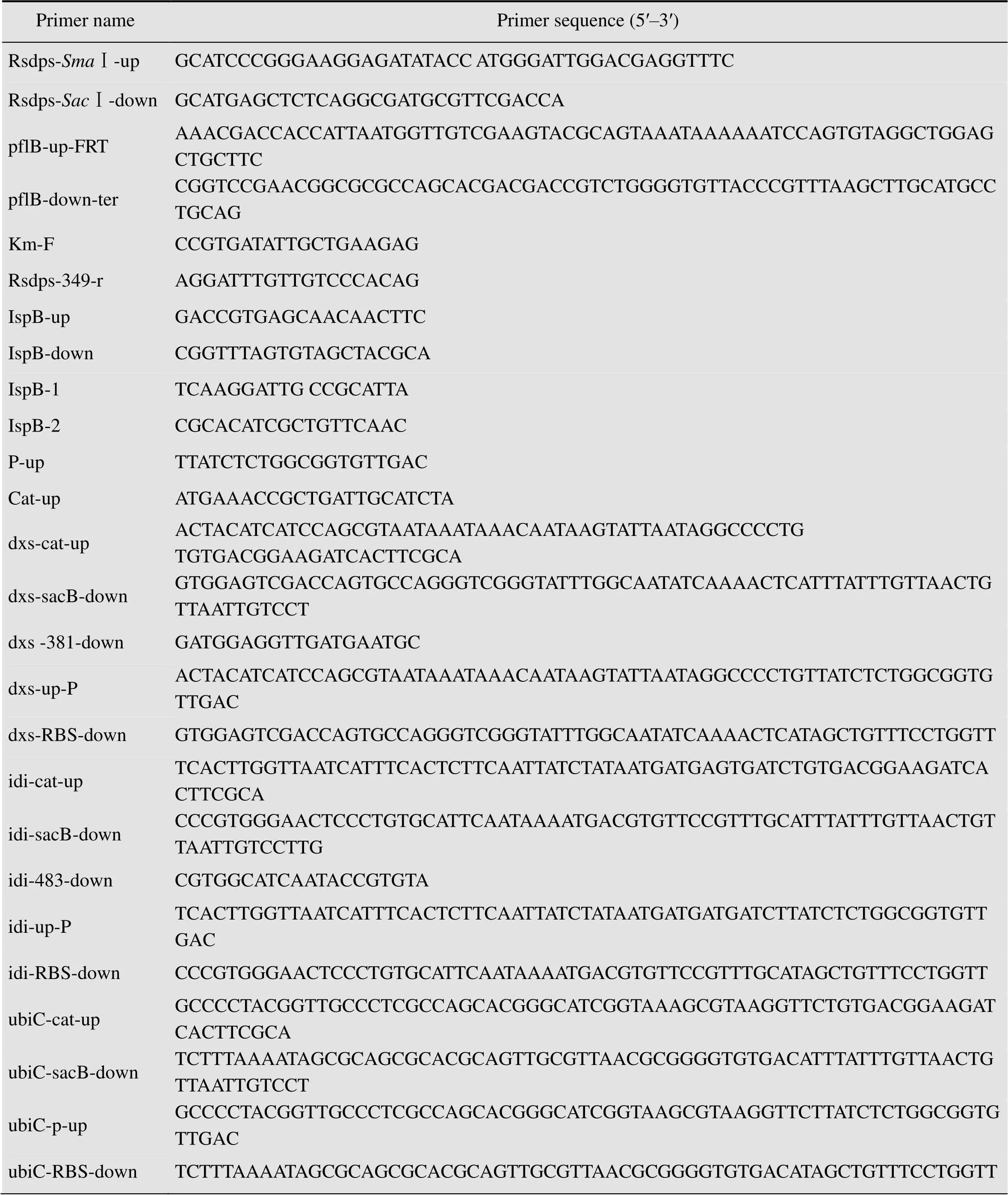
表3 本研究所用的引物
续表3

ubiC-365-rGATGTGAACAGATAGCGTCC pflB-up-catAAAACGACCACCATTAATGGTTGTCGAAGTACGCAGTAAATAAAAAATCCATGTGACGGAAGATCACTTCGCA p-down-sacBGGCTCAATTATATCAACGTTGTTATCTCTTGTCAACACCGCCAGAGATAATTATTTGTTAACTGTTAATTGTCCT pflB-up-PAAACGACCACCATTAATGGTTGTCGAAGTACGCAGTAAATAAAAAATCCATTATCTCTGGCGGTGTTGAC Rsdps-RBS-downTCGGCCGACAGCCGGTCGAGCGGCTTGGAGACGTTTTCGTTCATGCCCATAGCTGTTTCCTGGTT ptsI-catsacB-upTGTGGTGAGCTTGCTGGCGATGAACGTGCTACACTTCTGTTGCTGGGGATTGTGACGGAAGATCACTTCGCA ptsI-catsacB-downATGATCTTCTCCTAAGCAGTAAATTGGGCCGCATCTCGTGGATTAGCAGA TTATTTGTTAACTGTTAATTGTCCT ptsI-upCGCATTATGTTCCCGATGAT ptsI-downGCCTTTCAGTTCAACGGTGT
采用上述同样的方法对、和基因进行调控。
上述调控所用引物序列见表3,构建菌株见表1。
1.2.5 菌株GD-51的分批补料发酵
参照Zhao等的研究[17],将辅酶Q10产量最高的重组大肠杆菌GD-51在7 L发酵罐中进行分批补料发酵。发酵温度37 °C,空气流量4 L/min,溶氧控制在30%。在批次发酵阶段,为了使溶氧控制在30%,转速需与溶氧偶联,转速在400− 1 200 r/min之间变化。在溶氧反弹点 (初始碳源消耗完) 之后转速一直保持在1 200 r/min,采用模拟指数流加补料方式进行补料[28]。通过控制补料量使整个发酵过程甘油浓度保持在0.5 g/L以下,使用5 mol/L氨水将pH控制在7.0。
1.2.6 辅酶Q10产量的检测方法
参照Park等的研究[29],对菌体中的辅酶Q10进行提取和HPLC检测。每次取4 mL菌液,离心收菌,破碎细胞,用正己烷和正丙醇的混合液 (体积比5∶3) 萃取两次,用真空离心浓缩仪真空干燥,得到少量固体,加入无水乙醇溶解,使用HPLC检测辅酶Q10产量。因为辅酶Q10不能被完全萃取,用上述方法,在菌体中加不同浓度标准品,进行加标回收实验,得到的辅酶Q10回收率是60.4%,用来矫正辅酶Q10产量[29]。烘干菌体测得每升每600的培养物中含0.343 g干细胞,用以换算单位干细胞中辅酶Q10产量。
用高效液相色谱检测辅酶Q10产量。检测条件:DAD检测器,Symmetry C18色谱柱 (250 mm×4.6 mm,5 μm),流动相为无水乙醇,流速 0.8 mL/min,柱温30 °C,进样量20 μL,检测时间20 min,检测波长275 nm。每个待测样品分别有3个平行样,实验结果取自3个平行的平均值。用购自Sigma公司的辅酶Q10标准品构建辅酶Q10的标准曲线。
2 结果与分析
2.1 外源基因的表达
大肠杆菌本身没有合成辅酶Q10的能力,但是引入外源基因后,大肠杆菌就可以生产辅酶Q10。克隆s的基因,构建质粒pACYC184-rsdps-P12,并将其转入大肠杆菌ATCC 8739中,来合成辅酶Q10。
在转入质粒pACYC184-rsdps-P12的大肠杆菌中,检测到辅酶Q10的合成,辅酶Q10产量达到1.24 mg/L,单位细胞含量为0.68 mg/g DCW (表4),说明质粒pACYC184-rsdps-P12中s的基因可以表达、具有催化合成辅酶Q10的能力。
2.2 染色体整合外源基因并敲除内源基因
由于质粒表达不稳定,并且发酵时需要添加抗生素,因此将外源基因整合到大肠杆菌染色体上。同时,将大肠杆菌自身的基因敲除,以减少代谢副产物辅酶Q8的积累,同时达到提高辅酶Q10产量的目的。
将s的基因整合到ATCC 8739染色体上,得到重组菌株GD-13。然后,敲除内源基因,得到重组菌株GD-14。对菌株GD-13和GD-14进行发酵,并对辅酶Q10进行提取和HPLC检测。
分析HPLC检测色谱图 (图2),重组大肠杆菌GD-13既有辅酶Q10合成,又有辅酶Q8合成;敲除了内源基因后,只有辅酶Q10合成,与预期结果一致。
分析辅酶Q10产量 (表4),敲除基因,辅酶Q10产量有显著提高,GD-14的单位细胞含量与GD-13相比提高135%。说明敲除基因,可以阻止辅酶Q8的合成,从而提高辅酶Q10的产量,这与Choi等的研究结果一致[30]。

图2 辅酶Q10的HPLC检测色谱图

表4 染色体整合外源dps基因及敲除内源ispB基因后辅酶Q10的产量
aThree repeats were performed for each strain, and the error bars represented standard deviation.
2.3 调控MEP途径的关键基因
DPP是辅酶Q10合成的一个重要前体,调控MEP途径,可以增加IPP、DMAPP的供给,从而增加碳流向DPP的合成。Zhao等[17]的研究表明,调控MEP途径的关键基因和,可以显著提高β-胡萝卜素产量,而辅酶Q10侧链与β-胡萝卜素的合成有相同的前体,因此认为采用同样方法对和基因进行调控,可以有效提高辅酶Q10产量。
对MEP途径的和基因调控后得到重组菌株GD-21,其辅酶Q10产量为0.68 mg/L,单位细胞含量为0.53 mg/g DCW,与GD-14几乎一样 (图3)。这与Zhao等的研究不一致[17],推测可能另一前体物质pHBA供给不足限制了辅酶Q10的合成,或者基因表达量不足,即使细胞内有足够的前体物质IPP和DMAPP存在,也不能合成足够多的DPP,从而限制辅酶Q10的合成。
2.4 调控基因
pHBA是辅酶Q10合成的另一前体,在大肠杆菌中,由基因编码的分支酸-丙酮酸裂解酶催化合成。基因编码的对羟基苯甲酸-聚异戊二烯转移酶催化pHBA与聚异戊二烯焦磷酸的缩合是整个辅酶Q合成的限速酶。并且和处于同一个操纵子下,过表达可以显著增加辅酶Q10产量[19]。因此从GD-14出发,用3个强度的人工调控元件(M1-46、M1-37和M1-93) 对基因进行调控,得到菌株GD-22、GD-23和GD-24。
基因调控后,辅酶Q10产量均有提高,单位细胞含量与GD-14相比,分别提高105%、91%和117%,其中调控为M1-93的菌株GD-24辅酶Q10产量最高,达到1.41 mg/L,单位细胞含量为1.17 mg/g DCW (图3)。调控基因,可以有效提高Q10产量,说明大肠杆菌辅酶Q10的整个合成途径中对羟基苯甲酸的供给以及其与DPP的缩合是关键的限速步骤。
2.5 组合调控MEP途径和基因
调控后,MEP途经的IPP和DMAPP供给可能成为辅酶Q10合成的限速步骤。为了验证这一点,对MEP途经和基因进行组合调控。将菌株GD-21的基因的原始启动子调控为人工调控元件M1-46、M1-37和M1-93,得到重组菌株GD-31、GD-32和GD-33。
MEP途经和基因组合调控后,辅酶Q10产量均有显著提高,单位细胞含量与GD-21相比分别提高210%、217%和174%,与GD-22、GD-23和GD-24相比分别提高50%、64%和25% (图3)。菌株GD-32的产量最高,其辅酶Q10产量为1.94 mg/L,1.70 mg/g DCW。说明调控后,IPP和DMAPP前体供应成了另一个限制因素,只有同时充分供给两个前体物质,才能使辅酶Q10产量更高。
2.6 调控基因
由于在大肠杆菌染色体上只整合了一个拷贝且带有相对低强度调控元件(M1-12) 的基因,十聚异戊二烯焦磷酸合成酶表达不足可能限制辅酶Q10的合成。为了进一步提高辅酶Q10的产量,分别用人工调控元件M1-37和M1-93组合调控菌株GD-32的基因,得到菌株GD-43和GD-44。
基因调控为M1-93的菌株GD-44辅酶Q10产量最高,产量达2.21 mg/L,单位细胞含量达1.87 mg/g DCW,与GD-32相比增加10% (表5)。基因调控后产量增加不明显,然而据Zhao等的研究[17],调控和基因后,β-胡萝卜素产量达18.40 mg/g DCW,如果合成β-胡萝卜素的前体IPP和DMAPP全部用来合成辅酶Q10,理论上应该达到约23.67 mg/g DCW,可能目前DPP并不是辅酶Q10合成的限制因素,pHBA的供给不足或者下游醌环修饰途径的酶表达不够等限制了辅酶Q10的合成。
2.7 引入的基因
为了增加PEP的供给从而提高辅酶Q10的产量,将来自的带有M1-12人工调控元件的基因插入重组大肠杆菌GD-44的位点,敲除大肠杆菌自身的PTS系统,既减少PEP的消耗,又保证葡萄糖转运。
引入的带有M1-12人工调控元件的基因,得到菌株GD-51,其辅酶Q10单位细胞含量与GD-44相比增加16% (表5)。说明通过引入的Glf转运蛋白,可以进一步增加辅酶Q10的产量。
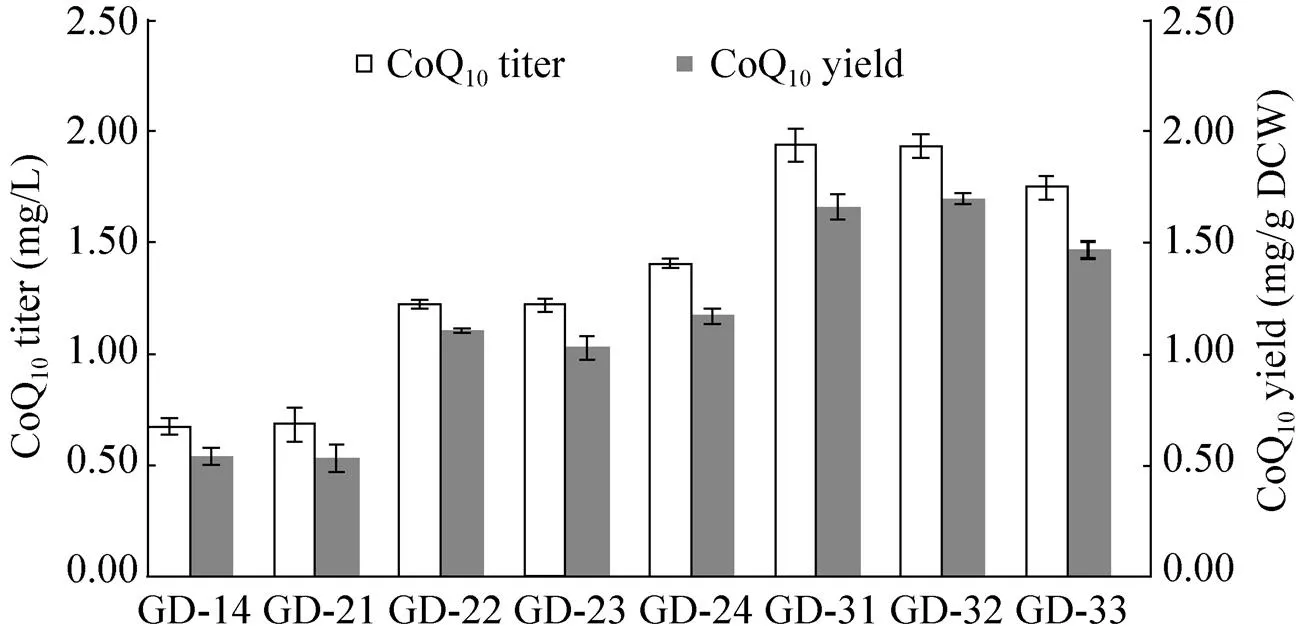
图3 调控MEP途径和ubiCA基因后重组大肠杆菌的辅酶Q10产量

表5 调控dps基因和引入外源glf基因后重组大肠杆菌的辅酶Q10产量
aThree repeats were performed for each strain, and the error bars represented standard deviation.
2.8 菌株GD-51的分批补料发酵
对高产辅酶Q10的重组菌株GD-51在7 L发酵罐中,进行分批补料发酵。在批次发酵阶段,转速与溶氧偶联,溶氧稳定在30%左右。第10 h,初始碳源消耗完,溶氧反弹,开始补料发酵。首先,采用模拟指数流加的补料策略,补料3.5 h,补料量指数增加 (15.7−26.1 mL/h)。如果持续指数流加策略,则会营养过剩,产生过量乙酸从而影响细胞生长。因此,13.5 h之后采用26.1 mL/h的速度恒速补料。细胞在47 h进入稳定期,为了减少副产物乙酸的积累,发酵后期从60 h至 78 h,阶段性的降低补料速度 (图4)。
发酵周期是78 h,最高的600是118,干重为41.6 g/L,辅酶Q10产量最高达433 mg/L,单位细胞辅酶Q10含量达11.7 mg/g DCW (图5)。与摇瓶发酵相比,分批补料发酵使重组菌株GD-51的600增加约31倍,辅酶Q10单位细胞含量提高约4.4倍,这说明分批补料发酵,既可以增加细胞量还可以提高辅酶Q10产量。推测认为,与摇瓶实验相比,分批补料发酵能很好地限制碳源的供给,降低代谢副产物乙酸的积累。另外,发酵过程中控制pH在7.0,搅拌增加溶氧等为细胞提供了合适的生长条件。这些因素导致分批补料发酵时辅酶Q10的单位细胞产量大于摇瓶实验。

图4 分批补料发酵GD-51菌株过程中甘油浓度、溶氧和补料速度的变化

图5 分批补料发酵GD-51菌株,生物量以及辅酶Q10产量的变化
3 结论
本研究在大肠杆菌中引入外源基因,敲除内源基因,然后分别对MEP途径的和基因以及基因进行调控,发现只有辅酶Q10的两个前体DPP和pHBA同时供给充足,才能使辅酶Q10产量更高。另外,首次用的Glf转运蛋白代替大肠杆菌自身的PTS系统,使辅酶Q10产量进一步提高,证明构建非PTS葡萄糖转运系统这一策略可用于提高PEP供给从而提高辅酶Q10的生产。
REFERENCES
[1] Meganathan R. Ubiquinone biosynthesis in microorganisms. FEMS Microbiol Lett, 2001, 203(2): 131–139.
[2] Fleischmann RD, Adams MD, White O, et al. Whole-genome random sequencing and assembly ofRd. Science, 1995, 269(5223): 496–512.
[3] Jeya M, Moon HJ, Lee JL, et al. Current state of coenzyme Q10production and its applications. Appl Microbiol Biotechnol, 2010, 85(6): 1653–1663.
[4] Ohnuma S, Koyama T, Ogura K. Purification of solanesyl-diphosphate synthase from. J Biol Chem, 1991, 266(35): 23706–23713.
[5] Lass A, Sohal RS. Electron transport-linked ubiquinone-dependent recycling of α-tocopherol inhibits autooxidation of mitochondrial membranes. Arch Biochem Biophys, 1998, 352(2): 229–236.
[6] Yoshida Y, Hayakawa M, Habuchi Y, et al. Evaluation of the dietary effects of coenzyme Qby the oxidative stress marker, hydroxyoctadecadienoic acid and its stereoisomer ratio. BBA-Gen Subjects, 2006, 1760(10): 1558–1568.
[7] Martin SF, Bur NI, Espinosa JC, et al. Coenzyme Q and protein/lipid oxidation in a BSE-infected transgenic mouse model. Free Radical Bio Med, 2007, 42(11): 1723–1729.
[8] Littarru GP, Tiano L. Clinical aspects of coenzyme Q10: an update. Curr Opin Clin Nutr, 2005, 8(6): 641–646.
[9] Singh RB, Wander GS, Rastogi A, et al. Randomized, double-blind placebo-controlled trial of coenzyme Q10in patients with acute myocardial infarction. Cardiovasc Drug Ther, 1998, 12(4): 347–353.
[10] Hodgson JM, Watts GF, Playford DA, et al. Original Communication Coenzyme Q10improves blood pressure and glycaemic control: a controlled trial in subjects with type 2 diabetes. Eur J Clin Nutr, 2002, 56(11): 1137–1142.
[11] Shults CW, Oakes D, Kieburtz K, et al. Effects of coenzyme Q10in early Parkinson disease: evidence of slowing of the functional decline. Arch Neurol, 2002, 59(10): 1541–1550.
[12] Yang X, Dai G, Li G, et al. Coenzyme Q10reduces β-amyloid plaque in an APP/PS1 transgenic mouse model of Alzheimer’s disease. J Mol Neurosci, 2010, 41(1): 110–113.
[13] Inui M, Ooe M, Fujii K, et al. Mechanisms of inhibitory effects of CoQ10on UVB-induced wrinkle formationand. Biofactors, 2008, 32(1): 237–243.
[14] Zahiri HS, Yoon SH, Keasling JD, et al. Coenzyme Q10production in recombinantstrains engineered with a heterologous decaprenyl diphosphate synthase gene and foreign mevalonate pathway. Metab Eng, 2006, 8(5): 406–416.
[15] Takahashi S, Nishino T, Koyama T. Isolation and expression ofdecaprenyl diphosphate synthase gene for production of ubiquinone-10 in. Biochem Eng J, 2003, 16(2): 183–190.
[16] Cluis CP, Ekins A, Narcross L, et al. Identification of bottlenecks inengineered for the production of CoQ10. Metab Eng, 2011, 13(6): 733–744.
[17] Zhao J, Li Q, Sun T, et al. Engineering central metabolic modules offor improving β-carotene production. Metab Eng, 2013, 17: 42–50.
[18] Kim SJ, Kim MD, Choi JH, et al. Amplification of 1-deoxy-D-xyluose-5-phosphate (DXP) synthase level increases coenzyme Q10production in recombinant. Appl Microbiol Biotechnol, 2006, 72(5): 982–985.
[19] Zhang D, Shrestha B, Li Z, et al. Ubiquinone-10 production usinggene inby coexpression system. Mol Biotechnol, 2007, 35(1): 1–14.
[20] Yi J, Draths KM, Li K, et al. Altered glucose transport and shikimate pathway product yields in. Biotechnol Prog, 2003, 19(5): 1450–1459.
[21] Zhang X, Jantama K, Shanmugam KT, et al. Reengineeringfor succinate production in mineral salts medium. Appl Environ Microbiol, 2009, 75(24): 7807–7813.
[22] Tang J, Zhu X, Lu J, et al. Recruiting alternative glucose utilization pathways for improving succinate production. Appl Microbiol Biotechnol, 2013, 97(6): 2513–2520.
[23] Lu J, Tang J, Liu Y, et al. Combinatorial modulation ofandgene expression for improved alternative glucose utilization. Appl Microbiol Biotechnol, 2012, 93(6): 2455–2462.
[24] Tan Z, Zhu X, Chen J, et al. Activating phosphoenolpyruvate carboxylase and phosphoenolpyruvate carboxykinase in combination for improvement of succinate production. Appl Environ Microbiol, 2013, 79(16): 4838–4844.
[25] Datsenko KA, Wanner BL. One-step inactivation of chromosomal genes inK-12 using PCR products. Proc Natl Acad Sci USA, 2000, 97(12): 6640–6645.
[26] Shi A, Zhu X, Lu J, et al. Activating transhydrogenase and NAD kinase in combination for improving isobutanol production. Metab Eng, 2013, 16: 1–10.
[27] Zhang X, Jantama K, Moore JC, et al. Production of L-alanine by metabolically engineered. Appl Microbiol Biotechnol, 2007, 77(2): 355–366.
[28] Li L. Enhanced production of recombinant formate dehydrogenase with pseudo-exponential Fed-batch cultivation [D]. Hangzhou:Zhejiang University, 2010 (in Chinese).李丽. 拟指数流加补料高密度培养重组产甲酸脱氢酶 [D]. 杭州: 浙江大学, 2010.
[29] Park YC, Kim SJ, Choi JH, et al. Batch and fed-batch production of coenzyme Q10in recombinantcontaining the decaprenyl diphosphate synthase gene from. Appl Microbiol Biotechnol, 2005, 67(2): 192–196.
[30] Choi JH, Ryu YW, Seo JH. Biotechnological production and applications of coenzyme Q10. Appl Microbiol Biotechnol, 2005, 68(1): 9–15.
(本文责编 陈宏宇)
Production of coenzyme Q10by metabolically engineered
Guanping Dai1,2,3, Liangtian Miao1,2,3, Tao Sun1,2,3, Qingyan Li2,3, Dongguang Xiao1, and Xueli Zhang2,3
1,,300457,2,,300308,3,,300308,
Coenzyme Q10(CoQ10) is a lipophilic antioxidant that improves human immunity, delays senility and enhances the vitality of the human body and has wide applications in pharmaceutical and cosmetic industries. Microbial fermentation is a sustainable way to produce CoQ10, and attracts increased interest. In this work, the native CoQ8synthetic pathway ofwas replaced by the CoQ10synthetic pathway through integrating decaprenyl diphosphate synthase gene () frominto chromosome ofATCC 8739, followed by deletion of the native octaprenyl diphosphate synthase gene (). The resulting strain GD-14 produced 0.68 mg/L CoQ10with a yield of 0.54 mg/g DCW. Modulation ofandgenes of the MEP pathway andgenes in combination led to 2.46-fold increase of CoQ10production (from 0.54 to 1.87 mg/g DCW). Recruiting glucose facilitator protein ofto replace the native phosphoenolpyruvate: carbohydrate phosphotransferase systems (PTS) further led to a 16% increase of CoQ10yield. Finally, fed-batch fermentation of the best strain GD-51 was performed, which produced 433 mg/L CoQ10with a yield of 11.7 mg/g DCW. To the best of our knowledge, this was the highest CoQ10titer and yield obtained for engineered.
CoQ10, homologus recombination, modulation of gene expression,
April 8, 2014; Accepted: May 12, 2014
Xueli Zhang. Tel/Fax: 86-22-84861983; E-mail: zhang_xl@tib.cas.cn Qingyan Li. Tel/Fax: 86-22-84861946; E-mail: li_qy@tib.cas.cn
Supported by:Tianjin Key Technology R&D Program of Tianjin Municipal Science and Technology Commission (No. 12ZCZDSY14700), National High Technology Research and Development Program of China (863 Program) (No. 2012AA02A704), National Natural Science Foundation of China (No. 31100047), the Hundred Talent Program of the Chinese Academy of Sciences.
天津市科技支撑计划重点项目(No. 12ZCZDSY14700),国家高技术研究发展计划(863计划) (No. 2012AA02A704),国家自然科学基金(No. 31100047),中国科学院百人计划资助。

