牛杀菌/通透性增加蛋白对脂多糖介导的炎性细胞因子表达的影响
姚楠,白杰,张雪梅,张宁,吴卫东,李文蓉
牛杀菌/通透性增加蛋白对脂多糖介导的炎性细胞因子表达的影响
姚楠1,2,4*,白杰1,3*,张雪梅1,张宁1,吴卫东2,李文蓉1
1 农业部草食家畜遗传育种与繁殖重点实验室新疆维吾尔自治区动物生物技术重点开放实验室新疆维吾尔自治区畜牧科学院生物技术研究中心,新疆乌鲁木齐 830000 2 新疆维吾尔自治区人民医院临床医学研究中心,新疆乌鲁木齐 830000 3 河南省农业科学院畜牧兽医研究所,河南郑州 450002 4 新疆维吾尔自治区克拉玛依市人民医院,新疆克拉玛依 834000

姚楠, 白杰, 张雪梅, 等. 牛杀菌/通透性增加蛋白对脂多糖介导的炎性细胞因子表达的影响. 生物工程学报, 2015, 31(2): 195-205.Yao N, Bai J, Zhang XM, et al. Effects on the expression of lipopolysaccharide-induced inflammatory cytokines mediated by bovine bactericidal/permeability-increasing protein. Chin J Biotech, 2015, 31(2): 195-205.
杀菌/通透性增加蛋白 (Bactericidal/permeability-increasing protein, BPI) 能结合并特异地中和来自革兰氏阴性菌外膜的脂多糖 (Lipopolysaccharide, LPS)。为了研究牛源BPI蛋白及其 N端结构域在LPS介导的免疫应答中的作用,本文将全长1 449 bp编码区序列 () 和其N端714 bp的编码区序列 () 分别导入mHEK293细胞,分析了稳定表达的BPI或BPI714对LPS介导的炎性细胞因子表达的影响。首先将构建的pLEX-BPI/pLEX-BPI714载体分别转染mHEK293细胞,获得稳定表达牛源BPI或BPI714的mHEK293细胞;然后用LPS刺激上述细胞,分别收集刺激前、刺激后1 h、3 h、6 h、12 h、24 h、36 h和48 h的细胞,并同时收集未表达BPI或BPI714的 mHEK293细胞在各时间点的样品作为对照;采用定量RT-PCR检测上述细胞中炎性细胞因子的相对表达水平,比较LPS刺激前后表达BPI/BPI714和对照细胞中上述基因转录水平的变化规律。研究表明,LPS刺激后,对照细胞中表达水平在不同时间点均显著提高 (<0.05),并呈现规律性变化;而稳定表达BPI/BPI714的细胞在同样刺激条件下,基因的转录水平均未发生显著变化 (>0.05)。根据我们的实验结果,在mHKE293细胞模型中BPI或BPI714均能显著降低LPS介导的炎性细胞因子表达,抑制LPS介导的免疫应答。这不仅为进一步研究BPI抑菌机制和利用其抑菌功能提供了可靠的实验依据,也为分析抗菌蛋白的抗菌效果提供了一种可靠的实验方法。
杀菌/通透性增加蛋白,脂多糖,免疫应答,炎性细胞因子
在人和动物生活的环境中存在着大量的革兰氏阴性菌,脂多糖 (Lipopolysaccharide, LPS) 是革兰氏阴性菌菌膜的组成部分。在革兰氏阴性菌侵入动物机体后,LPS被机体的天然免疫系统TLR识别,当机体检测到LPS的入侵信号后,在转录因子家族 (Nuclear factor-κ-gene binding,) 的调控下,白介素8 (Interleukin- 8,)、白介素1β (Interleukin-1β,) 和肿瘤坏死因子α (Tumor necrosis factor-α,) 等促炎症因子的表达水平都急剧增加,产生清除病原菌的免疫反应[1-2]。杀菌/通透性增加蛋白(Bactericidal/permeability-increasing protein,) 是机体在免疫反应中释放的免疫分子,它与LPS有很高的亲和能力,可以特异地中和LPS,对革兰氏阴性菌有强烈的细胞毒性效应[3-4]。
基因最初是在人中性粒细胞中发现[5],嗜酸性粒细胞也有低水平的表达[6]。随着研究的深入,在人胃肠道上皮细胞[7]、皮肤成纤维细 胞[8]、泪腺管上皮细胞[9]、生殖道上皮细胞[10]中都检测到BPI的转录和表达。牛源BPI蛋白研究相对较少,目前主要集中在基因多态性对基因功能的影响及BPI体外表达后抑菌功能的研究,对牛BPI抑菌机制的研究还未见报道。
本实验将牛源的基因转入到mHEK293 (该细胞系由白杰等[11]参考Sauter等[12]的方法,将牛源的基因转染到HEK293细胞后,该细胞系具有了免疫应答能力,是研究牛天然免疫反应的细胞模型) 细胞中进行表达,期望了解LPS介导的炎症反应发生时,基因稳定表达对炎性细胞因子转录表达的影响。此外,研究显示人源BPI与LPS结合的核心区域位于BPI蛋白N端。因此,本研究克隆获得了牛源基因CDS全长及N端的编码序列,开展了二者对LPS介导的炎症反应影响的研究。本研究有助于了解牛源的抗菌机理,为进一步利用其抗菌活性,降低奶牛乳腺炎的发病率,提高牛奶食用的安全性提供理论和实验依据。
1 材料与方法
1.1 材料
1.1.1 载体、菌种及细胞
DH5α感受态细胞购自北京天根公司;pMD20-T载体购自TaKaRa公司;pLEX-MCS慢病毒表达载体及其包装质粒pMD2G、pSPAX购自Openbiosystem公司;用于生产重组慢病毒的293T包装细胞购自ATCC公司。包含牛源基因的mHEK293细胞系由新疆畜牧科学院动物生物技术中心提供。
1.1.2 酶及主要试剂
限制性内切酶HⅠⅠ购自Fermentas公司;T4 DNA连接酶、PrimeSTAR®HS DNA Polymerase 购自宝生物工程 (大连) 有限公司;Trizol试剂和Lipofectamine™ 2000试剂购自Invitrogen公司;DMEM培养基和胎牛血清购自GIBCO公司;HA抗体购自北京天根公司;荧光二抗购自LI-COR公司;QuantiTect SYBR GreenⅠ试剂购自QIAGEN公司。其他试剂为国产分析纯。
1.2 牛BPI/BPI714基因表达载体的构建
根据基因的mRNA序列 (NM_173895.2),设计用于扩增牛基因N端序列 (大小为714 bp) 的一对PCR引物,上、下游引物分别引入HⅠ和Ⅰ酶切位点,下划线部分为HA标签序列。同时设计另一对引物用以扩增全长CDS序列 (大小为1 449 bp),引物也分别引入HⅠ和Ⅰ酶切位点,下划线部分为HA标签序列 (序列详见表1)。用荷斯坦牛血样2.5 mL提取总RNA,取1 µg RNA反转录成cDNA。目的片段的PCR扩增体系为:cDNA 2 μL,10×缓冲液2 μL,25 mmol/L MgCl21.5 μL,10 mmol/L dNTPs 2 μL,前述上下游引物各 10 pmol/L,1.25 U PrimeSTAR®HS DNA聚合酶,超纯水补足到20 μL。PCR反应条件:95 ℃预变性5 min;95 ℃变性30 s,65 ℃ (降低2 ℃/2循环) 退火40 s以及72 ℃延伸100 s,共16个循环;然后95 ℃变性30 s,51 ℃退火40 s以及72 ℃延伸100 s共19个循环;最后72 ℃延伸5min,琼脂糖凝胶电泳检测。目的片段和pLEX-MCS载体分别用HⅠ和Ⅰ双酶切,回收酶切产物进行克隆,经酶切和测序鉴定正确的重组质粒分别命名为pLEX-BPI和pLEX-BPI714。
1.3 稳定表达牛BPI和BPI N端的mHEK293细胞的获得
1.3.1 BPI、BPI714重组慢病毒的制备
采用磷酸钙方法分别将pLEX-BPI /pLEX-BPI714质粒、包装质粒和包膜质粒共转染到293T细胞中,分别获得携带和基因的重组病毒。步骤如下:293T细胞于10 cm培养皿培养,细胞汇合度达到70%−80%时进行转染。转染试剂包括pLEX-BPI/pLEX-BPI714质粒20 µg,包装质粒pSPAX 15 µg、pMD2G 6 µg,去离子水补足500 μL,加入2 × HBS (0.273 mol/L NaCl,10 µmol/L KCl,1.4 µmol/L Na2HPO4, 42 µmol/L 4-羟乙基哌嗪乙磺酸及10 µmol/L葡萄糖,pH 7.05) 500 μL,2.5 mol/L CaCl2溶液50 µL。室温孵育20 min后,将混合液均匀滴加至生长293T细胞培养基中。12−14 h后更换新鲜培养基,48 h后收获含病毒颗粒的细胞培养液,分装保存于−70℃备用。
1.3.2稳定表达BPI/BPI714 mHEK293细胞的构建及鉴定
将pLEX-BPI/pLEX-BPI714重组慢病毒感染mHEK293细胞。步骤如下,在6孔板每孔各铺3×105个mHEK293细胞。当细胞汇合度达到70%时,将pLEX-BPI/pLEX-BPI714重组慢病毒0.5 mL和DMEM培养液0.5 mL混合,同时加入聚凝胺 (Polybrene) 10 µg,16 h换液后继续培养48 h,在培养基中添加600 ng/mL的嘌呤霉素进行筛选,获得表达牛源基因的细胞系mHEK293-BPI和mHEK293-BPI714。
BPI/BPI714基因在mHEK293中的表达鉴定。分别收集mHEK293-BPI和mHEK293-BPI714细胞,裂解后取40 µg总蛋白按文献[13]进行Western blotting分析,其中一抗为1∶5 000小鼠抗HA抗体。
1.4 稳定表达BPI基因对LPS介导的炎性细胞因子表达的影响
6孔板中分别培养3×105个/孔稳定表达BPI/BPI714和未表达BPI/BPI714的mHEK293细胞,当细胞汇合度达到70%时,添加LPS (终浓度100 ng/mL),分别收集实验组和对照组0、1、3、6、12、24、36和48 h共8个时间点的细胞。为保证实验结果准确,每个时间点均设平行样品。通过定量RT-PCR检测上述细胞中相关炎性细胞因子相对表达量的变化。
1.5 实时定量RT-PCR检测细胞炎性细胞因子的转录水平
1.5.1 标准曲线的制备
使用标准曲线相对定量法对基因mRNA水平进行定量RT-PCR分析。首先分别制备目的基因的标准品。针对人、、、、和基因,设计相应的跨内含子引物 (表1)。将PCR获得的目的片段克隆至pMD-20-T载体,使用RⅠ内切酶获得线性化质粒。经DNA纯化试剂盒 (QIAGEN) 纯化线性化质粒DNA,梯度稀释至1 ng/μL、100 pg/μL、10 pg/μL、1 pg/μL、100 fg/μL、10 fg/μL、1 fg/μL共7个浓度作为标准品。使用QuantiTect SYBR Green Ⅰ试剂进行定量RT-PCR,生成标准曲线。

表1 基因克隆及定量RT-PCR检测的引物序列
The underlined sequences are the HA peptide tag sequences.
1.5.2 样本的制备及实时定量PCR检测
用Trizol提取实验组和对照组的不同时间点细胞样品总RNA,取1 µg总RNA反转录成cDNA,取2 µL cDNA进行定量RT-PCR,选择作为内参基因。反应程序均为:95 ℃ 15 min,55个循环:95 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s。溶解曲线:99 ℃ 10 s,40 ℃ 15 s,99 ℃0.1 ℃/s,降温至40 ℃ 30 s。反应体系:2×Master mix 10 µL;上下游引物 (10 pmol/L) 1 µL;cDNA 2 µL;无RNA酶超纯水 7 µL。每个样本重复3次。
1.5.3 统计分析
使用SPSS13.0软件进行数据的方差分析。当结果显示表达差异显著时 (<0.05),在图上用不同字母a、b、c表示;当结果显示表达差异不显著时 (>0.05),在图上用相同字母表示。
2 结果与分析
2.1 BPI/BPI714慢病毒表达载体的构建
以荷斯坦牛血样总RNA的反转录产物cDNA为模板进行PCR扩增,分别获得1 449 bp和714 bp的CDS全长和N端目的片段。随即分别将目的片段克隆到pLEX-MCS表达载体,经双酶切鉴定后,对重组质粒测序。测序结果显示,获得的目的片段序列正确,且基因序列准确插入载体的预定位置。
2.2 获得稳定表达BPI的mHEK293细胞系
将携带牛源BPI/BPI714的重组病毒感染mHEK293细胞,获得稳定表达BPI/BPI714的mHEK293细胞,Western blotting检测BPI/BPI714在细胞中的表达情况。结果显示,在55 kDa和25 kDa标准分子量附近有特异的目的蛋白,说明BPI/BPI714在mHEK293细胞中表达 (图1)。
2.3 稳定表达的BPI/BPI714对LPS诱导的炎性细胞因子表达的影响
为了研究重组BPI/BPI714蛋白对LPS介导的炎性细胞因子的影响,以稳定表达BPI/BPI714 mHEK239细胞为细胞模型,用LPS分别刺激BPI/BPI714 mHEK239的实验组细胞和不表达BPI/BPI714的mHEK239对照组细胞,分析不同细胞经LPS诱导后炎症因子表达的变化。分别收集LPS刺激前、刺激后不同时间点的实验组和对照组细胞,制备细胞总RNA进行反转录,获得相应cDNA。通过实时定量RT-PCR检测实验组和对照组各个时间点细胞的炎症因子、和以及转录因子和共5个基因转录水平的相对表达量。
2.3.1 稳定表达的BPI/BPI714对LPS诱导的基因表达水平的影响
对于没有表达BPI或BPI714mHEK293细胞,LPS刺激6 h后,基因的相对转录水平升高 (<0.05),随后下降至与对照差异不显著,之后的时间点其表达量虽有小幅波动,但均与刺激前差异不显著。相比,无论表达BPI或BPI714,LPS刺激1 h后表达BPI/BPI714的细胞中基因的相对转录水平均显著升高 (>0.05),随后下降,之后各时间点基因表达量和刺激前相比,差异均不显著 (>0.05) (图2)。
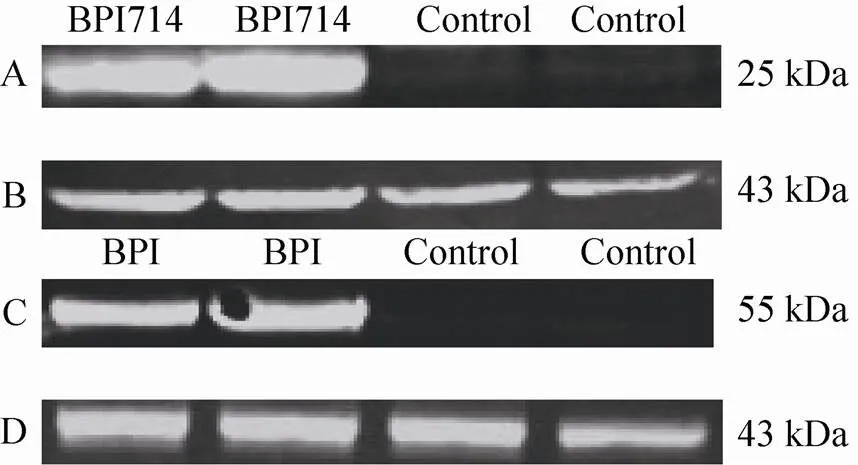
图1 Western blotting检测重组蛋白BPI /BPI714的表达

图2 LPS刺激前后稳定表达BPI/BPI714和未表达BPI/BPI714的mHEK293细胞中IL-1β基因的相对表达水平
2.3.2 稳定表达的BPI/BPI714对LPS诱导的基因表达水平的影响
LPS刺激1 h后,没有表达BPI或BPI714的mHEK293细胞中基因的相对转录水平迅速升高 (<0.05),随后的时间点逐渐下降,并在36 h后降到与对照差异不显著。而表达BPI和BPI714的细胞在LPS刺激后,基因的相对转录水平相比LPS刺激前没有显著变化 (>0.05) (图3)。

图3 LPS刺激前后稳定表达BPI/BPI714和未表达BPI/BPI714的mHEK293细胞中TNF-α基因的相对表达水平
2.3.3 稳定表达的BPI/BPI714对LPS诱导的基因表达水平的影响
LPS刺激1 h后,没有表达BPI或BPI714的mHEK293细胞中基因的相对转录水平即显著升高 (<0.05),到3 h达到最高点,而后逐渐下降,刺激36和48 h后基因转录表达与刺激前相比无显著变化 (>0.05)。与表达BPI或BPI714的细胞相比,基因的相对转录水平在LPS刺激前后没有显著变化 (>0.05) (图4)。
2.3.4 稳定表达的BPI/BPI714对LPS诱导的基因表达水平的影响
没有表达BPI或BPI714的mHEK293细胞在LPS刺激后1 h、3 h和6 h,基因的相对转录水平迅速、持续升高,维持较高的转录表达水平,与刺激前相比,差异显著 (<0.05)。LPS刺激12 h时,基因表达水平下降至刺激前水平 (>0.05),刺激24 h时其表达水平再次升高,较LPS刺激前的表达水平差异显著,随后在36 h和48 h又恢复到刺激前的表达水平 (>0.05)。与此同时,表达BPI和BPI714的mHEK293细胞,其基因相对转录水平LPS刺激前和刺激后没有显著变化 (>0.05) (图5)。
2.3.5 稳定表达的BPI/BPI714对LPS诱导的基因表达水平的影响
在没有表达BPI或BPI714的mHEK293细胞中,LPS刺激后基因的转录表达升高,在刺激后3 h的表达量与刺激前相比差异显著,然后逐渐下降,并在刺激12 h后表达水平降低至刺激前的表达水平。在表达BPI和BPI714的细胞中,的相对转录水平在LPS刺激1 h时升高,与刺激前显著差异;随后下降,刺激3 h、6 h后基因转录水平降至刺激前的表达水平;之后表达量持续下降,显著低于刺激前的表达水平 (图6)。
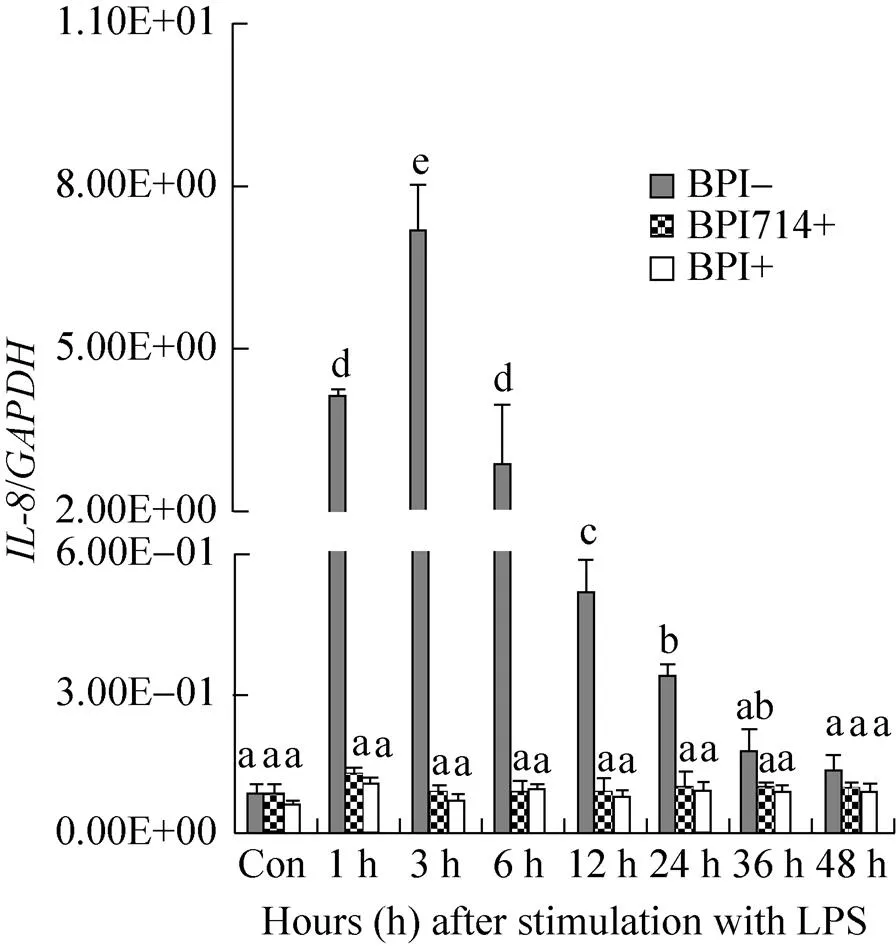
图4 LPS刺激前后稳定表达BPI/BPI714和未表达BPI/BPI714的mHEK293细胞中IL-8基因的相对表达水平

图5 LPS刺激前后稳定表达BPI/BPI714和未表达BPI/BPI714的mHEK293细胞中NF-κB-2基因的相对表达水平
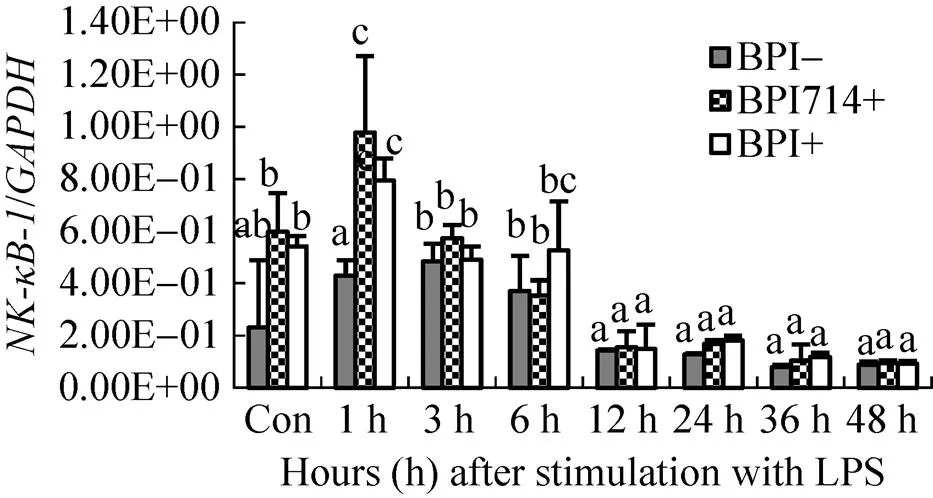
图6 LP S刺激前后稳定表达BPI/BPI714和未表达BPI/BPI714的mHEK293细胞中NF-κB-1基因的相对表达水平
3 讨论
LPS是革兰氏阴性菌菌膜的组成部分,可以导致急性炎症反应,清除LPS或对LPS的脱毒是机体免疫反应的最重要目标。激活免疫反应首先需要把单个LPS分子转移到宿主细胞的表面识别受体TLR4,这个过程需要LBP和革兰氏阴性菌菌膜上的LPS结合,由LBP把内毒素单体转移给可溶的CD14 (或细胞膜上的CD14) 形成复合物,该复合物的结合底物是MD2或MD2-TLR4,然后由MD2将内毒素和TLR4结合起来,通过激活NF-κB途径,使巨噬细胞释放促炎性细胞因子,如、和等,诱导巨噬细胞介导的免疫应答,从而清除细菌[14]。
IL-8可由多种细胞产生,包括单核细胞、巨噬细胞、内皮细胞、成纤维细胞和表皮细胞等。、和LPS是刺激分泌的主要诱导剂。主要生物学功能是趋化和激活中性粒细胞,使其产生处理细胞毒素的吞噬小泡[4]。吞噬小泡中包括大量的抗菌肽、活性氧以及骨髓分化的蛋白,能够消灭病原菌,清除LPS或对LPS进行脱毒化处理,其中BPI是抗菌肽处理LPS的主要成分之一。
自1978年Weiss等提取天然BPI分子后,人们已经对兔、鼠、猪、牛和鸡等多种生物的基因进行研究,大部分研究主要集中在基因多态性对其功能的影响[15-17],以及不同组织的BPI表达分布以及其对革兰氏阴性菌的杀菌能力方面。徐俊杰等[18]从细菌培养和平板计数上,都证实BPI有极强的抑菌效果。在全血实验中,5 nmol/L浓度的nBPl55或rBPl23就可使对血清和吞噬作用具有抵抗力的有荚膜粗糙型大肠杆菌发生损伤[1]。Eckert等[19]通过表达TLR4信号通路的HEK293细胞研究小鼠BPI的功能,发现鼠源BPI能特异的抑制IL-8和基因的表达。Wittmann等[20]在稳定表达基因的RAW细胞系 () 中研究BPI对LPS诱导的炎性反应的影响,发现鼠源BPI可以抑制,IL-8和TNF基因的表达。综上所述,LPS刺激后,炎性细胞因子、、和转录因子表达水平均显著增加。因此,我们认为通过分析这些基因的表达水平变化能够判断BPI对LPS介导的免疫应答的影响作用。为此本实验选择了上述炎性细胞因子/转录因子,利用具有TLR4信号通路的mHEK293细胞系,将牛源BPI/BPI N端基因分别转染到上述mHEK293细胞中,在相同LPS刺激条件下,通过比较稳定表达BPI/BPI714实验组细胞和没有表达BPI/BPI714对照组细胞中这些因子的相对转录水平变化情况,评价牛源对LPS介导的免疫应答的影响。
不同剂量的LPS刺激不同物种的免疫细胞、炎性细胞因子的转录水平变化并不完全相同。Strandberg等[21]采用50 μg/mL的LPS刺激牛乳腺上皮细胞,炎性细胞因子的转录水平均迅速提高,其中和的转录水平在2 h后最高,而在刺激8 h后达到最高转录水平。而Hadley等[22]采用1 ng/mL的LPS刺激人的血液,发现在6 h后表达水平达到最高,在12 h达到最高水平,则在24 h时达到最高水平。Guillermo等[23]对人的单核细胞系THP-1用LPS (100 ng/mL) 进行刺激,发现表达量迅速升高,并在4 h后达到最高水平,随后缓慢下降。Lee等[24]用大肠杆菌刺激奶牛个体,采集牛奶中的细胞,检测炎性细胞因子转录水平的变化,发现转录水平没有显著升高,而在16 h后转录水平显著升高 (<0.05),而后逐渐下降。总体上,在LPS刺激的各种实验模型中,尽管炎性细胞因子表达在变化强度和时间上存在差异,但是炎性细胞因子表达水平都会显著高于其刺激前的转录水平。本研究结果也显示,没有BPI/BPI714表达时,LPS刺激mHEK293细胞后,、和以及转录因子的转录水平均显著提高,说明LPS可以诱导mHEK293产生炎性细胞因子应答。然而,当稳定表达BPI/BPI714 mHEK293细胞受到相同LPS刺激细胞后,其、和的转录水平均接近刺激前的转录水平,都未发生显著变化,说明BPI能强烈抑制以上基因的转录表达。这一结果与Eckert等[19]和Wittmann等[20]的研究结果相似,说明不同物种的BPI抗菌机理是相似的。然而,本实验检测到表达BPI/BPI714的细胞在LPS刺激后6 h,其中的表达与对照组细胞相比也显著降低,但该基因在LPS刺激后1 h的转录表达水平却比刺激前显著升高了,提示在LPS诱导的炎性细胞因子应答中基因的转录调节与和可能不完全相同。此外,不表达BPI/BPI714的细胞经LPS刺激后基因转录水平并没有显著提高,而稳定表达BPI/BPI714的细胞在LPS刺激后1 h,基因转录水平却显著升高,说明基因在LPS刺激的炎性反应中不起主要作用。
本研究分别构建了牛BPI和BPI N端编码序列的表达载体并导入mHEK293细胞中使其成功表达,收集LPS刺激前后不同时间点细胞样品,利用实时定量RT-PCR方法检测、、、和基因的表达变化规律。结果表明,LPS刺激后,没有表达BPI/BPI714的细胞中、、、表达水平在不同时间点均显著提高 (<0.05),并呈现规律性变化;而稳定表达BPI/BPI714细胞在同样刺激条件下,、、、基因在LPS刺激前后的转录水平均没有显著变化 (>0.05)。说明在mHKE293细胞模型中,稳定表达BPI/BPI714的细胞能强烈抑制LPS介导的炎性细胞因子的表达。该实验结果证明了BPI/BPI714均能抑制LPS介导的免疫应答,这为将来研究抗菌蛋白的抗菌效果提供了一种可靠的方法,也为进一步研究其抑菌机制、开发利用其抑菌功能提供了可靠的实验依据。
REFERENCES
[1] Chen XD, Wang SB, Jiang Q, et al. The effect of endotoxins on the levels of cytokines, soluble adhesion molecule, and sFas/sFasL in patients with severe burn. Chin J Emerg Med, 2004, 13(7): 470–473 (in Chinese).陈晓东, 王顺宾, 江琼, 等. 内毒素对严重烧伤后细胞因子、可溶性粘附分子及sFas/sFasL的影响. 中华急诊医学杂志, 2004, 13(7): 470–473.
[2] Lin JP, Bai J, Zhang XM, et al. Association the mutation of 2021 locus of Toll-like receptor 4 gene (TLR4) exon 11 polymorphisms with somatic cell score in Xinjiang brown cattle. J Agr Biotech, 2010, 18(6): 1115–1122 (in Chinese).林嘉鹏, 白杰, 张雪梅, 等. 新疆褐牛Toll样受体基因(TLR4) 外显子Ⅲ2021位点突变与奶牛体细胞评分的相关性研究. 农业生物技术学报, 2010, 18(6): 1115–1122.
[3] Tobias PS, Soldau K, Iovine NM, et al. Lipopolysaccharide (LPS)-binding proteins BPI and LBP form different types of complexes with LPS. J Biol Chem, 1997, 272(30): 18682–18685.
[4] Chen J. Research progress of endotoxin inhibitor. World Notes on Antibiotics, 2005, 26(3): 137–141 (in Chinese).陈军. 内毒素抑制剂的研究进展. 国外医药抗生素分册, 2005, 26(3): 137–141.
[5] Weiss J, Elsbach P, Olsson I, et al. Purification and characterization of a potent bactericidal and membrane active protein from the granules of human polymorphonuclear leukocytes. J Biol Chem, 1978, 253(8): 2664–2672.
[6] Calafat J, Janssen H, Tool A, et al.The bactericidal/permeability-increasing protein (BPI) is present in specific granules of human eosinophils. Blood, 1998, (91): 4770–4775.
[7] Canny G, Levy O, Furuta GT, et al. Lipid mediator-induced expression of bactericidal/ permeability-increasing protein (BPI) in human mucosal epithelia. Proc Natl Acad Sci USA, 2002, 99(6): 3902–3907.
[8] Reichel PH, Seemann C, Csernok E, et al. Bactericidal/permeability-increasing protein is expressed by human dermal fibroblasts and upregulated by interleukin 4. Clin Diagn Lab Immunol, 2003, 10(3): 473–475.
[9] Peuravuori H, Aho VV, Aho HJ,et alBactericidal/ permeability-increasing protein in lacrimal gland and in tears of healthy subjects. Graefes Arch Clin Exp Ophthalmol, 2006, 244(2): 143–148.
[10] Canny GO, Trifonova RT, Kindelberger DW, et al.Expression and function of bactericidal/permeability increasing protein in human genital tract epithelial cells. J Infect Dis, 2006, 194(4): 498–502.
[11] Bai J. Study of Toll-like receptor 2 & 4 gene structure and function and its correlation with mastitis in bovine [D]. Urumqi: Xinjiang University, 2012 (in Chinese).白杰. Toll样受体2和4基因结构和功能及其与奶牛乳房炎的相关性研究[D]. 乌鲁木齐: 新疆大学, 2012.
[12] Sauter KS, Brcic M, Franchini M, et al. Stable transduction of bovine TLR4 and bovine MD-2 into LPS-nonresponsive cells and soluble CD14 promote the ability to respond to LPS. Vet Immunol Immunopathol, 2007, 118(1): 92–104.
[13] Liu CX, Wang LQ, Li W, et al. Highly efficient generation of transgenic sheep by lentivirus accompanying the alteration of methylation status. PLoS ONE, 2013, 8(1): e54614.
[14] Hendrik Schultz, Jerrold P. The bactericidal/ permeability-increasing protein (BPI) in infection and inflammatory disease. Clin Chim Acta, 2007, 384(1/2): 12–23.
[15] Yang QF, Chen BL, Zhang QS, et al. Glu216Lys polymorphism of bactericidal/permeability- increasing protein gene has noassociation with inflammatory bowel disease in Chinese Han population. Chin J Pathophysiol,,: 718723(in Chinese).杨庆帆, 陈白莉, 张青森, 等. 杀菌/通透性增加蛋白基因Glu216Lys多态性与中国汉族人群炎症性肠病无关. 中国病理生理杂志, 2013, 29(4): 718–723.
[16] Ma Y, Jin XB, Li XB, et al. Optimization of condition for expression of BPI23-haFGF fusion protein in Pichia pastoris. Biotechnology, 2013, 23 (2): 2529 (in Chinese).马艳, 金小宝, 李小波, 等. BPI23-haFGF融合蛋白在毕赤酵母中表达条件的优化. 生物技术, 2013, 23(2): 25–29.
[17] Wu ZC, Wang J, Zhu SP, et al. The partial cSNPs detection of pig BPI gene and its influence on protein structure and function. Acta Vet Zootech Sin, 2013, 44(7): 10001007 (inChinese).,,, 等. 猪BPI基因部分cSNPs检测及其对蛋白结构功能的影响. 畜牧兽医学报, 2013, 44(7): 1000–1007.
[18] Xu JJ, Xu J, Wang HT. Gene cloning and expression of human bactericidal/permeability- increasing protein. Acta Microbiol Sin, 2001, 41(6): 669–672 (in Chinese).徐俊杰, 徐静, 王海涛. 杀菌/通透性增加蛋白基因的克隆及在CHO细胞中的表达. 微生物学报, 2001, 41(6): 669–672.
[19] Eckert M, Wittmann I, Röllinghoff M, et al. Endotoxin-induced expression of murine bactericidal permeability/increasing protein is mediated exclusively by Toll/IL-1 receptor domain-containing adaptor inducing IFN-β- dependent pathways. J Immunol, 2006, 176(1): 522528.
[20] Wittmann I, Schönefeld M, Aichele D, et al. Murine bactericidal/permeability-increasing protein inhibits the endotoxic activity of lipopolysaccharide and gram-negative bacteria. J Immunol, 2008, 180(11): 75467552.
[21] Strandberg Y, Gray C, Vuocolo T, et al. Lipopolysaccharide and lipoteichoic acid induce different innate immune responses in bovine mammary epithelial cells. Cytokine, 2005, 31(1): 72–86.
[22] Hadley JS, Wang JE, Foster SJ, et al. Peptidoglycan ofupregulates monocyte expression of CD14, Toll-like receptor 2 (TLR2), and TLR4 in human blood: possible implications for priming of lipopolysaccharide signaling. Infect Immun, 2005, 73(11): 7613–7619.
[23] Giambartolomei GH, Zwerdling A, Cassataro J, et al. Lipoproteins, not lipopolysaccharide, are the key mediators of the proinflammatory response elicited by heat-killed Brucellaabortus. J Immunol, 2004, 173(7): 46354642.
[24] Lee JW, Bannerman DD, Paape MJ, et al. Characterization of cytokine expression in milk somatic cells during intramammary infections with Escherichia coli or Staphylococcus aureus by real-time PCR. Vet Res, 2006, 37(2): 219–229.
(本文责编 陈宏宇)
Effects on the expression of lipopolysaccharide-induced inflammatory cytokines mediated by bovine bactericidal/ permeability-increasing protein
Nan Yao1,2,4*, Jie Bai1,3*, Xuemei Zhang1, Ning Zhang1, Weidong Wu2, and Wenrong Li1
1 Key Laboratory of Genetics, Breeding and Reproduction of Grass Feeding Livestock, Ministry of Agriculture, the Key Laboratory of Animal Biotechnological of Xinjiang, Biotechnological Center, Xinjiang Academy of Animal Science, Urumqi 830000, Xinjiang, China 2 Clinical Research Center, Xinjiang People’s Hospital, Urumqi 830000, Xinjiang, China 3 Institurte of Amimal Science of Henan Academy of Agricultural Sciences, Zhengzhou 450002, Henan, China 4 Karamay City People's Hospital, Karamay 834000, Xinjiang, China
Bactericidal/permeability-increasing protein () can bind to and specifically neutralize lipopolysaccharide (LPS) from the outer membrane of Gram-negative bacteria. In order to evaluate potent LPS-neutralizing activity of bovine BPI, the full-length coding sequence (1 449bp) or 714 bp N-terminal coding sequence () of bovine BPI was transfected into mHEK293 cells and the expression of LPS-induced inflammatory cytokines was studied. First, we constructed the lentiviral expression vectors and generated mHEK293 cells stably expressing recombinant bovine BPI or BPI714. Then, we detected the expression of,,,andgenes by real-time PCR at 0, 1, 3, 6, 12, 24, 36 and 48 h post of LPS induction in cells with or without recombinant bovine BPI or BPI714 ectopic expression, respectively. In response to LPS, the robust abundance of inflammatory cytokines including,,andwas observed in wild type mHEK293 cells at eachtime point. On the contrary, mRNA abundance of,and
bactericidal/permeability-increasing protein, lipopolysaccharide, immune respond, inflammatory cytokines
April 4, 2014; Accepted: October 20, 2014
Wenrong Li. Tel: +86-991-4832343; Fax: +86-991-4833671; E-mail: xjlwr@126.com
Supported by:National Natural Science Foundation of China (No. 30860183).
国家自然科学基金(No. 30860183) 资助。
网络出版时间:2014-11-18
http://www.cnki.net/kcms/doi/10.13345/j.cjb.140207.html
*These authors contributed equally to this study.

