饮食限制联合维生素D对Beclin1表达的诱导作用
武海燕,邱 龄,刘 蓉,吴晨栋
饮食限制联合维生素D对Beclin1表达的诱导作用
武海燕,邱 龄,刘 蓉,吴晨栋
目的探讨维生素D联合饮食限制诱导细胞自噬的发生以及对自噬相关蛋白Beclin1表达的影响。方法将18月老龄大鼠随机分为对照组、维生素D组、饮食限制组、维生素D联合饮食限食组,喂养6个月后,透视电镜观察大鼠肝脏细胞中的自噬体,免疫组化检测大鼠肾皮质细胞中自噬相关蛋白Beclin1的表达情况。结果电镜下维生素D组、饮食限制组、维生素D联合饮食限制组均出现自噬细胞形态学改变。免疫组化显示,与对照组相比,维生素D组、饮食限制组、维生素D联合饮食限制组Beclin1蛋白表达的比值均明显提高(P<0.01),且维生素D联合饮食限制组Beclin1蛋白的表达高于维生素D组、饮食限制组(P<0.01)。结论两种不同的检测细胞自噬方法证实,维生素D以及维生素D联合饮食限制均可增强细胞发生自体吞噬,且维生素D联合饮食限制比单独维生素D或者单独饮食限制引起自噬的程度更高,提示维生素D与饮食限制可能通过不同的信号转导途径来诱导细胞自噬的发生。
自噬;维生素D;饮食限制;Beclin1蛋白
自噬是广泛存在于真核细胞中的生命现象,是生物在其发育、老化过程中都存在的一个净化自身多余或受损细胞器的共同机制。生命体籍此维持蛋白代谢平衡及细胞环境稳定[1]。Beclin1参与自噬泡的形成过程,是新近被发现的哺乳动物调控自噬性细胞死亡途径的关键基因[2]。饮食限制(dietary restriction, DR)是指在提供生物体充分的营养成分如必需氨基酸、维生素等,保证生物体不发生营养不良的情况下,限制每日摄取的总热量[1]。维生素D的激活形式1, 25-(OH)2D3作为一种多效型激素在人体许多不同的细胞中调控着将近900多种不同的基因表达,并调控他们的增殖、分化与存活[37]。
本研究旨在饮食限制以及维生素D(VD)干预的情况下,观察老龄大鼠中自噬相关基因Beclin1的表达和自噬小体的比例,研究饮食限制联合维生素D对细胞自噬的影响,探索饮食限制与维生素D是否通过不同的信号转导途径来诱导细胞自噬的发生。
1 材料与方法
1.1 实验动物和主要试剂 山西医科大学动物实验中心购进40只18月的老龄大鼠,JEM-100CX II型透射电镜(日本日立HITACHI公司H-600),超薄切片机(瑞典LKB公司LKB-Ⅴ),活性VD(纯度为99%)购自Sigma公司,Beclin 1兔抗大鼠单克隆抗体、EnVision抗兔/鼠通用型免疫组化检测试剂盒均购自武汉博士德公司。
1.2 动物处理 40只18月老龄大鼠经洗脱期后随机分为4组,对照组、饮食限制组(DR组)、维生素D组(VD组)、维生素D联合饮食限制组(DR联合VD组),喂养6个月,每周测大鼠体重,灌胃VD 3μg/kg。
1.3 投射电镜检测自噬小体 经过常规取材、双重固定、脱水、浸透、包埋、切片(厚度为50 nm),醋酸双氧铀和枸橼酸铅双重染色后,透射电镜观察、拍照、记录。
1.4 免疫组化观察肾皮质细胞Beclin1蛋白的表达采用免疫组化法检测,组织蜡块切片,烤片后脱蜡和水化,高压抗原修复,依次滴加过氧化物酶阻断液(37℃封闭40 min)、体积分数10%非免疫血清(37℃孵育40 min)、第一抗体(稀释度均为1∶50,4℃过夜),生物素标记的第二抗体(37℃孵育20 min)及链酶亲和素-生物素-辣根过氧化物酶工作液(37℃孵育20 min),DAB显色,苏木素复染,脱水透明,中性树胶封片。用已知阳性切片作阳性对照,用PBS代替一抗作阴性对照。
1.5 统计学处理 采用SPSS 17.0统计软件进行分析,计量资料以均数±标准差(x±s)表示,各组细胞自噬泡比值和Beclin1的表达采用单因素方差分析,两组之间的进一步比较采用t检验,检验水准α= 0.05。
2 结 果
2.1 电镜观察 自噬体为单层或双层膜包裹着的处于不同降解阶段的胞浆成分或废弃的细胞器经消化降解后形成的板层样结构。透射电镜下正常组肝脏细胞内脂滴较多,线粒体嵴结构清晰,自噬体少见。限食组肝脏细胞内线粒体丰富,肿胀明显,自噬体数量较多。维生素D组肝脏细胞线粒体丰富,线粒体体积增大,自噬体数量较多。维生素D组联合饮食限制组线粒体明显肿胀,出现大量自噬体。详见图1、表1。
表1 各组自噬泡与胞浆面积的比值(±s)

表1 各组自噬泡与胞浆面积的比值(±s)
组别n自噬泡/胞浆面积对照组100.008 5±0.000 7 DR组100.013 3±0.001 11)VD组100.013 7±0.001 21)DR联合VD组10 0.034 7±0.004 11)2)与对照组比较,1)P<0.01;与DR组、VD组比较,2)P< 0.01。

图1 各组电镜观察结果
2.2 免疫组化显示Beclin1蛋白表达增高 与对照组相比,DR组、VD组、DR联合VD组肾皮质细胞中Beclin1的表达明显增高,差异有统计学意义(P< 0.01),且DR联合VD组Beclin1蛋白的表达高于DR组、VD组(P<0.01)。详见表2。
表2 不同组别Beclin1表达的比较(±s)
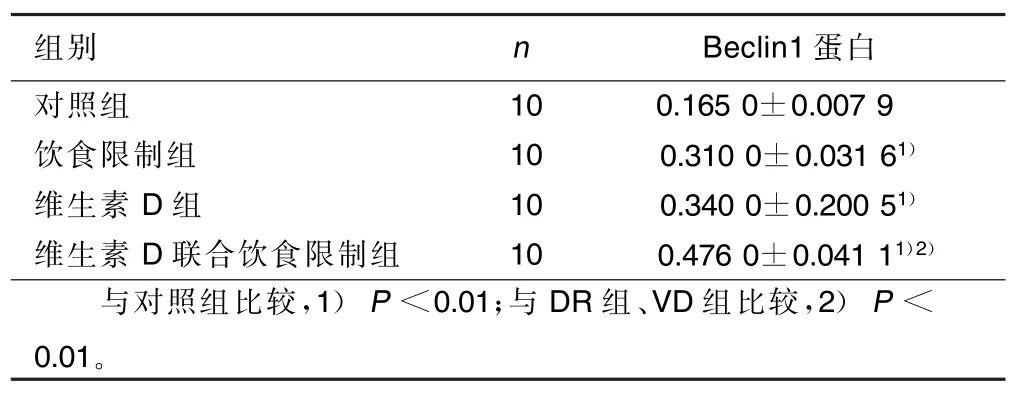
表2 不同组别Beclin1表达的比较(±s)
组别nBeclin1蛋白对照组100.165 0±0.007 9饮食限制组100.310 0±0.031 61)维生素D组100.340 0±0.200 51)维生素D联合饮食限制组100.476 0±0.041 11)2)与对照组比较,1)P<0.01;与DR组、VD组比较,2)P< 0.01。
3 讨 论
大量实验表明饮食限制可以引起细胞自噬,是除遗传操作以外强有力的延缓衰老方法,被称为衰老研究领域重大的发现[8]。近年来有实验发现活性维生素D也能够引起细胞自噬,成为自噬与衰老领域新的研究热点,但目前的研究尚不清楚二者是否通过相同的信号转导途径引起细胞自噬。
自噬主要的生理功能是将胞质中的大分子物质(如蛋白质、RNA、过量储存的糖原等)和一些细胞内源性底物(包括由于生理或病理原因引起的衰老、破损的细胞器)在单位膜包裹的囊泡中大量降解,实现再循环,以维持细胞自身的稳定。这个过程对于细胞成分更新、保持旺盛的生理状态是至关重要的[9]。自噬过程的信号调控目前有以下几种:mTOR信号途径、ClassⅠPI3K/PKB途径、Gi3蛋白和氨基酸等。随着年龄的增长,细胞自噬作用开始减弱,细胞适应外界环境和自身防御反应的能力降低,损伤的细胞结构及大量氧自由基等不能有效地被清除,细胞稳态发生变化,加速细胞老化[10]。Beclin1是酵母菌atg/vps40基因在哺乳动物中的同源物,参与自噬泡的形成过程,是新近发现的哺乳动物调控自噬性细胞死亡途径的关键基因[8]。Beclin1基因在多种正常组织中均有表达,因此可以通过检测Beclin1蛋白的表达来间接反映自噬发生的强度。
电子显微镜是检测细胞自噬的金标准[11]。自噬体是内源性物质包括细胞内由于生理或病理原因而被损伤的细胞器,或过量储存的糖原等,被细胞自身的膜(如内质网或高尔基复合体的膜)包裹形成。通过电镜可对细胞的自噬体进行定量。
活性维生素D与细胞的自噬有着相关性,本实验结果表示4组之间Beclin1蛋白表达差异有统计学意义,且维生素D联合饮食限制组Beclin1蛋白的表达高于维生素D组和饮食限制组。这些结果显示,维生素D、饮食限制二者联合可以诱导细胞自噬,且维生素D联合饮食限制诱导细胞自噬比单独的维生素D和单独饮食限制作用更强,支持维生素D与饮食限制二者联合具有叠加作用,但维生素D与饮食限制究竟通过什么信号途径需要进一步探讨。
参与自噬的信号转导分子十分复杂。TOR激酶是氨基酸、三磷酸腺苷(ATP)和激素的感受器,对细胞生长具有重要调节作用,抑制自噬的发生,是自噬的负调控分子,并发挥“门卫(gatekeeper)”作用,哺乳动物细胞中的核糖体蛋白质S6(p70S6)抑制自噬的发生,它位于TOR信号途径下游,其活性受mTOR调节[12]。外源性氨基酸的去除,可以阻断TOR信号途径,因此饮食限制可能通过阻断mTOR途径来诱导细胞自噬的发生。磷酸腺苷(AMP)激活的蛋白激酶AMPKα(5’AMP-activated protein kinase)是细胞体内的一个感受能量的激酶,能够感受AMP的变化,诱导自噬的发生,从而进行细胞内物质的降解重新产生能量[13]。AMPK 通过抑制雷帕霉素-1(mTORC1)位点来引起细胞自噬。维生素的活性形式1,25-(OH) 2D3可促进小肠对钙磷的吸收,维持钙磷正常代谢,调节肾脏对钙磷的重吸收。维生素D经血液维生素D结合蛋白(DBP)运送至小肠细胞,与细胞膜表面受体Cubilin和Megalin结合后,进入细胞核,与视黄醇类X受体(RXR),维生素D受体(VDR)复合物结合,并作用于目标基因的维生素D反应元件,产生钙结合蛋白。维生素D可能通过增加内质网中钙调控蛋白[Ca2+]cyt,激活钙离子依赖激酶CaMKK-β,进一步激活磷酸腺苷(AMP)激活的蛋白激酶AMPK诱导细胞自噬的发生[14]。本实验证明饮食限制和维生素D联合诱导细胞自噬具有叠加作用,但目前机制尚不明确,因此维生素D和饮食限制引起细胞自噬的具体信号通路需要进一步的研究。
[1] Masoro EJ.Caloric restriction and adding update[J].Exp Gerontol,2000,35(3):299-305.
[2] Pirtoli L,Cevenini G,Tini P,et al.The prognostic role of Beclin 1 protein expression in high-grade gliomas[J].Autophagy,2009, 5:930-936.
[3] Jones G.Expanding role for vitamin D in chronic kidney disease:Importance of blood 25-OH-D levels and extra-renal lalphahydroxylase in the classical and nonclassical actions of lalpha, 25-dihydroxyvitaminD(3)[J].Semin Dial,2007,20(4):316-324.
[4] Norman AW.From vitamin D to hormone D:Fundamentals of the vitamin D endocrine system essential for good health[J].Am J Clin Nutr,2008,88(2):491S-499S.
[5] White JH.Vitamin D signaling,infectious diseases,and regulationof innate immunity[J].Infect Immun,2008,76(9):3837-3843.
[6] Zittermann A,Schleithoff SS,Frisch S,et al.Circulating calcitriol concentrations and total mortality[J].Clin Chem,2009,55(6): 1163-1170.
[7] Bikle DD.Vitamin D:Newly discovered actions require reconsideration ofphysiologicrequirements[J].TrendsEndocrinol Metab,2010,21(6):375-384.
[8] Anson RM,Guo Z,de Cabo R,et al.Intermittent fasting dissoc-i ates beneficial effects of dietary restriction on glucose metabolism and neuronal resistance to injury from calorie intake[J]. Proc Natl Acad Sci USA,2003,100(10):6216-6220.
[9] Dusso AS,Brown AJ,Slatopolsky E.Vitamin D[J].Am J Physiol Renal Physiol,2005,289(1):8-28.
[10] Bergamini E,Cavallini G,Donati A,et al.The role of macroautophag in the aging process,anti-aging intervention and ageassociated diseases[J].Int J Biochem&Cell Biology,2004,36: 2392-2404.
[11] Ashford TP,Porter KR.Cytoplasmic compontents in hepatic cell lysosomes[J].J Cell Biol,1962,12:198-202.
[12] Klionsky DJ,Meijer AJ,Codogno P,et al.Autophagy and P70S6 kunase[J].Autophagy,2005,1(1):59-60.
[13] He C,Klionsky DJ.Regulation mechanisms and signaling pathways of autophagy[J].Annual Rev Genet,2009,43:67-93.
[14] Maria Hyer-Hansen,Sasja Pauline Schultz Nordbrandt,Marja Jä ätteäl.Autophagy as a basis for the health-promoting effects of vitamin D[J].Trends in Medicine,2010,16:295-302.
R329.1
:Adoi:10.3969/j.issn.1672-1349.2015.02.024
:1672-1349(2015)02-0200-03
2014-06-13)
(本文编辑郭怀印)
山西医科大学第二临床医学院(太原030001)
邱龄,E-mail:oldnestle@aliyun.com

