贵州省猪源沙门氏菌Ⅰ类整合子与耐药基因盒研究
王源 谭艾娟 吕世明等


摘要: 为了调查规模养殖场沙门氏菌中Ⅰ类整合子的流行情况,采用聚合酶链式反应检测了从贵州省规模养猪场分离的57株沙门氏菌中Ⅰ类整合子的携带率以及整合子中耐药基因盒的种类;采用微量肉汤稀释法测定了57株沙门氏菌对12种抗菌药物的敏感性;并应用χ2检验检测Ⅰ类整合子阳性菌株与阴性菌株耐药性的相关性。结果显示,57株沙门氏菌中Ⅰ类整合子检出率为40.4%(23/57);耐药基因盒检出率为31.6%(18/57);整合子中携带可分别介导对氨基糖苷类和磺胺类药物耐药的aadA2、aadA5、aadA22、aadA23b、dfrA1、dfrA12和dfrA17基因;57株沙门氏菌对12种抗菌药物的耐药率不同,Ⅰ类整合子与多重耐药之间有明显的相关性。
关键词:沙门氏菌;Ⅰ类整合子; 基因盒; 耐药性; 多重耐药
中图分类号:S852.61 文献标识号:A 文章编号:1001-4942(2015)01-0105-04
Abstract To investigate the prevalence state of classⅠintegron in Salmonella, the carrying rates of classⅠintegrons and the types of drug resistance gene cassettes of 57 Salmonella strains isolated from scale swine farms were determined by polymerase chain reaction (PCR). The susceptibility of the Salmonella strains to 12 antimicrobial was tested by the broth dilution method. The correlation of anti-microbial resistance between the positive and negative strains of classⅠintegron was analyzed by χ2 test. The results showed that the carrying rate of classⅠintegrons and drug resistance gene cassettes was 40.4% (23/57) and 31.6% (18/57) respectively. The genes of aadA2, aadA5, aadA22, aadA23b, dfrA1, dfrA12 and dfrA17 were checked out in classⅠintegrons, which mediated Salmonella resistance to aminoglycoside antibiotics and sulfa drug resistance respectively. Fifty seven strains of Salmonella had different drug resistance rates to 12 antimicrobial. The gene cassette carried in classⅠintegron presented obvious relativity to multi-drug-resistance (MDR).
Key words Salmonella; Integron classⅠ; Gene cassette; Drug resistance; Multi-drug-resistance
沙门氏菌(Salmonella)是危害人和动物健康的重要致病菌之一,严重威胁养殖业和食品安全[1]。抗菌药物的广泛使用,尤其是不规范使用,导致耐药现象日益严重[2]。整合子是介导细菌耐药性的主要机制之一[3],整合子作为可移动的基因元件,在整合酶的作用下,可通过位点特异的重组系统捕获外源性的基因盒并使之表达;同时整合子可定位于质粒上,或者自身作为转座子的一部分参与转移,使耐药基因在细菌种间和种内传播[4]。整合子中绝大多数已知基因盒携带的是抗生素抗性基因,已确认的有70多个抗性基因盒[5]。目前,对整合子的研究多集中在临床菌株[6],对猪源沙门氏菌的报道较少。本研究从贵州省规模养猪场分离到57株沙门氏菌,对其Ⅰ类整合子及携带的耐药基因盒进行了检测,并进行了药敏试验,应用χ2检验分析了Ⅰ类整合子阳性菌株与阴性菌株耐药表型的相关性,对于监测细菌耐药性的传播具有重要意义。
1 材料与方法
1.1 试验材料
缓冲蛋白胨水肉汤(BPW)、TTB肉汤、木糖赖氨酸脱氧胆酸钠琼脂(XLD)、营养琼脂、米勒-海顿肉汤(MHB)均购自杭州博微生物技术有限公司;阿莫西林、氨苄西林、大观霉素、恩诺沙星、氧氟沙星、土霉素、氟苯尼考、头孢噻呋钠、复方新诺明、多粘菌素E、庆大霉素和磺胺甲基异恶唑原料药购自上海博微科技有限公司。Ex Taq酶试剂盒购自TaKaRa公司;胶回收试剂盒购自天根生物公司;质粒小提试剂盒及T-A克隆试剂盒购自TaKaRa公司。
57株猪源沙门氏菌均分离于贵州各地区规模养殖场中,标准质控菌株大肠埃希菌(ATCC25922)购自微生物保藏中心。
1.2 试验方法
1.2.1 DNA模板的制备 沙门氏菌经选择性培养基培养后挑取单菌落采用煮沸法提取总DNA。
1.2.2 Ⅰ类整合子检测 根据Ⅰ类整合子的整合酶基因序列,参照文献[7]设计引物(表1)。
50 μL PCR反应条件见表2,PCR扩增产物采用1.5%琼脂糖凝胶进行电泳分析。endprint
1.2.3 Ⅰ类整合子基因盒检测 参照文献[7]设计Ⅰ类整合子基因盒可变区通用引物,上游:5′-GGCATCCAAGCAGCAAGC-3′,下游:5′-AAGCAGACTTGACCTGAT-3′。50 μL PCR反应条件如表3,扩增产物用1.5%琼脂糖凝胶电泳分析。
1.2.4 基因盒扩增产物测序及序列分析 应用天根生化科技有限公司胶回收试剂盒回收Ⅰ类整合子可变区基因盒扩增产物,将胶回收产物连接pMD18-T载体。连接产物转化DH5α感受态细胞,经PCR鉴定,选取阳性菌株提取质粒,送上海生工生物技术股份有限公司进行测序。得到的序列进行Blast比对,确定Ⅰ类整合子可变区基因盒所含耐药基因的种类。
1.2.5 药物敏感性试验 参照美国临床实验室标准化委员会(CLSI)标准,采用微量肉汤稀释法测定57株沙门氏菌对12种抗菌药物最低抑菌浓度(MIC);并按中国兽医药品监察所标准进行耐药性统计。
2 结果与分析
2.1 沙门氏菌Ⅰ类整合子检测结果
部分沙门氏菌Ⅰ类整合子intI1基因PCR扩增结果见图1。57株猪源性沙门氏菌中,共有23株得到303 bp的扩增产物。阳性菌株再经Ⅰ类整合子3′末端保守序列sul1基因检测,23株菌株均扩增出了大小为416 bp的目的条带(图2)。说明23株猪源沙门氏菌均含有Ⅰ类整合子,检出率为40.4%(23/57)。
2.2 Ⅰ类整合子耐药基因盒检测结果
单株沙门氏菌可扩增出0~2个数目不等的条带。其中,有3株沙门氏菌扩增出2个大小不同的条带,分别为1 kb与1.7 kb和1.7 kb与2.0 kb,携带率为13.04%(3/23);有15株沙门氏菌扩增出1个条带,分别为1、1.2、1.7 kb和2.0 kb左右,携带率65.22%(15/23);5株沙门氏菌没有扩增出条带,说明其Ⅰ类整合子不含基因盒。
2.3 Ⅰ类整合子耐药基因盒序列分析
基因盒阳性菌株质粒提取物测序结果显示,1 kb左右的条带,含2种耐药基因:aadA22和aadA23b,编码氨基糖苷核苷转移酶,与大观霉素耐药有关;1.2 kb大小的片段,包含一个耐药基因dfrA1,编码二氢叶酸合成酶,与甲氧苄啶耐药有关;1.7 kb大小的片段,含有2个耐药基因dfrA17和aadA5,编码二氢叶酸合成酶和氨基糖苷核苷转移酶,与甲氧苄啶和大观霉素耐药有关;2.0 kb大小的片段,含有dfrA12、aadA2和orfF,编码二氢叶酸合成酶和氨基糖苷核苷转移酶,与甲氧苄啶和大观霉素耐药有关,其中orfF为功能未知基因(表4)。
由表4可知,基因盒中所含耐药基因以氨基糖苷类耐药基因出现频率最高,为28.07%(16/57),没有检测到β-内酰胺类、四环素类、喹诺酮类、氯霉素类、多肽类药物耐药基因。
氨基糖苷类药物耐药基因以aadA5出现频率最高,其次为aadA2、aadA22与aadA23b。磺胺类药物耐药基因以dfrA17出现频率最高,其次为dfrA12和dfrA1(表5)。
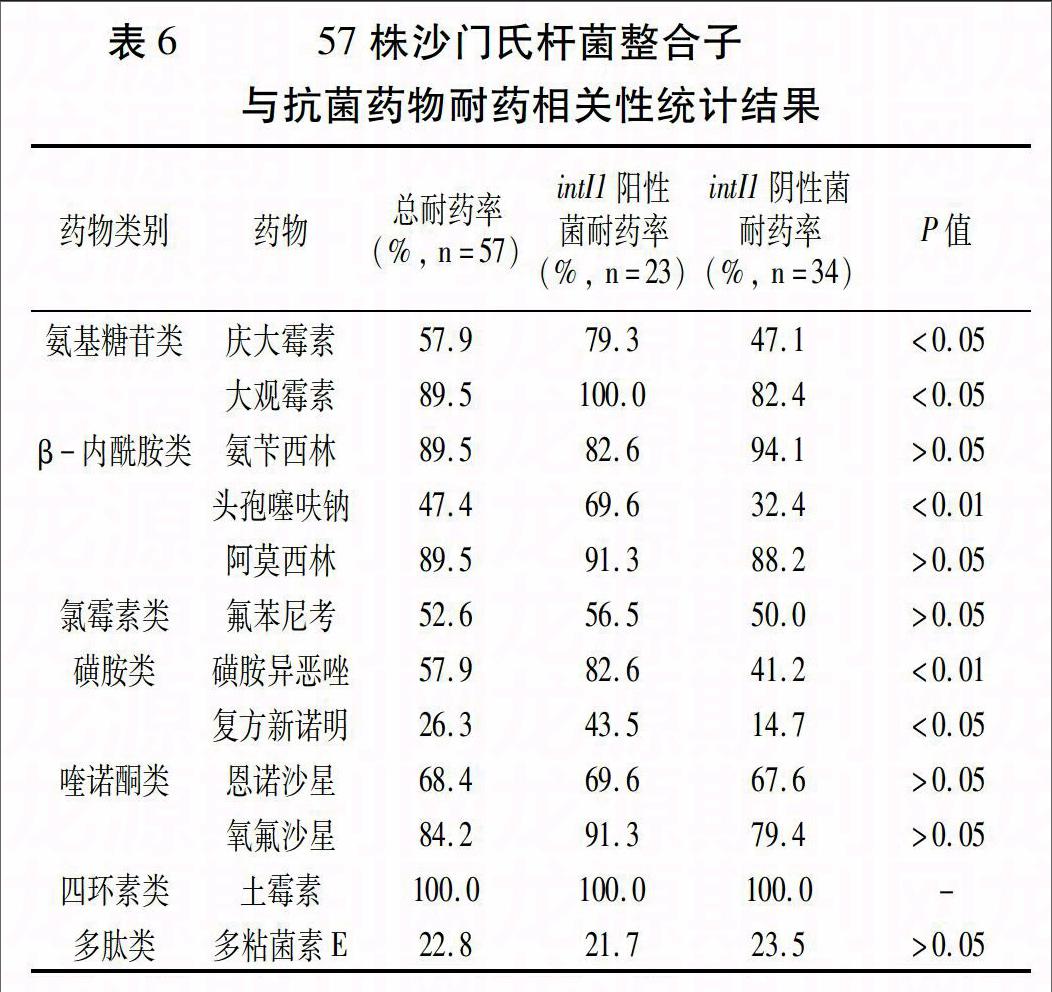
57株沙门氏菌对12种常用抗菌药物存在不同程度的耐药性,特别是对四环素类的耐药性最严重,耐药率高达100%;对多肽类的耐药率则相对较低,为22.8%。根据Ⅰ类整合子检测结果,将57株菌分为Ⅰ类整合子阳性菌组与阴性菌组,对12种抗菌药物耐药率进行χ2检验,结果显示,头孢噻呋钠、磺胺异恶唑、复方新诺明、庆大霉素、大观霉素在整合子阳性组的耐药率极显著或显著高于整合子阴性组(P<0.01或P<0.05,表6)。
3 结论与讨论
本研究从分离得到的57株沙门氏菌中检测出23株携带有Ⅰ类整合子,检出率为40.4%(23/57),与文献报道一致[8],略低于国外报道的59%~75%[9]。其中18株含有耐药基因盒,携带率为31.6%(18/57)。Ⅰ类整合子阳性菌株耐药谱明显宽于阴性菌株,说明Ⅰ类整合子与细菌多重耐药存在着密切关系[10~12]。
检测出的耐药基因盒均为Ⅰ类整合子常见基因盒[13]。18株沙门氏菌Ⅰ类整合子基因盒阳性株共含有7种不同的耐药基因,其中,氨基糖苷类药物耐药基因检出4种,与已有报道Ⅰ类整合子携带aadA基因盒一致[14,15],基因检测结果与耐药表型基本一致。
通过分析药敏试验与基因检测结果,得出所有Ⅰ类整合子基因盒阳性株均对磺胺异恶唑耐药。复方新诺明中含有另外一种成分——甲氧苄啶,dfr基因编码二氢叶酸合成酶,介导甲氧苄啶耐药,对复方新诺明耐药的菌株均检测到dfr基因。因此,临床用药时需注意联合用药和轮换用药并行。
本次检出的沙门氏菌Ⅰ类整合子含有的耐药基因盒可以解释沙门氏菌分离株对氨基糖苷类、磺胺类药物的耐药性,但对于耐药性较高的四环素类和喹诺酮类却未检测出相应的耐药基因盒。因此,Ⅰ类整合子携带的耐药基因盒还不能完全解释沙门氏菌所有的耐药表型,可能存在着其他机制共同介导沙门氏菌耐药表型,如其他类整合子携带的耐药基因盒、抗生素作用的靶位改变、细胞膜通透性改变、转座子介导耐药等。
整合子-基因盒系统在耐药基因捕获和转移中发挥重要作用[16]。研究动物源性细菌整合子-基因盒系统介导的耐药机制是控制细菌耐药性传播的根源途径。本试验从猪源沙门氏菌中检测出了整合子及耐药基因盒的存在,从分子水平分析细菌耐药性获得及传播方式,为我国动物源性细菌耐药性传递研究积累基础资料,为指导贵州省规模猪场合理选择用药、制定干预细菌多重耐药的产生及传播措施提供了理论依据。
参 考 文 献:
[1]
Taiwo S S, Fadiora S O, Fayemiwo S A. High antimicrobial resistance among bacterial isolates of blood stream infections (BSI) in a Nigerian University Teaching Hospital [J]. World Journal of Microbiology and Biotechnology, 2008, 24(2):231-236.endprint
[2]Khan A A, Nawaz S M, Khan S A, et al. Detection of multidrug-resistant Salmonella typhimurium DT104 by multiplex polymerase chain reaction [J].FEMS Microbiology Letters,2000, 182(2):355-360.
[3]魏述永,吴邓红,刘世东.细菌基因盒-整合子系统研究进展[J].动物医学进展, 2008,29(1):53-56.
[4]Barber D A, Bahnson P B, Isaacson R, et al. Distribution of Salmonella in swine production ecosystems [J]. J. Food Prot., 2002, 65(12): 1861-1868.
[5]Xu Z, Li L, Shi L, et al. Class 1 integron in staphylococci[J]. Molecular Biology Reports, 2011, 38(8):5261-5279.
[6]苏健裕, 石磊, 杨连生. 临床大肠埃希菌第I类整合子检测及耐药基因盒分析[J].检验医学与临床, 2008,5(7): 385-387.
[7]Krauland M G, Marsh J W, Paterson D L, et al. Integron-mediated multidrug resistance in a global collection of nontyphoidal Salmonella enterica isolates [J]. Emerging Infectious Diseases, 2009, 15(3): 388-396.
[8]陈玲,吴聪明,沈建忠,等.动物源沙门菌耐药性调查及Ⅰ类整合子的检测[J].中国兽药杂志, 2008, 44(11): 6-9.
[9]Fluit A C, Schmitz F J. Class 1 integrons, gene cassettes, mobility, and epidemiology [J]. European Journal of Clinical Microbiology and Infections Diseases, 1999, 18(11):761-770.
[10]张弘,高伟利,张双宅,等.整合子-基因盒体系与细菌耐药关系及研究进展[J].医学动物防制, 2013,29(3): 288-291.
[11]Fluit A C, Schmitz F J. Resistance integrons and superintegrons [J]. Clin. Microbiol. Infect., 2004, 10 (4): 272-288.
[12]徐彬,曹弟勇,周岐新,等.大肠埃希菌临床分离株I类整合子分布与耐药相关性研究[J].中国抗生素杂志, 2010, 35(10):784-787.
[13]Michael C A, Gillings M R, Holmes A J, et al. Mobile gene cassettes: a fundamental resource for bacterial evolution [J]. The American Naturalist, 2004,164(1):1-12.
[14]Chang C Y, Chang L L, Chang Y H, et a1. Characterisation of drug resistance gene cassettes associated with class 1 integrons in clinical isolates of Escherichia coli from Taiwan, ROC[J]. J. Med. Microbiol., 2000,49(12): 1097-1102.
[15]Chang L L, Chang T M, Chang C Y. Variable gene cassette patterns of class 1 integron-associated drug-resistant Escherichia coli in Taiwan[J]. Kaohsiung J. Med. Sci., 2007,23(6):273-280.
[16]蔡敏泓,黄永茂.整合子与大肠埃希菌耐药基因水平转移关系的研究进展[J].西南军医, 2011,13(1): 124-126.endprint

