手足口病患儿IL—18对Th1/Th2平衡细胞因子IL—1、IL—8、IL—4、IL—10水平变化的影响
黄月艳等
【摘要】 目的 观察手足口病(HFMD)患儿IL-18与Th1型细胞因子IL-1、IL-8及Th2型细胞因子IL-4、IL-10的水平变化,并探讨手足口病发病的分子机制。
方法 选取2011年10月~2014年3月收治住院并诊断为HFMD患儿46例作为病例组,其中普通病例40例(普通病例组),重症病例6例(重症病例组), 选取同期经过健康体检中心体检的健康幼儿40例作为对照组,采用形态观察、ELISA法检测各细胞因子水平、淋巴细胞凝胶电泳观察手段进行研究。
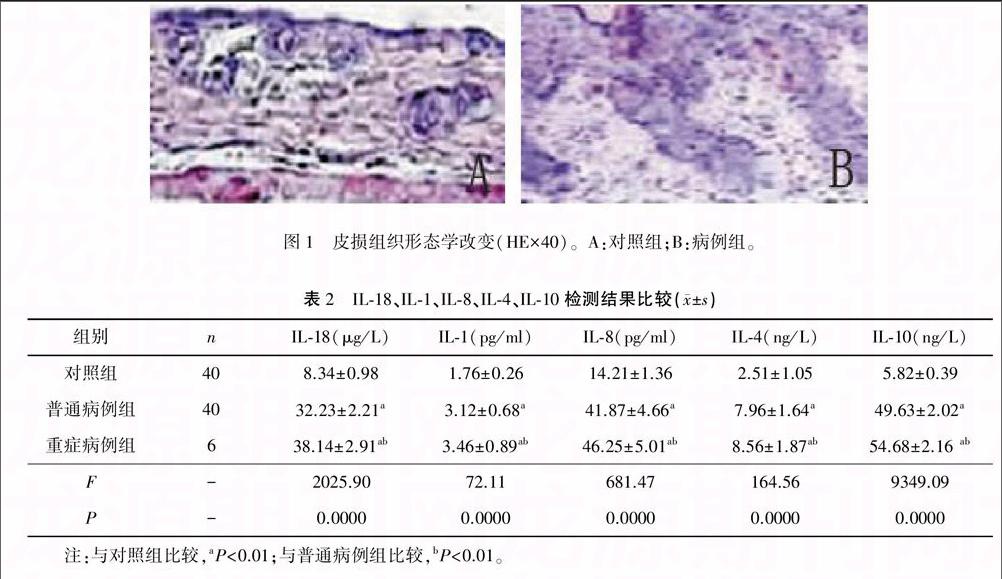
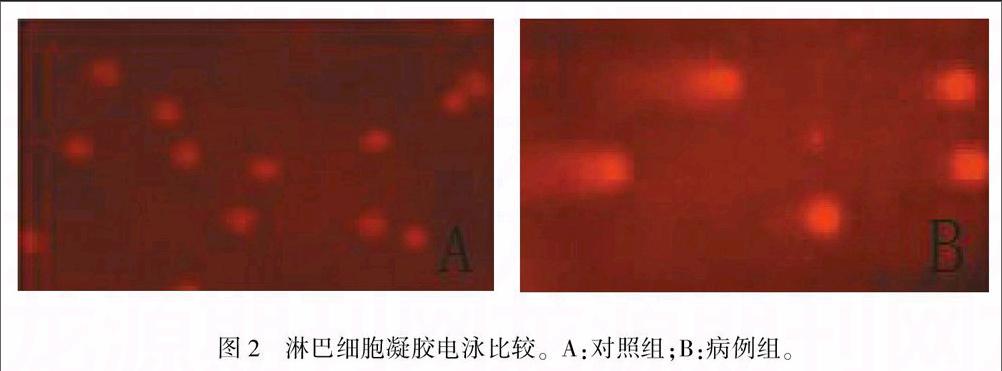
结果 与对照组比较,病例组表皮层增厚,血管增生、扩张,伴有炎症细胞浸润、表皮细胞碎片。与对照组比较,普通病例组和重症病例组的IL-18、IL-1、IL-8、IL-4、IL-10水平均显著升高(P<0.01)。通过淋巴细胞凝胶电泳观察到,病例组彗星细胞比对照组多。
结论 IL-18可能通过影响Th1型、Th2型细胞因子水平对Th1/Th2平衡进行调控而参与手足口病发病机制,IL-18有可能作为临床干预手足口病的潜在靶点。
【关键词】 白细胞介素18;手足口病;细胞因子
【Abstract】 Objective To observe the changes of levels of IL-18,Th1 cytokines (IL-1 and IL-8) and Th2 cytokines(IL-4 and IL-10) of children with hand-foot-mouth disease(HFMD),and to investigate the molecular mechanism of HFMD.
Methods 46 children who were admitted to hospital and diagnosed with HFMD were collected as case group,among which 40 normal cases were selected as normal case group,and 6 severe cases were selected as severe case group.And 40 healthy children proved by physical examination in physical examination center in the same period were selected as control group.Then,morphologic changes of skin lesion was observed,levels of cytokines was tested by ELISA,damage of lymphocyte was observed by gel electrophoresis.
Results Compared with the control group,epidermis of the cases group thickened,blood vessels proliferated and expanded,associating with inflammatory cell infiltration and epidermal cells fragments.Levels of IL-18, IL-1, IL-8,IL-4 and IL-10 of both normal case group and severe case group significantly increased comparing with those of the control group(P<0.01).Observation of lymphocytes gel electrophoresis showed that the case group had more comet cells than the control group.
Conclusion IL-18 might regulate Th1/Th2 balance by affecting the levels of cytokine of type Th1 and Th2,which might be the part of the molecular mechanism of HFMD,and IL-18 is expected to become the potential molecule in the targeted therapy of HFMD.
【Key words】 interleukin-18;hand-foot-mouth disease;cytokines
手足口病(hand-foot-mouth disease,HFMD)是一种儿科常见的传染病,由多种肠道病毒引起,以 5 岁以下儿童发病为主[1],其感染所致疾病多以发热和手、足、口腔等部位的皮疹或疱疹为主要特征。柯萨奇病毒A16型(coxsackievirusA16,CoxAl6)和肠道病毒7l型(enterovirus71,EV71)是引起HFMD的最常见病原[2],HFMD确切的发病机制仍不清楚,病毒感染后可致机体细胞免疫功能紊乱,体液免疫功能受损等诸多病理改变[3]。白细胞介素18(Interleukin-18,IL-18)主要由活化的单核-巨噬细胞产生,能促进多种免疫细胞的增殖和分化,从而明显提高机体的免疫功能,增强机体抗肿瘤、抗病毒、抗炎症能力[4],被认为是靶向调节Th1/Th2平衡的重要因子。本研究通过检测HFMD患儿IL-18表达、Th1型细胞因子IL-1、IL-8以及Th2型细胞因子IL-4、IL-10的水平变化,从IL-18调控细胞免疫、体液免疫和炎症反应角度探讨HFMD的可能病理机制。
1 对象与方法
1.1 研究对象
选取2011年10月~2014年3月在右江民族医学院附属医院儿科收治住院并诊断为HFMD患儿46例作为病例组,其中男30例,女16例;普通病例40例(普通病例组),重症病例6例(重症病例组);年龄6个月~7岁,平均(2.21±0.56)岁。选取同期经过健康体检中心体检的健康幼儿40例作为对照组,无过敏性疾病及其他慢性病史, 排除其他肠道病毒性疾病或先天性免疫缺陷等疾病,近期均无呼吸道、消化道等感染病史。其中男26例,女14例,年龄8个月~6岁,平均(2.11±0.48)岁。病例组和对照组的性别、年龄比较差异无统计学意义(P>0.05),具有可比性。本研究取得HFMD患儿监护人知情同意并获我院医学伦理委员会批准。
1.2 病例入选和排除标准
依据卫生部颁发的《医疗机构手足口病诊疗技术指南》(2011年版)诊断标准。普通病例:以发热及手、足、口、臀部出现斑丘疹、疱疹为主要表现。重症病例:⑴重型:出现神经系统受累表现:包括精神差、嗜睡、易惊、谵妄;头痛、呕吐;肢体抖动、肌阵挛、眼球震颤、共济失调、眼球运动障碍;无力或急性迟缓性麻痹;惊厥。体征可见脑膜刺激征,腱反射减弱或消失。⑵危重型:出现下列情况之一者:①频繁抽搐、昏迷、脑疝。②呼吸困难、发绀、血性泡沫痰、肺部啰音等。③休克等循环功能不全表现。排除标准:其他肠道病毒性疾病;治疗前4周使用过糖皮质激素和免疫调节剂等药物。
1.3 方法
1.3.1 皮损组织观察
分别取患儿斑丘疹或疱疹结痂组织、健康者包皮环切术后皮肤组织,4%多聚甲醛固定24 h,常规石蜡包埋,切片厚度5 μm,60℃的烤箱中烘烤30 min,再用二甲苯、无水酒精以及95%酒精、80%酒精、70%酒精、三蒸水脱蜡及脱水,苏木素-伊红溶液(HE)染色,树胶固定封片,显微镜观片拍摄。
1.3.2 IL-18、IL-1、IL-8、IL-4、IL-10的检测方法
无菌非抗凝管采集新鲜外周血2 ml,室温静置0.5 h后3000 r/min离心10 min吸取血清,每管50 μl分装于EP管中,置-80℃冰箱保存待检。ELISA法检测IL-18、IL-1、IL-8、IL-4、IL-10水平,IL-18、IL-1、IL-8、IL-4、IL-10检测试剂盒购自北京生物科技有限公司,严格按照试剂盒操作说明进行。
1.3.3 淋巴细胞凝胶电泳观察
在冰冻玻片上铺正常溶点琼脂糖,在室温下静置5 min,作为底层凝胶,0.6 μl淋巴细胞悬液与50 μl低熔点琼脂充分混匀,铺在底层凝胶上,加盖玻片,静置待胶凝固后取下盖玻片,作为第2层凝胶,另外再加100 μl低熔点琼脂铺在第2层凝胶上作为第1层凝胶,在水平电泳槽内电泳1 h。染色,封片,红光激发,荧光显微镜观片拍摄。
1.4 统计学方法
采用 SPSS 13.0统计软件进行数据处理,计量资料用均数±标准差(±s)表示,多组间比较采用单因素方差分析,3个样本均数两两比较采用q检验(Newman-Keuls法),P<0.05为差异有统计学意义。
2 结 果
2.1 皮损组织形态学观察
对照组皮肤表皮层细胞形态正常,排列层次分明,血管分布排列整齐。与对照组比较,病例组表皮层增厚,血管增生、扩张,伴有炎症细胞浸润、表皮细胞碎片。见图1 。
2.2 IL-18、IL-1、IL-8、IL-4、IL-10检测结果
与对照组比较,普通病例组和重症病例组的IL-18、IL-1、IL-8、IL-4、IL-10水平均显著升高(P<0.01)。见表2。
2.3 淋巴细胞凝胶电泳结果
正常淋巴细胞核在原位形成一个发亮的头部,没有移动,病例组中受损的淋巴细胞DNA由于受到破坏、碎裂,碎片携带负电荷向正极移动,碎片形成尾部,形状像个彗星,即彗星细胞,彗星细胞数目可以反映细胞DNA受损程度。见图2 。
3 讨 论
Ushio等[5]发现一种多肽具有多种生物学功能,包括促进T细胞增殖,增强天然杀伤细胞活性等,根据其蛋白质序列将其命名为白细胞介素18(Interleukin-18,IL-18)。IL-18可诱导Th1细胞、B细胞、NK细胞产生IFN-γ[6],还可诱导IL-1、TNF-α、IL-8的分泌[7],并能促进多种免疫细胞的增殖和分化,从而明显提高机体的免疫功能,增强机体抗肿瘤、抗病毒、抗细菌能力[8]。IL-18也可诱导Th2型细胞因子IL-4、IL-5、IL-10、IL-13等释放[9],促进Th1应答,从而调节Th1/Th2平衡,因而被认为是靶向调节Th1/Th2细胞因子的重要因子。
本研究发现,与对照组比较,病例组表皮层增厚,血管增生、扩张,伴有炎症细胞浸润、表皮细胞碎片;与对照组比较,普通病例组和重症病例组的IL-18、IL-1、IL-8、IL-4、IL-10水平均显著升高(P<001)。提示病毒感染后,机体启动防御机制,表现为IL-18水平升高,继而诱导IL-1、IL-8、IL-4、IL-10细胞因子的分泌和释放,在各种细胞因子的综合作用下,提高抗病毒、抗炎症能力。因此,推测IL-18可能在HFMD病毒感染后抗病毒及免疫调节中起到关键的作用,而且这种作用可能是通过调节Th1/Th2平衡而发挥的。通过淋巴细胞凝胶电泳观察到,病例组彗星细胞比对照组多,表明病毒感染后,机体的淋巴细胞遭到损伤,推测损伤的原因可能与IL-18的过度表达有关。通常情况下,HFMD病毒感染后,IL-18只是处于适度表达的状态,这样有利于机体抗感染免疫,但在病毒感染程度严重的前提下,IL-18有可能处于过度表达状态,研究[10]已表明IL-18表达过度会诱发一系列病理生理改变,包括脓毒症、急性器官功能损伤及某些自身免疫性疾病等,在脓毒症早期发生促炎反应后机体会迅速释放大量的抗炎介质如IL-4、IL-10等产生强烈的抗炎反应,由此有可能损伤机体淋巴细胞。本研究结果表明,与对照组比较,病例组的淋巴细胞受损程度较严重,和上述文献的报道一致。提示在临床治疗上通过恰当调节IL-18水平有可能既达到提高机体抗病毒、抗炎症能力又可以避免IL-18过度表达带来的对淋巴细胞的损害等不良作用,但如何界定IL-18过度表达仍然需要进一步的实验。
参 考 文 献
[1] 陈 鹏,陶泽新,王海岩,等. 新型人类肠道病毒的研究进展[J].病毒学报,2013,29(2):211-217.
[2] Li W,Yi L,Su J,et al.Seroepidemiology of human enterovirus71 and coxsackievirusA16 among children in Guangdong province,China[J].BMC Infect Dis,2013,13:322.
[3] 王跃飞,郑 瑞,陈葆国,等.手足口病相关免疫学指标检测的病例对照研究[J].浙江预防医学,2010,22(10):15-17,21.
[4] Lin X,Huang R,Zhang S,et al.Methyl helicterate protects against CCl4-induced liver injury in rats by inhibiting oxidative stress,NF-κB activation,Fas/FasL pathway and cytochrome P4502E1 level[J].Food Chem Toxicol,2012,50(10):3413-3420.
[5] Ushio S,Namba M,Okura T,et al.Cloning of the cDNA for human IFN-gamma-inducing factor,expression in Escherichia coli,and studies on the biologic activities of the protein[J].J Immunol,1996,156(11):4274-4279.
[6] Verardi PH,Legrand FA,Chan KS,et al.IL-18 expression results in a recombinant vaccinia virus that is highly attenuated and immunogenic[J].J Interferon Cytokine Res,2014,34(3):169-178.
[7] Tang HP,Sun LX,Han W.Endothelial cells on the proliferation and expression of intercellular adhesion molecule 1 and interleukin 8 of vascular smooth muscle cells[J].Genet Mol Res,2013,12(4):4363-4370.
[8] 潘兴寿,蓝景生,李天资,等.大蒜素治疗病毒性心肌炎疗效分析[J].右江医学,2010,38(2):120-122.
[9] Szymanowski K,Niepsuj-Binias J,Dera-Szymanowska A,et al.An influence of immunomodulation on Th1 and Th2 immune response in endometriosis in an animal model[J]. Biomed Res Int,2013,2013:849492.
[10] Novick D,Kim S,Kaplanski G,et al.Interleukin-18,more than a Th1 cytokine[J].Semin Immunol,2013,25(6):439-448.
(收稿日期:2015-02-10 修回日期:2015-04-14)
(编辑:梁明佩)

