早产儿发生呼吸窘迫综合征及患儿宫外发育迟缓的相关因素分析
项俊华 夏红卫
[摘要] 目的 分析早产儿发生呼吸窘迫综合征相关因素及呼吸窘迫综合征早产儿宫外发育迟缓的危险因素。 方法选择呼吸窘迫综合征早产儿153例作为病例组,根据是否发生宫外发育迟缓分为EUGR组和非EUGR组,选择同期非呼吸窘迫综合征早产儿200例作为对照组,观察各组临床资料,分析相关因素。 结果 呼吸窘迫综合征患儿与非呼吸窘迫综合征患儿EUGR及严重EUGR发生率差异均有统计学意义(P<0.05)。胎龄、出生体重、多胎率、预防性应用PS率、产前激素应用率、宫内窘迫或窒息、羊水吸入、宫内感染、前置胎盘/胎盘早剥、剖宫产、妊娠期高血压病、妊娠期糖尿病发生率是早产儿发生呼吸窘迫综合征的相关因素(P<0.05)。胎龄<31周、多胎、达全量肠内营养时间、喂养不耐受、恢复出生体重时间是呼吸窘迫综合征早产儿EUGR独立危险因素(P<0.05),产前激素应用是呼吸窘迫综合征早产儿EUGR保护因素(P<0.05)。 结论 胎龄小和多胎是早产儿发生呼吸窘迫综合征及患儿EUGR的共同危险因素,产前激素应用对两者都有一定的保护作用,呼吸窘迫综合征对患儿宫外发育有明显不良影响,呼吸窘迫综合征早产儿EUGR主要与喂养情况有关。
[关键词] 早产儿;呼吸窘迫综合征;宫外发育迟缓;危险因素
[中图分类号] R722.6 [文献标识码] B [文章编号] 1673-9701(2015)11-0055-04
[Abstract] Objective To analyze the relevant factors of respiratory distress syndrome for premature infants and the risk factors of extrauterine growth restriction (EUGR) for the premature infants with respiratory distress syndrome. Methods All 153 premature infants with respiratory distress syndrome were selected as case group, and they were assigned to EUGR group and non-EUGR group on the basis of whether they had EUGR. 200 premature infants without respiratory distress syndrome were selected as control group during the same period. Clinical data of each group were observed and relevant factors were analyzed. Results Differences of incidence rates of EUGR and severe EUGR between the premature infants with respiratory distress syndrome and those without respiratory distress syndrome were statistically significant (P<0.05). Incidence rates of gestational age, birth weight, multiple pregnancy rate, preventive application rate of PS, antenatal application rate of hormone, fetal distress or asphyxia, amniotic fluid aspiration, intrauterine infection, placenta previa/placental abruption, cesarean section, pregnancy-induced hypertension and gestational diabetes mellitus were relevant factors of respiratory distress syndrome for premature infants (P<0.05). Gestational age of less than 31 weeks, multiple pregnancy, time reaching total enteral nutrition, feeding intolerance, and time resuming birth weight were independent risk factors of EUGR for premature patients with respiratory distress syndrome (P<0.05). Antenatal application of hormone was the protective factor of EUGR for premature infants with respiratory distress syndrome (P<0.05). Conclusion Young gestational age and multiple pregnancy are common risk factors of respiratory distress syndrome and EUGR for premature infants, and antenatal application of hormone has protective effect on the two diseases. Respiratory distress syndrome has obvious adverse effect on infants' extrauterine growth, and EUGR for premature infants with respiratory distress syndrome is mainly related to feeding.
[Key words] Premature infants; Respiratory distress syndrome; Extrauterine growth restriction (EUGR); Risk factors
早产对新生儿身体健康及发育均造成不良影响,由于宫内发育未足月,新生儿呼吸、消化、免疫等系统尚未发育完全,出生后面临多种新生儿疾病威胁,存在不良结局风险,随着妇产科和新生儿科医疗技术的发展,新生儿死亡率逐渐下降,但早产儿的健康风险依然很高。呼吸窘迫综合征是早产儿死亡的主要原因之一,在出生短时间内发生急性进行性缺氧性呼吸衰竭,与早产儿肺部发育不成熟、缺乏内源性肺表面活性物质有关[1]。早产儿宫外发育迟缓(EUGR)与宫内发育迟缓(IUGR)相对应,对新生儿日后成长发育有重要影响,在早产儿死亡率下降、存活率提高的现状下,早产儿EUGR日益受到重视。本研究对早产儿发生呼吸窘迫综合征及呼吸窘迫综合征对早产儿出现EUGR相关因素进行分析,探讨早产儿呼吸窘迫综合征对其宫外发育的影响,为临床提高早产儿出生质量,减少EUGR发生提供参考。
1 对象与方法
1.1 研究对象
选择2011年4月~2014年2月杭州市第一人民医院收治的呼吸窘迫综合征早产儿153例作为病例组,纳入标准:胎龄<37周;我院出生并住院治疗,出生后24 h内入院;住院时间≥7 d;符合新生儿呼吸窘迫综合征诊断标准[2]。选择同期非呼吸窘迫综合征早产儿200例作为对照组,纳入标准:胎龄<37周;我院出生并住院治疗;住院时间≥7 d;所有研究对象排除:先天畸形、基因缺陷、遗传性疾病;合并其他系统严重疾病;住院期间死亡、住院<7 d、家属主动要求出院或转院。病例组根据是否发生宫外发育迟缓分为EUGR组和非EUGR组。
1.2诊断及评价方法
新生儿呼吸窘迫综合征:生后进行性呼吸困难,PaO2<50 mmHg,中央性紫绀,胸部X线示毛玻璃样改变、支气管充气征或白肺改变[2]。EUGR:以全国15个城市不同胎龄新生儿生长指标(体重、头围、身长等)数据为住院期间生长标准(生长曲线),出院时体重≤相应纠正胎龄宫内生长曲线第10百分位(P10)为EUGR,出院时体重≤相应纠正胎龄宫内生长曲线第3百分位(P3)为严重EUGR;纠正胎龄=胎龄+住院天数/7[3]。病例组入院时和出院时均测量体重。
1.3 干预方法
病例组确诊后均给予吸氧、呼吸机辅助通气,常规采用持续气道正压通气(CPAP),压力5~6 cmH2O,维持PaO2 50~70 mmHg,CPAP无效则进行气管插管;根据病情需要给予肺表面活性物质(PS)、抗生素治疗;支持治疗:暖箱保持体温,依据早产儿肠内营养支持和早产儿营养需求建议计算患儿每日摄入热量及各营养物需求,早期以肠外营养为主,逐渐增加肠内营养。
1.4观察指标
观察病例组与对照组胎龄、出生体重、性别、多胎、宫内窘迫或窒息、羊水吸入、宫内感染、前置胎盘、胎盘早剥、妊娠方式、预防性应用PS、母亲妊娠期高血压病史、妊娠期糖尿病史、产前激素应用,分析早产儿发生呼吸窘迫综合征的相关因素。EUGR组和非EUGR组另观察新生儿急性生理学评分围产期补充Ⅱ(SNAPPE-Ⅱ)、首次肠外营养时间、肠外营养持续时间、首次肠内营养时间、达全量肠内营养时间、喂养不耐受、PS应用例数、CPAP时间、气管插管例数、机械通气时间、恢复出生体重时间、出院时体重、住院时间。
1.5统计学处理
数据采用SPSS21.0统计学软件进行处理,计数资料采用百分比表示,采用χ2检验,计量资料用(均数±标准差)表示,采用t检验,多因素分析采用多因素Logistic回归分析,P<0.05为差异有统计学意义。
2结果
2.1新生儿情况
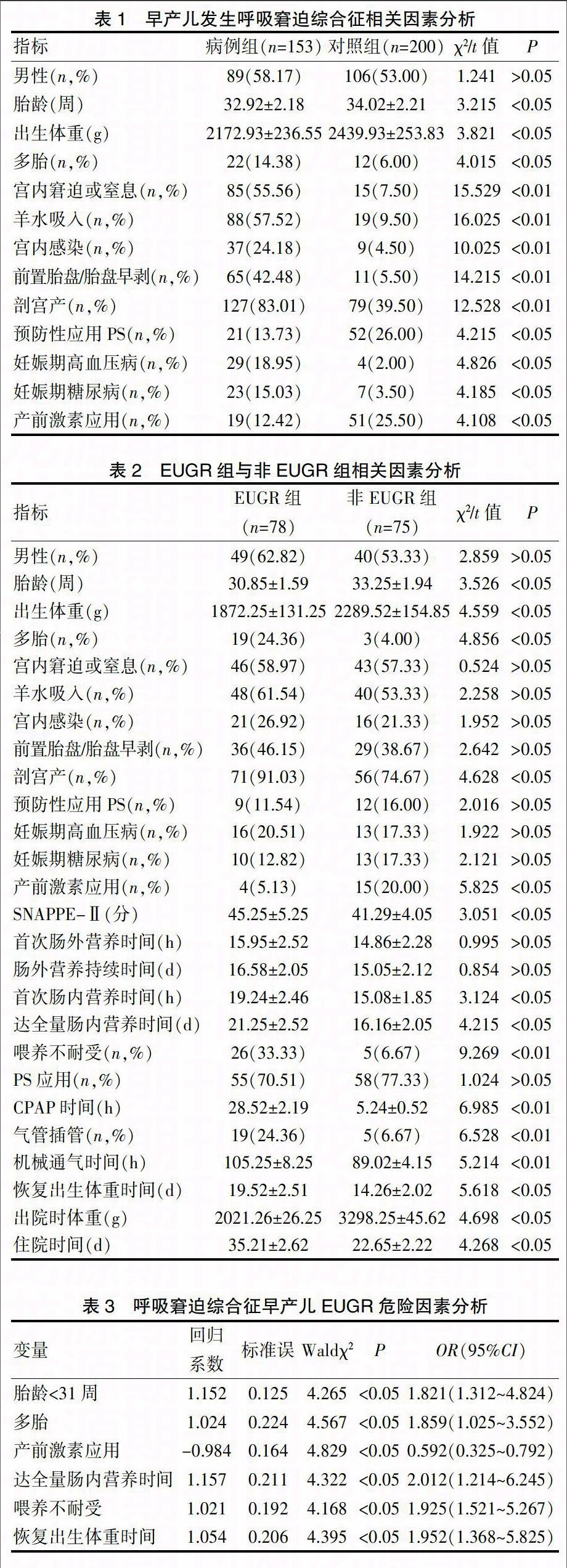
病例组男89例,女64例,胎龄26+3周~35+6周,平均(32.92±2.18)周,出生体重974~4289 g,平均(2172.93±236.55)g,其中EUGR(≤生长曲线P10)78例(50.98%),非EUGR75例(49.02%),EUGR组中有21例(13.73%)为严重EUGR(≤生长曲线P10)。随机选择的非EUGR早产儿对照组200例,男106例,女94例,胎龄26+6周~36+5周,平均(34.02±2.21)周,出生体重997~4532 g,平均(2439.93±253.83)g,EUGR 45例(22.50%),严重EUGR 14例(7.00%),呼吸窘迫综合征患儿与非呼吸窘迫综合征患儿EUGR及严重EUGR发生率差异均有统计学意义(χ2=6.934、8.283,P<0.05)。
2.2 早产儿发生呼吸窘迫综合征相关因素分析
病例组胎龄、出生体重、预防性应用PS率、产前激素应用率均明显低于对照组(P<0.05),病例组多胎率、宫内窘迫或窒息、羊水吸入、宫内感染、前置胎盘/胎盘早剥、剖宫产、妊娠期高血压病、妊娠期糖尿病发生率均明显高于对照组(P<0.05),是早产儿发生呼吸窘迫综合征的相关因素,见表1。
2.3 EUGR组与非EUGR组相关因素分析
EUGR组胎龄、出生体重、出院时体重、产前激素应用均显著低于非EUGR组(P<0.05),EUGR组多胎、剖宫产、SNAPPE-Ⅱ、首次肠内营养时间、达全量肠内营养时间、喂养不耐受、CPAP时间、气管插管、机械通气时间、恢复出生体重时间、住院时间等数据均明显高于非EUGR组(P<0.05),见表2。
2.4呼吸窘迫综合征早产儿EUGR危险因素分析
多因素Logistic回归分析显示,胎龄<31周、多胎、达全量肠内营养时间、喂养不耐受、恢复出生体重时间是呼吸窘迫综合征早产儿EUGR独立危险因素(P<0.05),产前激素应用是呼吸窘迫综合征早产儿EUGR保护因素(P<0.05),见表3。
3讨论
早产是新生儿呼吸窘迫综合征的高危因素,孕28周胎儿肺部内源性肺表面活性物质开始分泌,但其量不足以满足自主呼吸需求,新生儿呼吸窘迫综合征发生率与胎龄密切相关[4]。呼吸窘迫综合征是严重的缺氧性疾病,可能对新生儿的多器官发育造成不良影响。本研究对病例组和对照组临床资料进行比较可见,病例胎龄、出生体重、预防性应用PS率、产前激素应用率均明显低于对照组,胎龄和出生体重有关,胎龄越小,低体重或极低体重儿发生率越高,而呼吸窘迫综合征的病例组患儿胎龄为(32.92±2.18)周,循证资料显示,30~31周的早产儿呼吸窘迫综合征的发生率为52%[5],本研究数据略高于循证研究,说明31周以后的早产儿呼吸窘迫综合征发生风险仍然较高,临床在产前评估时必须格外重视进行预防性干预;病例组体重(2172.93±236.55)g,大部分患儿出生体重<2500 g低体重儿的标准,反映患儿宫内发育可能存在一定程度迟缓,而对宫外各器官功能产生影响;多胎也是造成胎儿宫内发育不良的因素之一,本研究病例组多胎22例,其中有2例属同一3胎,新生儿体重为本组最低,分别为974 g、978 g,胎龄为32+5周,均大于呼吸窘迫综合征高危31周胎龄,由于多胎对其发育的不良影响均发生了呼吸窘迫综合征。
预防性应用PS率、产前激素应用均是新生儿呼吸窘迫综合征预防措施,产前激素应用可以减少新生儿病死率,地塞米松、倍他米松可促进胎肺成熟[6,7],小于35周可能发生早产的孕妇可使用激素进行干预,然而对不同胎龄早产儿仍需进一步循证研究证明,产前反复多疗程激素应用效果及安全性也存在一定争议[8],本研究结果显示,产前激素应用可以使早产儿获益,可降低呼吸窘迫综合征的发生风险,临床针对可能发生早产且胎儿宫内发育成熟度较低的孕妇建议在充分产前评估的基础上给予单个疗程的产前激素干预,最佳时机为产前24 h~7 d[2];预防性应用PS是对高危新生儿在出生后早期给予外源性肺表面活性物质替代性治疗,补充内源性肺表面活性物质不足,可有效减少呼吸窘迫综合征发生[9],本研究两组的预防性应用率均不高,可能与新生儿出生后评估及PS成本有关。
病例组多胎率、宫内窘迫或窒息、羊水吸入、宫内感染、前置胎盘/胎盘早剥、剖宫产、妊娠期高血压病、妊娠期糖尿病发生率均明显高于对照组,这些均属于妊娠期、围产期产妇及胎儿因素,妊娠期产妇发生并发症如高血压、糖尿病对胎儿发生造成不良影响,围产期宫内窘迫或窒息、羊水吸入、宫内感染、前置胎盘/胎盘早剥等不良事件,这可直接导致胎儿缺氧、酸中毒及感染,导致胎肺毛细血管通透性增加,纤维蛋白渗出沉积于肺泡表面阻碍气体弥散抑制肺表面活性物质分泌及活性[10,11],是发生新生儿呼吸窘迫综合征的高危因素;而产道的挤压有益于促进胎儿肺发育,减少新生儿呼吸系统并发症,剖宫产则可能增加早产儿发生呼吸系统并发症几率,不利于新生儿出生质量提高。
呼吸窘迫综合征是否对早产儿宫外发育有影响,相关研究较少,本研究追踪病例组153例患儿和200例非呼吸窘迫综合征早产儿,在出院前进行生长发育评估,结果显示,病例组EUGR发生率为50.98%,严重EUGR发生率为13.73%,明显高于对照组的22.50%和7.00%,说明呼吸窘迫综合征对早产儿宫外发育有明显不良影响。EUGR组胎龄、出生体重、出院时体重、产前激素应用均显著低于非EUGR组,其多胎、剖宫产、SNAPPE-Ⅱ、首次肠内营养时间、达全量肠内营养时间、喂养不耐受、CPAP时间、气管插管、机械通气时间、恢复出生体重时间、住院时间等数据均明显高于非EUGR组。可见宫内窘迫或窒息、羊水吸入、宫内感染、前置胎盘/胎盘早剥、剖宫产、妊娠期高血压病、妊娠期糖尿病等早产儿发生呼吸窘迫综合征相关因素与EUGR无明显关系,胎龄、出生体重、多胎率、产前激素应用等早产儿发生呼吸窘迫综合征相关因素与EUGR相关。而主要的相关因素集中于新生儿出生后喂养和机械通气的影响。肠内营养有助于促进胃肠道功能发育,但由于早产儿胃肠道功能承载力仍不足,肠外营养在早期作为重要的营养支持来源;CPAP为无创正压通气技术在呼吸窘迫综合征的治疗过程发挥重要的作用,在其无效时仍需进行有创机械通气,CPAP时间、气管插管、机械通气时间都反映了患儿呼吸窘迫综合征及其肺部功能不全的严重程度,患儿身体机能差,对营养需求高,但利用率却受到疾病的影响,对宫外发育不利[12]。
多因素分析显示,胎龄<31周、多胎、达全量肠内营养时间、喂养不耐受、恢复出生体重时间是呼吸窘迫综合征早产儿EUGR独立危险因素;胎龄<31周、多胎对早产儿发生呼吸窘迫综合征和患儿发生EUGR都有明显不良影响,与宫内发育程度有关;达全量肠内营养时间、喂养不耐受、恢复出生体重时间则是危险因素中相对可控的因素,针对呼吸窘迫综合征患儿喂养应更有针对性,根据患儿营养需求及利用情况制定更合理的营养配方,促进患儿肠内营养的进程,缩短达全量肠内营养时间,减少由于营养配方因素造成的喂养不耐受,相关配方有待进一步研究,而目前,可能延长肠外营养时间,增加肠外营养供给弥补肠内营养缺口可能有利于促进患儿营养利用和发育,改进喂养方式控制进食量、速度、温度促进患儿胃肠道功能恢复,减少喂养不耐受发生,从而提高患儿体重恢复速度,缩短恢复出生体重时间或者实现生长追赶[13]。预防措施中产前激素应用是呼吸窘迫综合征早产儿EUGR保护因素,也可减少早产儿发生呼吸窘迫综合征的风险。
综上所述,早产儿发生呼吸窘迫综合征及患儿发生EUGR有部分相同的因素,胎龄小、多胎对新生儿健康及发育都有不利影响,产前激素应用则可能有一定的改善新生儿预后作用,呼吸窘迫综合征对患儿宫外发育有明显的不良影响,宫外发育主要受到喂养相关因素影响,与妊娠期、围产期等因素无关,提高喂养效率,改善针对呼吸窘迫综合征患儿的喂养方式有助于促进其宫外发育。
[参考文献]
[1] 潘涛,朱秋皎,肖志辉. 双水平正压通气联合早期气管插管-肺表面活性物质-拔管策略治疗早产儿呼吸窘迫综合征的效果[J]. 中华围产医学杂志,2014,17(2):122-125.
[2] 袁琳,Sweet DG,Carnielli V.欧洲新生儿呼吸窘迫综合征防治指南-2010版[J]. 中华儿科杂志,2011,49(1):27-33.
[3] 单红梅,蔡威,陶晔璇. 早产儿宫外生长发育迟缓的评价[J]. 中国临床营养杂志,2005,13(3):150-153.
[4] Jennifer S Landry,Dick Menzies. Occurrence and severity of bronchopulmonary dysplasia and respiratory distress syndrome after a preterm birth[J]. Paediatrics & Child Health,2011,16(7):399-403.
[5] William M Callaghan,Andreea A Creanga,Elena V Kuklina.Severe maternal morbidity among delivery and postpartum hospitalizations in the United States[J]. Obstetrics and Gynecology,2012,120(5):1029-1036.
[6] Evangelia Akoumianaki,Aissam Lyazidi,Nathalie Rey. Mechanical ventilation-induced reverse-triggered breaths:A frequently unrecognized form of neuromechanical coupling[J].Chest,2013,143(4):927-938.
[7] Brian R Jacobs,Vinay Nadkarni,Brahm Goldstein. Nutritional immunomodulation in critically ill children with acute lung injury:Feasibility and impact on circulating biomarkers[J]. Pediatric Critical Care Medicine,2013,14(1):45-56.
[8] 刘敬. 肺脏超声诊断新生儿呼吸窘迫综合征[J]. 中华实用儿科临床杂志,2014,29(18):1438-1440.
[9] 周文莉,周琪,李丛. 早期应用牛肺泡表面活性物质对晚期早产儿及足月儿呼吸窘迫综合征治疗的随机对照研究[J]. 中国当代儿科杂志,2014,16(3):285-289.
[10] 骆娟,蒋虹,李茂军. 肺表面活性物质预防早产儿呼吸窘迫综合征的疗效评价[J]. 实用医院临床杂志,2014, 11(2):77-79.
[11] 杨燕玲,单若冰. 重度新生儿呼吸窘迫综合征死亡危险因素分析[J]. 中国小儿急救医学,2014,21(7):423-426.
[12] 李月凤,刘方,张敏. 极低出生体重儿住院期间营养状况及发生宫外发育迟缓的危险因素[J]. 中华围产医学杂志,2014,17(1):23-28.
[13] 王爱武. 早产儿宫外发育迟缓与血清前清蛋白的关系研究[J]. 重庆医学,2011,40(10):1000-1001.
(收稿日期:2014-12-12)

