RBP4 基因的多态性及其与母猪窝产仔性状的相关性
昌文林,张达军,袁安文,杨青,薛立群*
(1.湖南农业大学a.动物医学院;b.动物科技学院,湖南 长沙 410128;2.益阳市农科所,湖南 益阳 413046)
根据组织结构进行分类,猪胎盘属于典型的上皮绒毛膜型胎盘,因此,供给子宫组织营养的质与量对妊娠过程中胚胎的发育和存活具有重大影响。梅山猪所具有的优秀LS性状种质特征与其子宫组织营养中一些关键组分含量显著相关[1–4]。维生素A影响基因转录、胞外基质合成和多种生长因子及其受体的表达[5]。妊娠第12天母猪子宫腺体和子宫内膜上皮细胞就可合成维生素A的结合蛋白RBP (retinol binding protein),且结合蛋白的合成量随妊娠进程的表达而递增[5]。孕体亦早在妊娠第15天就在滋养层合成RBP,从第25天开始,RPB在子宫腺窝处的高柱状胎盘晕滋养外胚层细胞呈高丰度表达[6–8]。母体视黄醇通过与视黄醇结合蛋白(RBP)结合的形式被分泌到子宫腔中,构成子宫组织营养的重要组份[9–10]。孕体胎盘乳晕滋养层细胞上表达的RBP交换结合子宫RBP携带的视黄醇,实现母胎间的视黄醇转运[11],因此,子宫组织营养中RBP4的质和量通过影响母胎间维生素A的转运效率来对胎儿的发育和抗胁迫保护发挥重要作用,对提高动物多胎性能具有积极意义[12–14]。RBP4基因被视为母猪LS性状的重要候选基因[15]。
RBP4基因中一个Msp Ⅰ RFLP (SNP G1223C)与母猪LS性状显著相关[16–21],但哪一等位基因为LS性状的优势等位基因存在争议[17–21],甚至RBP4 Msp Ⅰ RFLP 是否与LS性状显著相关也存在着不同的研究结论[18,22]。基于这一现象,笔者提出如下假设:在RBP4基因Msp Ⅰ RFLP 位点附近可能存在一个与其连锁的功能性的多态性位点。为此,笔者利用家猪Unigene database中来源广泛的序列资源,进一步对RBP4基因外显子区域的多态性位点进行预测和检验,并对其与LS性状的关联进行统计分析,现将结果报道如下。
1 材料与方法
1.1 样本与数据的采集
分别采集97头大白猪和144头湖南黑猪的耳组织样品,并对应收集大白猪4年间的繁殖记录和湖南黑猪3年的繁殖记录。大白猪来自一个开放–核心育种群的专门化母系群体。湖南黑猪是一个杂合母系群体,具有杜洛克和湘西黑猪桃源地方类群遗传背景。
1.2 方法
1.2.1 RBP4 基因外显子区域SNP 的生物信息学预测
从NCBI Unigene 数据库中分别下载猪RBP4基因的EST序列,删除低质量序列数据。采用在线工具MultAlin[23],以Genebank 中相应基因的参考mRNA(XM_005671295)序列为基准序列进行多序列比对,筛选RBP4外显子区域的候选SNPs(每个等位基因至少在3条以上的不同EST序列中出现时才判读为阳性预测结果)。
1.2.2 基因组DNA 的提取和RBP4 基因片段的扩增
用普通的蛋白酶K消化和苯酚/氯仿法,从母猪耳组织中提取基因组DNA样品作为靶标基因PCR扩增的模板。
RBP4基因片段扩增用引物沿用文献中已经报道的引物或利用Primer 5.0 基于目标基因参考mRNA 序列进行设计,具体序列见表1。引物购自英俊公司(广州)。PCR反应体积为30 μL,各组份用量和浓度分别为:正向和反向引物终浓度分别为0.2 μmol/L,10×反应缓冲液(不含Mg2+)3 μL,Mg2+浓度为2 mmol/L,dNTPs混合物浓度为0.2 μmol/L,Taq DNA聚合酶用量为1.5 U (MBI,USA),DNA模板添加量为100 ng。PCR反应条件:94℃预变性4min;94℃下模板变性30 s,55℃下引物与模板退火30 s,72℃下延伸30 s,35个扩增循环;72℃下延伸10min,然后降温到4℃结束扩增反应。利用1.5%的琼脂糖凝胶检测PCR产物。–20℃保存PCR产物用于后续基因分型。

表1 RBP4基因SNPs检测的2对PCR引物序列 Table 1 Two pairs of PCR primer for SNPs detection in RBP4gene
1.2.3 多态性位点验证和个体基因分型
利用PCR RFLP对湖南黑猪和大白猪群体各母畜的RBP4 SNPs位点进行个体基因型检测和验证。特异性限制性内切酶MspⅠ和Eco 24Ⅰ购自美国MBI公司。酶切反应体积为10 μL,其中PCR产物添加量为3 μL。酶切反应各有效组份和反应温度按照产品操作手册确定。酶切反应时间为16 h。4℃终止酶切消化后,取5 μL酶切后产物进行2.5%的琼脂糖凝胶电泳,判读母畜个体的基因型。采取Msp RFLPⅠ 对RBP4 SNP G1223C进行基因分型。采用Eco 24 RFLPⅠ 对SNP G1027A进行个体基因分型。
1.3 数据统计
统计分析中的LS性状包括窝产仔数(TNB,total number born)和产活仔数(NBA,number born alive)。利用fastPHASE构建RBP4基因的单倍型,并对单倍型与母畜LS性状进行相关性分析。利用SAS8.0(SAS Institute,Inc.,Cary,NC,USA)一般线性模型,比较各基因型母猪对应的产仔性状的最小二乘均数,从而进行基因型与性状间的相关性分析。对TNB或NBA的统计模型中,包括的固定效应有窝次、品种/系、基因型和品系互作效应。母猪效应和残留效应被视为随机效应。统计模型为:性状表现型效应=群体均数+基因型效应+品种效应+胎次效应+残差。
通过纯合子母体的性状值比较来估计加性遗传效应(c,additivegenetic effect)。显性遗传效应(d dominantgenetic effect)估计为杂合子与2种纯合子的平均值之差,并用t–检验对遗传效应进行显著性检测。
2 结果与分析
2.1 RBP4 外显子区域基因候选SNPs
根据EST多序列比对结果,预测 RBP4基因(NC_010456.4)外显子区域存在5个候选SNPs(表2),其 中 有3个SNPs 是 在RBP4 基 因CDS(coding sequence)区(2个是错义突变,1个为同义突变)。预测结果还显示,同义突变A1027G(图1–B)与已报道的RBP4基因Msp ⅠR FLP(图1–A,由内含子2中SNP G1223C产生)临近,位于近临的外显子3中,与RBP4基因SNP G1223C紧密连锁。
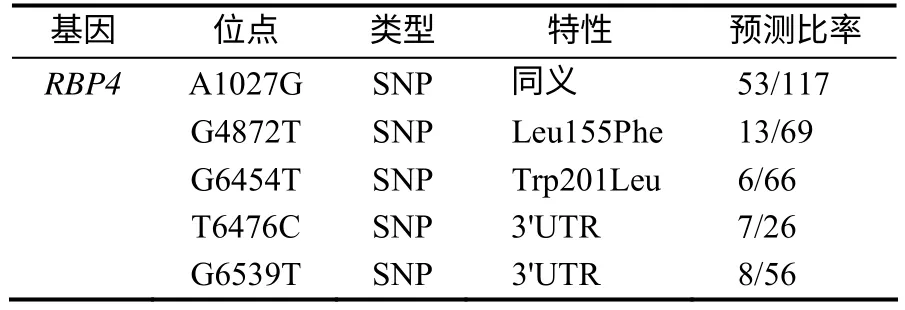
表2 RBP4(NC_010456.4)基因外显子区的候选SNPs Table 2 Candidate SNPs of RBP4gene at exonic zone

图1 RBP4 Msp Ⅰ RFLP 和Eco 24 ⅠR FLP琼脂糖凝胶电泳结果 Fig.1 Results of agrosegel electrophoresis for RBP4 G1223C and G1027Agenotyping
2.2 RBP4 基因SNP G1223C 与母猪LS 性状的相关性
RBP4 SNP G1223C与湖南黑猪和大白猪母猪LS性状显著相关(表3)。在湖南黑猪群体中,GG基因型母体的TNB和NBA都显著高于CC基因型母体(P<0.05),杂合型母体的性状值居于2种纯合基因型个体的平均值之间;基因加性效应每个窝次达0.7个仔猪(P<0.05)。在大白猪群体中,GG基因型母猪比CC基因型母体每窝次平均多产0.94头仔猪,但是CC纯合型和杂合型个体LS性状值间的差异无统计学意义。

表3 猪RBP4 基因 SNP G1223C 与母猪LS 性状的相关性分析结果 Table 3 Correlation analysis between SNP G1223C and LS traits of sow
2.3 RBP4 基因SNP G1027A 与母猪LS 性状的相关性
统计分析结果(表4)表明,对于TNB和NBA这2项指标,湖南黑猪群体RBP4 G1027A位点各基因型母畜对应的性状值均表现出AA纯合子母体最优、杂合子次之的趋势,但在本试验检测群体中,各基因型性状值的差异无统计学意义;2种纯合基因型母畜平均TNB和NBA的差值分别达每窝次0.71、0.60头。在大白猪群体中,这种差异不明显。2个动物群体数据的合并分析结果显示,SNP G1027A与母猪LS性状显著相关(P<0.05),并在TNB和NBA性状平均值上都表现为AA纯合子最优、GA杂合子次之的趋势。基因加性效应中等,在TNB和NBA上分别估值为0.375和0.385。与GG纯合子相比,优势等位基因A为AA纯合基因型母畜在TNB和NBA上平均每窝次分别多贡献了0.72和0.77头 (P<0.05) 。

表4 RBP4 基因SNP G1027A 与母猪LS 性状的相关性分析结果 Table 4 Correlation analysis between RBP4 SNP G1027A and LS traits of sow
2.4 RBP4 基因单倍型和母猪LS 性状的相关性
基于RBP4 SNPs G1027A与G1223C的个体基因分型结果,利用软件fastPHASE[24]分析大白猪群体和湖南黑猪群体的单倍型结果,再对单倍型与母畜LS性状进行相关性分析的结果(表5)表明,RBP4基因单倍型与母猪LS性状呈显著相关。在2个群体中,RBP4基因AG单倍型都表现出较优秀的LS性状值。与AC、GG和GC单倍型相比,湖南黑猪AG单倍型在TNB上每窝次分别多1.21、1.21和1.85(P<0.05)头仔猪,而大白猪群体中每窝次分别多1.08(P<0.05)、0.96(P<0.05)、1.38(P<0.05)头仔猪。在NBA表现上,湖南黑猪的AG单倍型相对于AC、GG和GC单倍型每 窝次 分 别 多1.51(P<0.05) 、 1.45(P<0.05) 和1.97(P<0.01)头仔猪,大白猪群体中每窝次分别多0.39、0.58和1.23 (P<0.01)头仔猪。2个动物群体的合并分析结果显示,母畜LS性状表现从高到低依次为 AG、AC、GG、GC。优势单倍型AG在TNB上相对于另3种单倍型每窝次分别表现出0.66、0.94 (P<0.05)、1.36 (P<0.01)头仔猪;优势单倍型AG在NBA上相对于另3种单倍型每窝次分别表现出0.39、0.58、1.23 (P<0.01)头仔猪的优势。

表5 由RBP4基因SNPs G1027A和G1223C构建的单倍型与母猪LS性状的相关性分析结果 Table 5 Correlation analysis between the constructed haplotypes (based on RBP4gene SNPs G1027A and G1223C )and LS traits of sow
3 结论与讨论
动物分子育种的一个重要目标就是发现家畜重要经济性状的内在遗传调控机制,发现相关的主效基因,进一步开发出可以有效实现性状遗传改进的分子标记[16,25]。Rothchild等[15]首先在RBP4基因开发了一个Msp RFⅠ LP标记,并基于对6个品系共 1 300头母猪和对应的2 755个窝次的分析,证明其与母畜LS性状显著相关,并发现等位基因A为LS性状优势等位基因。本研究在大白猪和湖南黑猪群体中也得到了类似的结果,进一步证实RBP4基因Msp Ⅰ RFLP 标记检测中等位基因A为LS性状有利等位基因。SNP G1027A是一个同义SNP,这一多态性位点以高频率状态存在于所检测的湖南黑猪和大白猪群体中,性状相关性分析结果表明RBP4 Msp Ⅰ RFLP是一个有价值的LS性状相关分子标记。
RBP4基因单倍型与母猪LS性状相关性分析的结果进一步表明,采用SNPs G1027A和G1223C (RBP4 Msp Ⅰ RFLP)2个位点的单倍型进行选择,可以预期获得更大的LS性状选择进展。本研究结果显示,RBP4基因G1027A和G1223C组成的单倍型在对应LS性状上的表现从高到低依次为AG,AC,GG和GC,单倍型AG在TNB和NBA性能水平上显现出相对优势。
[1] Christenson R K.Ovulation rate and embryonic survival in Chinese Meishan and white crossbred pigs[J].J Anim Sci,1993,71:3060–3066.
[2] Vallet J L,Christenson R K,Klemcke H G.Purification and characterization of intrauterine folate-binding proteins from swine[J].Biol Reprod,1998,59:176–181.
[3] Vallet J L,Christenson R K,Trout W E,et al.Conceptus,progesterone,and breed effects on uterine protein secretion in swine[J].J Anim Sci,1998,76:2657–2670.
[4] Wilson M E,Biensen N J,Youngs C R,et al. Development of meishan and yorkshire littermate conceptuses in either a meishan or yorkshire uterine environment to day 90 ofgestation and to term[J].Biol Reprod,1998,58:905–910.
[5] Yelich J V,Pomp D,Geisert R D.Detection of transcripts for retinoic acid receptors,retinol-binding protein,and transforminggrowth factors during rapid trophoblastic elongation in the porcine conceptus[J].Biol Reprod,1997,57:286–294.
[6] Johansson S,Dencker L,Dantzer V. Immunohisto- chemical localization of retinoid binding proteins at the materno-fetal interface of the porcine epitheliochorial placenta[J].Biol Reprod,2001,64:60–68.
[7] Harney J P,Smith L C,Simmen R C,et al. Retinol-binding protein:Immunolocalization of protein and abundance of messenger ribonucleic acid in conceptus and maternal tissues during pregnancy in pigs[J].Biol Reprod,1994,50:1126–1135.
[8] Harney J P,Mirando M A,Smith L C,et al. Retinol- binding protein:A major secretory product of the pig conceptus[J].Biol Reprod,1990,42:523–532.
[9] Clawitter J,Trout W E,Burke M G,et al.A novel family of progesterone-induced,retinol-binding proteins from uterine secretions of the pig[J].J Biol Chem,1990,265:3248–3255.
[10] Stallings-Mann M L,Trout W E,Roberts R M.Porcine uterine retinol-binding proteins are identicalgene products to the serum retinol-binding protein[J].Biol Reprod,1993,48:998–1005.
[11] Harney J P,Ott T L,Geisert R D,et al.Retinol-binding proteingene expression in cyclic and pregnant endometrium of pigs,sheep,and cattle[J].Biol Reprod,1993,49:1066–1073.
[12] Vallet J L.Uteroferrin induces lipid peroxidation in endometrial and conceptus microsomal membranes and is inhibited by apotransferrin,retinol binding protein,and the uteroferrin-associated proteins[J].Biol Reprod,1995,53:1436–1445.
[13] Lindemann M D.Supplemental folic acid:A requirement for optimizing swine reproduction[J].J Anim Sci,1993,71:239–246.
[14] Vallet J L,Smith T P,Sonstegard T,et al.Isolation of complementary deoxyribonucleic acids encoding putative secreted and membrane-bound folate binding proteins from endometrium of swine[J].Biol Reprod,1999,61:372–379.
[15] Rothschild M F,Messer L,Day A,et al.Investigation of the retinol-binding protein 4 (RBP4)gene as a candidategene for increased litter size in pigs[J]. Mamm Genome,2000,11:75–77.
[16] Katska-Ksiazkiewicz L,Lechniak-Cieslak D,Korwin- Kossakowska A,et al.Genetical and biotechnological methods of utilization of female reproductive potential in mammals[J].Reprod Biol,2006,6(Suppl 1):21–36.
[17] Terman A,Kmiec M,Polasik D,et al.Retinol binding protein 4gene and reproductive traits in pigs[J]. Arch Tierz,Dummerstorf,2007(7):181–185.
[18] 公维华,唐中林,崔文涛,等.猪RBP1 和RBP4 基因的定位、组织表达谱和多态[J].农业生物技术学报,2007,15:729–734.
[19] 罗仍卓么,王立贤,孙世铎.北京黑猪RBP4 基因与繁殖性状的关联分析[J].畜牧兽医学报,2008,39(5):536–539.
[20] Dall'Olio S,Fontanesi L,Buttazzoni L,et al.Association study between single nucleotide polymorphisms in candidategenes and reproduction traits in Italian Large White sows[J].Livestock Science,2013,155:172–179.
[21] Do C H,Cho B W,Lee D H.Study on the prolactin receptor 3 (PRLR3)gene and the retinol-binding protein 4 (RBP4)gene as candidategenes for production traits in berkshire pigs[J].Asian-Australas J Anim Sci,2012,25:183–188.
[22] Drogemuller C,Hammann H,Distl O.Candidategene markers for litter size in different German pig lines[J].J Anim Sci,2001,79(10):2565–2570.
[23] Corpet F.Multiple sequence alignment with hierarchical clustering[J].Nucleic Acids Res,1988,16(22):10881– 10890.
[24] Scheet P,Stephens M.A fast and flexible statistical model for large-scale populationgenotype data:Applications to inferring missinggenotypes and haplotypic phase[J].Am J Hum Genet,2006,78:629–644.
[25] Yang S,Li X,Li K,et al.Agenome-wide scan for signatures of selection in Chinese indigenous and commercial pig breeds[J].BMC Genet,2014,15:7.

