植物乳杆菌来源的α-葡萄糖苷酶抑制剂的分离纯化
张欢欢,韩瑨,游春苹,刘振民,郭本恒,吴正钧
(1.乳业生物技术国家重点实验室 光明乳业股份有限公司,上海 200436;2.上海海洋大学 食品学院,上海 201306)
糖尿病是21 世纪主要的公共健康问题之一,2型糖尿病,又称非胰岛素依赖型糖尿病,占糖尿病总数的85%以上,主要特征为胰岛素抵抗,机体对胰岛素敏感性降低,患者体内的胰岛素相对缺乏[1]。2 型糖尿病可选择α-葡萄糖苷酶抑制剂、胰岛素增敏剂、促胰岛素分泌剂等多种方式来对餐后血糖进行调控。α-葡萄糖苷酶抑制剂以其相对较好的调控作用,已成为比较成熟的治疗糖尿病首选药物,广泛应用于临床。其作用机制为:竞争性抑制位于小肠的各种α-葡萄糖苷酶[2-3]。
天然来源的α-葡萄糖苷酶抑制剂主要来自动植物、微生物。与动植物来源相比,微生物来源的α-葡萄糖苷酶抑制剂报道相对较少。自然界中的微生物资源丰富,目前临床使用的3 种葡萄糖苷酶抑制剂:阿卡波糖、米格列醇及伏格列波糖都与微生物有关[4-5]。目前乳酸菌防治糖尿病的功能已受到高度重视,乳业生物技术国家重点实验室韩瑨等研究表明,植物乳杆菌ST-III 发酵大豆豆浆发酵液具有显著的α-葡萄糖苷酶抑制作用[6],但是没有对α-葡萄糖苷酶抑制剂进行进一步的研究及其分离纯化。
色谱法是一种常用的物质分离和分析方法,其基本原理是利用混合物中各组分在同一基质上的吸附或溶解性能的不同,或和其它亲和作用性能的差异,使混合物的溶液流经该种物质,进行反复的吸附或分配等作用,从而将各组分分开。本研究采用薄层色谱法、硅胶柱色谱法、高效液相色谱法对植物乳杆菌ST-III 发酵豆浆中α-葡萄糖苷酶抑制剂进行分离提纯。
1 实验部分
1.1 材料与仪器
植物乳杆菌ST-III(L.plantarum CGMCC0847),在MRS 琼脂上传代培养,采用添加15%(v/v)甘油的MRS 肉汤于- 80 ℃保存;MRS 培养基;大豆(Glycine max Merrill),从本地市场采购;α-葡萄糖苷酶(E.C 3.2.1.20)、pNPG(4-硝基酚-α-D-吡喃葡萄糖苷)、阿卡波糖,均购于美国Sigma 公司;乙酸乙酯、正己烷、甲醇均为分析纯;硅胶预制板(H 型,10 cm×20 cm);硅胶,200 ~300 目。
J-30I 高速冷冻离心机;PHS-25 型pH 计;HD-3型紫外检测仪;Laborota4000 旋转蒸发仪。
1.2 实验方法
1.2.1 α-葡萄糖苷酶抑制剂体外测定模型的建立
将Pierre C 等[7]使用的以PNPG 为底物的α-葡萄糖苷酶抑制剂体外筛选模型加以改良,主要步骤如下:取100 μL 待测样品于1.5 mL EP 管,接着加入50 μL α-葡萄糖糖苷酶(100 mU/mL),混匀,37 ℃温育15 min,然后加入80 μL PNPG(2 mmol/L),混匀,37 ℃反应15 min,最后加入80 μL(0.2 mol/L)Na2CO3终 止 反 应,再 离 心 2 min (4 ℃、10 000 r/min),取200 μL 上清液于96 孔微孔板,在405 nm 波长下用Spectra Max M5 多功能酶标仪(美国Molecular Devices 公司)测定吸光度值。
平行实验3 次,取平均值。代入以下公式计算α-葡萄糖苷酶抑制剂抑制率。同时以阿卡波糖作为阳性对照进行模型的验证。

阴性对照组为0.1 mol/L、pH=6.8 的磷酸盐缓冲液(PBS)替代待测样品;阴性空白组为PBS 替代阴性对照组中的α-葡萄糖苷酶;样品空白组为PBS替代样品组中的α-葡萄糖苷酶。
1.2.2 α-葡萄糖苷酶抑制剂粗提液的制备 发酵样品的制备:将植物乳杆菌ST-III 接入到固形物含量5%(w/w)的豆浆中,37 ℃静置培养24 h 后取出,发酵豆浆→沸水浴10 min →离心(4 ℃,10 000 r/min,15 min)→上清液经乙酸乙酯萃取→取酯相并旋转蒸发浓缩直至蒸干,之后加一定量的乙酸乙酯配成质量浓度为40 mg/mL 的α-葡萄糖苷酶抑制剂粗提液,以备后续分离研究。
1.2.3 豆浆对α-葡萄糖苷酶的抑制作用研究 将固形物含量5%(w/w)的豆浆37 ℃静置24 h 后取出,豆浆→沸水浴 10 min →离心(4 ℃,10 000 r/min,15 min)→取上清液旋转蒸发至质量不再减少→加蒸馏水配成质量浓度为50 mg/mL 的溶液,作为溶液S1。
将植物乳杆菌ST-III 接入到固形物含量5%(w/w)的豆浆中,37 ℃静置培养24 h 后取出,发酵豆浆→沸水浴10 min→离心(4 ℃,10 000 r/min,15 min)→取上清液旋转蒸发至质量不再减少→加蒸馏水配成质量浓度为50 mg/mL 的溶液,作为溶液S2。
分别将溶液S1 和S2 调pH 至6.8 后,测α-葡萄糖苷酶抑制率。
1.2.4 薄层层析(TLC)分析 采用H 型硅胶预制板(10 cm×20 cm),对上一步制备的粗提液用不同的展开剂组合进行薄层层析,反复实验,碘缸显色,找出最优分离时的展开剂组合。
1.2.5 硅胶柱分离 称取硅胶200 g 溶于适量的乙酸乙酯-正己烷(2∶3,v/v)混合体系中,制成硅胶匀浆。将匀浆慢慢倒入玻璃柱(45 mm ×300 mm)中装柱。装好的硅胶柱用乙酸乙酯-正己烷(2 ∶3,v/v)混合体系进行平衡,流速控制在1 mL/min,平衡一个柱体积后干法上样:取浓度为40 mg/mL,1.5 mL α-葡萄糖苷酶抑制剂粗提液于研钵中,加入1.0 g硅胶,充分研磨,至硅胶粉变得干燥均匀后,倒入称量纸中,然后缓缓均匀倒入硅胶柱上表面,确保样品加入后硅胶柱上表面平整。上样后按乙酸乙酯-正己烷(2∶3,v/v)、乙酸乙酯-正己烷(3∶2,v/v)、乙酸乙酯-正己烷(4∶1,v/v)梯度洗脱,每个梯度洗脱一个柱体积。样品洗脱开始后,用自动收集器开始收集,每6 min 收集1 管。收集的洗脱液经减压去除有机溶剂后,每管加0.5 mL 超纯水溶解,测试其对α-葡萄糖苷酶的抑制作用。
1.2.6 高效液相色谱检验样品纯度 将获得的活性抑制组分用超纯水溶解进行HPLC 检测。
1.2.7 半抑制率测定 对分得活性抑制组分样品进行冻干后用超纯水配成不同浓度,测定不同浓度的抑制率,得出半抑制率(IC50)值,并和阿卡波糖比较。
1.2.8 质谱检测 将分得活性抑制组分样品采用AB4800MALDI-TOF-TOF 质谱仪测定其分子量。
2 结果与讨论
2.1 豆浆对α-葡萄糖苷酶的抑制作用研究
溶液S1、S2 的α-葡萄糖苷酶抑制率结果见表1。
由表1 可知,没有接入植物乳杆菌ST-III 的豆浆经过一些处理后的溶液S1 对α-葡萄糖苷酶没有明显的抑制作用,而含有同样固形物的豆浆接入植物乳杆菌ST-III 后经过相同处理后的溶液S2 具有显著的α-葡萄糖苷酶抑制作用,由此可以得知,本研究中要分离的目标活性物质是植物乳杆菌ST-III在豆浆生长环境中产生的,并非来自豆浆本身。

表1 溶液S1、S2 的α-葡萄糖苷酶抑制率Table 1 The inhibitory effect to alpha-glucosidase of solution S1 and S2
2.2 薄层层析结果
TLC 结果显示,α-葡萄糖苷酶抑制剂粗提液在乙酸乙酯∶正己烷=4∶1 时,分离效果最好,碘缸显色结果见图1。

图1 α-葡萄糖苷酶抑制剂粗提物TCL 结果Fig.1 TCL profile of α-GI crude extract
对图1 中1、2、3 所标示的3 个斑点的硅胶在未经碘缸显色时小心刮下,经过甲醇溶解、离心取上清液、蒸干等步骤后,把干物质用超纯水溶解配成0.5 mg/mL溶液,调pH 至6.8 后进行抑制率测定,结果见表2。

表2 TLC 不同斑点所示物质对α-葡萄糖苷酶的抑制率Table 2 The inhibitory effect to alpha-glucosidase of different fractions in corresponding TLC spots
由表2 可知,1 号和2 号斑点所对应的物质即为分离提纯的目标物。
2.3 硅胶柱层析结果
2.3.1 硅胶柱层析后收集的每管样品抑制率的测定结果 样品经硅胶柱层析后,每管洗脱液对α-葡萄糖苷酶的抑制率见图2。

图2 α-葡萄糖苷酶抑制剂抽提物硅胶柱层析结果Fig.2 The eluting profile of the crude alphaglucosidase extract on silica gel column
可以看出34 ~37 管、47 ~52 管两个区域的洗脱物抑制率明显高于其它管数的抑制率,将34 ~37管以及47 ~52 管的样品分别收集、减压去除有机溶剂后,冻干,作为组分F1 和组分F2。
2.3.2 HPLC 检测结果 将组分F1 和F2 用超纯水溶解后配成0. 5 mg/mL 进行HPLC 检测,柱温35.5 ℃;流动相为水;凝胶柱为TSK SW2000 凝胶柱;流速1 mL/min;进样量50.0 μL,结果见图3、图4。

图3 组分F1 经HPLC 检测结果Fig.3 HPLC result of F1

图4 组分F2 经HPLC 检测结果Fig.4 HPLC result of F2
可以看出组分F1 和组分F2 都是纯度较高的单一组分。
2.3.3 半抑制率测定结果 不同浓度的组分F1 和F2 对α-葡萄糖苷酶的抑制作用见图5。
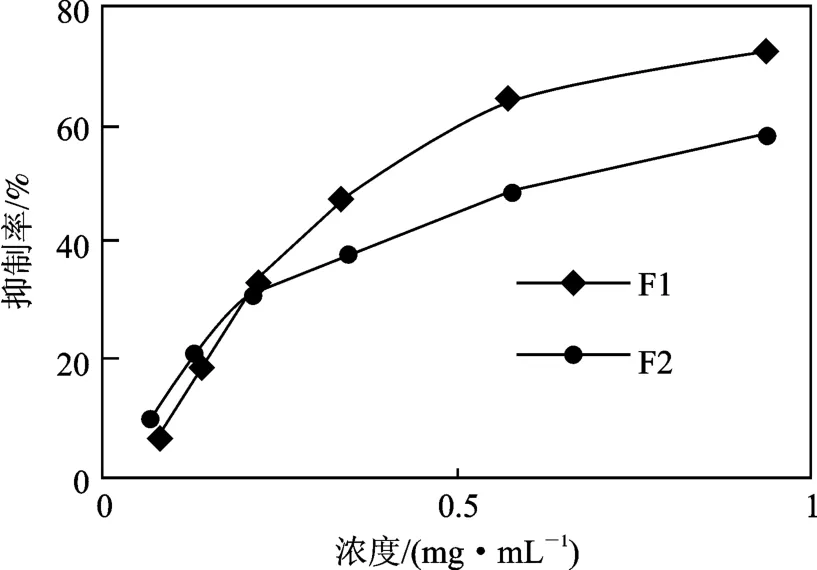
图5 不同浓度组分F1 和F2 对α-葡萄糖苷酶的抑制作用Fig.5 The inhibition to α-glucosidase of F1 and F2 in different concentration
由图5 可知,组分F1 和F2 对α-葡萄糖苷酶均有较强的抑制作用,并且随着浓度的增加,抑制作用增强,说明这两种组分对α-葡萄糖苷酶的抑制作用与它们的浓度之间呈现出明显的剂量效应关系。
表3 是组分F1 和F2 半抑制率的浓度(IC50)及其与阿卡波糖半抑制率的浓度(IC50)的比对,抑制作用越强则其达到半数抑制率所需的浓度越低。结果显示,组分F1 较F2 有更强的抑制作用。

表3 组分F1 和F2 半抑制率浓度(IC50)及与阿卡波糖半抑制率浓度(IC50)对比Table 3 The half inhibition concentration (IC50)of F1,F2 and acarbose to alpha-glucosidase
2.3.4 质谱检测结果 由图6 和图7 可知,组分F1 分子量为271.1,组分F2 分子量为255.1。

图6 组分F1 质谱检测结果Fig.6 Mass spectroscopy result of F1
作为新型抗糖尿病类药物,α-葡萄糖苷酶抑制剂(α-GI)目前已在临床上被广泛应用于糖尿病的治疗。植物、中草药是α-葡萄糖苷酶抑制剂优良来源[8-9],但由于其含量低或生长周期长,无法进行工业化生产[10]。目前乳酸菌对人体的免疫调控、促进吸收、疾病预防[11]等作用已得到广泛认可,部分乳酸菌对糖尿病的预防和治疗作用在动物及人群试验中取得了良好的效果[12],但关于其活性成分的研究报道较少。本研究对植物乳杆菌ST-III 豆浆发酵液中进行了α-GI 的分离纯化,为乳酸菌的降血糖作用以及其作为新型α-GI 来源的开发提供理论依据。

图7 组分F2 质谱检测结果Fig.7 Mass spectroscopy result of F2
本研究通过TLC 摸索出通过有机溶剂达到最佳分离比例,即α-葡萄糖苷酶抑制剂粗提液在乙酸乙酯∶正己烷=4∶1 时,分离效果最好,之后通过硅胶柱层析得到两个具有显著α-葡萄糖苷酶抑制作用的组分,通过HPLC 检测后发现为纯度较高的单一组分,并通过质谱对这两种组分的分子量进行了测定,测得组分F1 分子量为271.1,组分F2 分子量为255.1。有关α-GI 单一组分的结构还有待通过核磁共振等手段进行进一步的分析鉴定。此外,本研究仅测试了组分F1 和F2 对α-葡萄糖苷酶的抑制作用,其在体内的降血糖活性,还有待通过动物模型进一步研究其在体内对葡萄糖耐受、餐后血糖波动等的影响进行评估,从而为新型降糖药物或功能性食品的开发提供理论依据。
3 结论
植物乳杆菌ST-III 发酵豆浆是一种优良的α-葡萄糖苷酶抑制剂来源,具有潜在的抗高血糖作用。本研究通过硅胶柱层析的方法从植物乳杆菌ST-III发酵豆浆中α-GI 进行分离提纯,得到两种纯度较高的单一组分,其对α-葡萄糖苷酶抑制作用的IC50分别为0.41 mg/mL(F1)和0.65 mg/mL(F2),进一步通过质谱分析,确定了两种组分的分子量为271.1(F1)和255. 1(F2),但是其结构还有待进一步研究。
[1] King H,Rewers M.Diabetes in adults is now a third world problem. The WHO Ad Hoc Diabetes Reporting Group[J].Bulletin of the World Health Organization,1991,69(6):643.
[2] Levetan C.Oral antidiabetic agents in type 2 diabetes[J].Current Medical Research and Opinion ,2007,23(4):945-952.
[3] King H,Aubert R E,Herman W H.Global burden of diabetes,1995 ~2025:prevalence,numerical estimates,and projections[J].Diabetes Care,1998,21(9):1414-1431.
[4] Balitz D,Bush J,Bradner W,et al.Isolation of lavendamycin. A new antibiotic from Streptomyces lavendulae[J].The Journal of Antibiotics,1982,35(3):259-265.
[5] Campbell R K,Campbell L K,White J R. Insulin lispro:its role in the treatment of diabetes mellitus[J].Annals of Pharmacotherapy,1996,30(11):1263-1271.
[6] 韩瑨,季红,周方方,等. 产α-葡萄糖苷酶抑制剂乳酸菌的筛选及发酵条件优化[J].天然产物研究与开发,2013,25(3):302-306.
[7] Chapdelaine P,Tremblay R R,Dube J. P-nitrophenol-alpha-D-glucopyranoside as substrate for measurement of maltase activity in human semen[J]. Clinical Chemistry,1978,24(2):208-211.
[8] Lee S S,Lin H C,Chen C K.Acylated flavonol monorhamnosides,α-glucosidase inhibitors,from Machilus philippinensis[J].Phytochemistry,2008,69(12):2347-2353.
[9] Jong-Anurakkun N,Bhandari M R,Hong G,et al. α-Glucosidase inhibitor from Chinese aloes[J]. Fitoterapia,2008,79(6):456-457.
[10]Chan H H,Sun H D,Reddy M V B,et al.Potent α-glucosidase inhibitors from the roots of Panax japonicus CA Meyer var. major [J]. Phytochemistry,2010,71(11):1360-1364.
[11]Tian J,Zhao Q S,Zhang H J,et al.New cleroindicins from clerodendrum indicum[J]. Journal of Natural Products,1997,60(8):766-769.
[12] Yun S,Park H,Kang J. Effect of Lactobacillus gasseri BNR17 on blood glucose levels and body weight in a mouse model of type 2 diabetes[J]. Journal of Applied Microbiology,2009,107(5):1681-1686.

